|
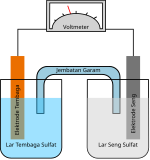
Jembatan garam Jembatan garam, dalam elektrokimia, adalah suatu peralatan laboratorium yang digunakan untuk menghubungkan setengah-sel reduksi dan oksidasi dari suatu sel galvani (sel volta), salah satu jenis sel elektrokimia.[1] Jembatan garam ini menjaga netralitas listrik di antara sirkuit internal, mencegah sel bereaksi dengan cepat menuju kesetimbangan. Jika tidak digunakan jembatan garam, larutan di salah satu setengah-sel akan terkumpul muatan negatif dan larutan di setengah-sel yang lain akan terkumpul muatan positif ketika reaksi berjalan, sehingga dengan cepat mencegah reaksi lebih lanjut, karenanya menghambat produksi listrik.[2] Jembatan garam biasanya terdapat dalam dua jenis: tabung gelas dan kertas saring. PeranDalam sel galvani, aliran arus listrik dipastikan dengan perpindahan elektron dalam sirkuit logam (sirkuit eksternal) dan ion dalam dua setengah-sel. Di antara dua kompartemen sel, larutan kedua sel tersebut saling terhubung oleh jembatan garam yang mengandung pasta semi-padat dari garam seperti kalium klorida (KCl) atau kalium nitrat (KNO3).[3] Kation dan anion dalam jembatan garam dapat bermigrasi ke satu kompartemen atau yang lain untuk memastikan netralitas listrik di kedua kompartemen sel.[4] Di sisi lain, larutan tidak saling bercampur, yang memungkinkan untuk menghindari reaksi redoks yang tidak diinginkan. Selama reaksi redoks, elektron meninggalkan kompartemen satu sel galvani ke sel yang lain, menciptakan perbedaan muatan listrik yang membuat larutan menjadi tidak netral. Tanpa jembatan garam, situasi ini akan menyebabkan berhentinya arus listrik antara dua setengah-sel tersebut.[5] Lihat pulaReferensi
|