|
Kobaltosena
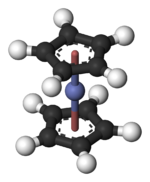
Kobaltosena, dikenal pula sebagai bis(siklopentadienil)kobalt(II) atau "bis Cp kobalt", adalah suatu senyawa organokobalt dengan rumus kimia Co(C5H5)2. Senyawa ini adalah padatan berwarna ungu gelap yang menyublim dengan mudah sedikit di atas suhu kamar. Kobaltosena ditemukan tak lama setelah ferosena, metalosena pertama. Karena mudahnya bereaksi dengan oksigen, senyawa tersebut harus ditangani dan disimpan menggunakan teknik bebas udara. SintesisKobaltosena disiapkan oleh reaksi antara natrium siklopentadienida (NaC5H5) dengan kobalt(II) klorida anhidrat dalam larutan THF. Natrium klorida terbentuk bersama, dan produk organologamnya biasanya dimurnikan dengan penyubliman vakum.[1] Struktur dan pengikatanDalam Co(C5H5)2 pusat Co "tertumpuk" di antara dua cincin siklopentadienil (Cp). Panjang ikatan Co–C adalah sekitar 2.1 Å, agak lebih panjang dibanding ikatan Fe–C dalam ferosena.[2] Co(C5H5)2 termasuk dalam golongan senyawa organologam yang disebut sebagai metalosena atau senyawa sandwich.[3] Kobaltosena memiliki 19 elektron valensi, kelebihan satu dari yang biasanya ditemukan dalam kompleks logam organotransisi, seperti ferosena, yang relatif sangat stabil. (Lihat aturan 18 elektron.) Elektron tambahan ini menempati orbital yang anti ikatan terhadap ikatan Co–C. Akibatnya, jarak Co–C agak lebih panjang dibanding ikatan Fe–C dalam ferosena. Banyak reaksi kimia Co(C5H5)2 dicirikan oleh kecenderungannya untuk kehilangan elektron "ekstra" ini, menghasilkan kation 18-elektron yang dikenal sebagai kobaltosenium: Kerabat dekat kobaltosena, rodosena tidak terdapat sebagai monomer, tetapi secara spontan terdimerisasi oleh pembentukan suatu ikatan C–C antara cincin Cp. ReaksiSifat redoksCo(C5H5)2 adalah agen pereduksi satu-elektron umum di laboratorium.[4] Bahkan, reversibilitas dari pasangan redoks Co(C5H5)2 begitu berperilaku baik sehingga Co(C5H5)2 dapat digunakan dalam voltametri siklik sebagai standar internal.[5] Senyawa analog terpermetilasinya dekametilkobaltosena (Co(C5Me5)2) adalah zat pereduksi yang sangat kuat, karena sumbangan induktif kerapatan elektron dari 10 gugus metil, mendorong kobalt untuk melepaskan elektron "ekstra"nya bahkan lebih. Kedua senyawa ini adalah contoh langka reduktor yang larut dalam pelarut organik non-polar. Berikut adalah potensial reduksi dari senyawa ini, menggunakan pasangan ferosena-ferosenium sebagai referensi:[6]
Data menunjukkan bahwa senyawa dekametil berada sekitar 600 mV lebih mereduksi daripada metalosena induknya. Efek substituen ini, bagaimanapun, dibayangi oleh pengaruh logam: perubahan dari Fe ke Co menjadikan reduksi lebih disukai dengan lebih dari 1.3 volt. KarbonilasiPerlakuan Co(C5H5)2 dengan karbon monoksida menghasilkan turunan kobalt(I) Co(C5H5)(CO)2, seiring dengan hilangnya satu ligan Cp.[1][7] Lihat pulaReferensi
Pranala luarWikimedia Commons memiliki media mengenai Kobaltosena.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||