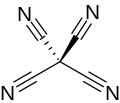
Tetrasianometana atau karbon tetrasianida adalah sebuah senyawa organik dengan rumus kimia C(CN)
4. Senyawa ini adalah sebuah persianoalkana, juga sebuah karbon nitrida molekuler. Struktur senyawa ini dapat dianggap sebagai metana dengan semua atom hidrogen digantikan oleh gugus sianida. Ia pertama kali dibuat oleh Erwin Mayer pada tahun 1969.[2][3]
Sifat
Tetrasianometana memiliki wujud padat pada suhu kamar. Ia terurai pada suhu 160 °C tanpa melebur, dan meskipun dapat berwujud uap encer, tidak ada wujud cair yang diketahui untuknya.[2]
Molekul tetrasianometana memiliki simetri tetrahedral (43m atau Td). Molekulnya mempunyai jarak C-C sebesar 1,484 Å dan C-N sebesar 1,161 Å dalam wujud gas. Pada wujud padat, ikatan C≡N memendek menjadi 1,147 Å.[3] Ikatan C-C memiliki konstanta gaya sebesar 4,86×105 dyn/cm yang sedikit lebih besar dibandingkan ikatan C-Cl pada karbon tetraklorida, namun sedikit lebih lemah dibandingkan pada ion trisianometanida.[4] Pada tekanan lebih dari 7 GPa, tetrasianometana mulai berpolimerisasi membentuk padatan jaringan kovalen yang tidak terorganisir. Pada tekanan yang lebih tinggi, warna putih[1] akan menguning dan kemudian menggelap menjadi hitam. Pada tekanan lebih dari 20 GPa, polimerisasinya sudah berada pada total.[5]
Tetrasianometana memiliki modulus kompresi K0 sebesar 4,4 dan turunannya memiliki K0' = 18.[5]
Produksi
Tetrasianometana dapat dibuat dengan mereaksikan sianogen klorida dengan perak trisianometanida.[4]
- ClCN + AgC(CN)
3 → C(CN)
4 + AgCl
Reaksi
Dalam larutan asam dalam air, tetrasianometana dihidrolisis untuk menghasilkan ion trisianometanida dan amonium bersama dengan karbon dioksida. Dalam larutan basa, ion trisianometanida dan sianat akan dihasilkan.[4]
Lihat pula
Referensi
- ^ a b Barnes, D.S.; Mortimer, C.T.; Mayer, E. (Juli 1973). "The enthalpy of formation of tetracyanomethane". The Journal of Chemical Thermodynamics. 5 (4): 481–483. doi:10.1016/S0021-9614(73)80095-3.
- ^ a b Mayer, Erwin (1969). "Darstellung und Eigenschaften von Tetracyanmethan". Monatshefte für Chemie. 100 (2): 462–468. doi:10.1007/BF00904089.
- ^ a b Britton, D. (1 Juli 1974). "The crystal structure of tetracyanomethane, C(CN)4". Acta Crystallographica Section B. 30 (7): 1818–1821. doi:10.1107/S0567740874005863.
- ^ a b c Hester, Ronald E.; Lee, Kenneth Michael; Mayer, Erwin (September 1970). "Tetracyanomethane as a pseudo-(carbon tetrahalide)". The Journal of Physical Chemistry. 74 (18): 3373–3376. doi:10.1021/j100712a011.
- ^ a b Keefer, Derek W.; Gou, Huiyang; Wang, Qianqian; Purdy, Andrew; Epshteyn, Albert; Juhl, Stephen J.; Cody, George D.; Badding, John; Strobel, Timothy A. (12 Februari 2018). "Tetracyanomethane under Pressure: Extended CN Polymers from Precursors with Built-in sp3 Centers". The Journal of Physical Chemistry A. 122 (11): 2858–2863. Bibcode:2018JPCA..122.2858K. doi:10.1021/acs.jpca.7b10729. OSTI 1430339. PMID 29432685.
Garam dan turunan kovalen dari ion sianida |
|---|
| HCN
|
|
|
|
He
|
| LiCN
|
Be(CN)
2
|
B(CN)3
|
C(CN)4
C2(CN)2
|
NH
4CN, N
3CN
|
OCN−
,
-NCO
O(CN)
2
|
FCN
|
Ne
|
| NaCN
|
Mg(CN)
2
|
Al(CN)
3
|
Si(CN)
4,
(CH
3)
3SiCN
|
P(CN)
3
|
SCN−
,
-NCS,
(SCN)
2,
S(CN)
2
|
ClCN
|
Ar
|
| KCN
|
Ca(CN)
2
|
|
Sc(CN)
3
|
Ti
|
V
|
Cr(CN)63−
|
Mn
|
Fe(CN)2,
Fe(CN)64−,
Fe(CN)63−
|
Co(CN)
2
|
Ni(CN)
2
Ni(CN)42−
Ni(CN)44−
|
CuCN
|
Zn(CN)
2
|
Ga(CN)
3
|
Ge(CN)
2
Ge(CN)
4
|
As(CN)
3,
(CH
3)
2AsCN
|
SeCN−
(SeCN)
2
Se(CN)
2
|
BrCN
|
Kr
|
| RbCN
|
Sr(CN)
2
|
|
Y(CN)
3
|
Zr
|
Nb
|
Mo(CN)84−
|
Tc
|
Ru
|
Rh
|
Pd(CN)
2
|
AgCN
|
Cd(CN)
2
|
In(CN)
3
|
Sn(CN)
2
|
Sb(CN)
3
|
Te(CN)
2
Te(CN)
4
|
ICN
|
Xe
|
| CsCN
|
Ba(CN)
2
|
*
|
Lu(CN)
3
|
Hf
|
Ta
|
W(CN)84−
|
Re
|
Os
|
Ir
|
Pt(CN)42-,
Pt(CN)64-
|
AuCN,
K[Au(CN)
2]
|
Hg
2(CN)
2,
Hg(CN)
2
|
TlCN
|
Pb(CN)
2
|
Bi(CN)
3
|
Po
|
At
|
Rn
|
| Fr
|
Ra
|
**
|
Lr
|
Rf
|
Db
|
Sg
|
Bh
|
Hs
|
Mt
|
Ds
|
Rg
|
Cn
|
Nh
|
Fl
|
Mc
|
Lv
|
Ts
|
Og
|
|
|
|
| *
|
La(CN)
3
|
Ce(CN)
3,
Ce(CN)
4
|
Pr
|
Nd
|
Pm
|
Sm(CN)
3
|
Eu(CN)
3
|
Gd(CN)
3
|
Tb
|
Dy(CN)
3
|
Ho(CN)
3
|
Er
|
Tm
|
Yb(CN)
3
|
| **
|
Ac(CN)
3
|
Th(CN)
4
|
Pa
|
UO
2(CN)
2
|
Np
|
Pu
|
Am
|
Cm
|
Bk
|
Cf
|
Es
|
Fm
|
Md
|
No
|
|