| Tetraethylolovo |
|---|
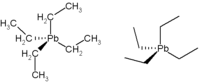 strukturní vzorec tetraethylolova |
| Obecné |
|---|
| Systematický název | tetraethylplumban |
|---|
| Ostatní názvy | tetraethylolovo, TEL |
|---|
| Latinský název | tetraethylplumbium |
|---|
| Anglický název | tetraethyllead |
|---|
| Německý název | Tetraethylblei |
|---|
| Funkční vzorec | (CH3CH2)4Pb |
|---|
| Sumární vzorec | C8H20Pb |
|---|
| Vzhled | bezbarvá kapalina |
|---|
| Identifikace |
|---|
| Registrační číslo CAS | 78-00-2 |
|---|
| EC-no (EINECS/ELINCS/NLP) | 201-075-4 |
|---|
| PubChem | 6511 |
|---|
| ChEBI | 30182 |
|---|
| UN kód | 1649 |
|---|
| SMILES | CC[Pb](CC)(CC)CC |
|---|
| InChI | InChI=1S/4C2H5.Pb/c4*1-2;/h4*1H2,2H3; |
|---|
| Číslo RTECS | TP4550000 |
|---|
| Vlastnosti |
|---|
| Molární hmotnost | 323,44 g/mol |
|---|
| Teplota tání | −136,8 °C |
|---|
| Teplota varu | 108 °C (5,3 kPa)
82 °C (1,73 kPa) |
|---|
| Teplota rozkladu | 200 °C |
|---|
| Hustota | 1,659 g/cm³ (12 °C)
1,652 8 g/cm³ (20 °C) |
|---|
| Dynamický viskozitní koeficient | 0,87 cP (20 °C) |
|---|
| Index lomu | 1,519 8
1,519 5 (20 °C) |
|---|
| Rozpustnost ve vodě | nerozpustný |
|---|
Rozpustnost v nepolárních
rozpouštědlech | alkoholy
ethery
kapalné uhlovodíky |
|---|
| Povrchové napětí | 28,5 mN/m (20 °C) |
|---|
| Struktura |
|---|
| Tvar molekuly | čtyřstěnný |
|---|
| Dipólový moment | 0 Cm |
|---|
| Termodynamické vlastnosti |
|---|
| Standardní slučovací entalpie ΔHf° | 52,7 kJ/mol (kapalina)
109,6 kJ/mol (plyn) |
|---|
| Entalpie varu ΔHv | 167,64 J/g |
|---|
| Bezpečnost |
|---|
 GHS06 GHS06 GHS08 GHS08 GHS09 GHS09
Nebezpečí[1] |
| R-věty | R61 R26/27/28 R33 R50/53 R62 |
|---|
| S-věty | S53 S45 S60 S61 |
|---|
| Teplota vzplanutí | 73 °C |
|---|
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa).
|
Tetraethylolovo je organokovová sloučenina, která se používala jako antidetonační přísada do motorových benzínů. V dnešní době je nahrazováno ferrocenem.
Vlastnosti
Za běžných podmínek jde o bezbarvou kapalinu. Zpomaluje hoření benzínu, a proto se používalo ke zvyšování oktanového čísla automobilových benzínů. Jde o těkavou toxickou látku dobře rozpustnou v tucích, která snadno proniká kůží, ale také se rychle a prakticky úplně vstřebává ze vzduchu v plicích. V játrech se metabolizuje na toxické trietylolovo.[2]
Výroba a spalování
Slitina Na+Pb reaguje s chlorethanem za vzniku tetraethylolova, olova a chloridu sodného.
- 4 NaPb + 4 C2H5Cl → Pb(C2H5)4 + 3 Pb + 4 NaCl
Další možností výroby je působení suchého chloridu olovnatého na Grignardovo činidlo.
- 4 C2H5MgI + 2 PbCl2 → 2 MgI2 + 2 MgCl2 + Pb + Pb(C2H5)4
Tetraethylolovo se spaluje za vzniku oxidu uhličitého, vody a olova
- Pb(C2H5)4 + 13 O2 → 8 CO2 + 10 H2O + Pb
Reference
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Související články
Externí odkazy



