|
Διοξείδιο του άνθρακα
Το διοξείδιο του άνθρακα (χημικός τύπος CO2) είναι χημική ένωση που αποτελείται από δύο άτομα οξυγόνου ενωμένα με ομοιοπολικό δεσμό με ένα άτομο άνθρακα. Είναι γραμμικό μόριο χωρίς διπολική ροπή. Περιέχει 27,3 % w/w άνθρακα και 72,7 % w/w οξυγόνο. Μπορεί να αποδοθεί με το συντακτικό τύπο : O=C=O. Είναι αέριο συστατικό της γήινης ατμόσφαιρας, άχρωμο, άοσμο και άγευστο σε κανονικές συνθήκες πίεσης και θερμοκρασίας και επίσης είναι ένα από τα αέρια του θερμοκηπίου. ΠροέλευσηΑποτελεί υποπροϊόν όλων των καύσεων ορυκτών καυσίμων (κάρβουνου, πετρελαίου, βενζίνης, φυσικού αερίου κλπ.), αλλά και του ξύλου, πλαστικών κ.ά. οργανικών ενώσεων. Παράγεται ακόμα από την αποσύνθεση οργανικών ουσιών. Μεγάλες ποσότητες διοξειδίου του άνθρακα εκπέμπονται επίσης από τα ηφαίστεια* και από τις θερμές πηγές αλλά και από τη διάλυση των ανθρακικών πετρωμάτων. Ενωμένο, με τη μορφή ανθρακικών αλάτων, βρίσκεται σε μεγάλες ποσότητες στο στερεό φλοιό της γης. Τα κυριότερα ανθρακικά ορυκτά είναι οι διάφορες ποικιλίες του CaCO3 (ασβεστόλιθοι, ασβεστίτης, μάρμαρο κ.ά.), ο μαγνησίτης MgCO3, ο σιδηρίτης FeCO3, ο δολομίτης CaCO3.MgCO3 κ.ά. Παράγεται επίσης κατά την αναπνοή όλων των φυτών και των ζώων και από τους μύκητες και μικροοργανισμούς που εξαρτώνται άμεσα ή έμμεσα από τα φυτά για την τροφή τους.
Ιστορικά στοιχείαΤο διοξείδιο του άνθρακα ήταν ένα από τα πρώτα αέρια που μελετήθηκε ως συστατικό του αέρα. Τον 17ο αιώνα ο Φλαμανδός χημικός Γιάν Μπατίστ φαν Χέλμοντ (Jan Baptist van Helmont) παρατήρησε ότι όταν καίγεται ο άνθρακας σε κλειστό δοχείο, η μάζα της στάχτης που προκύπτει ήταν πολύ μικρότερη από εκείνη του αρχικού άνθρακα. Η ερμηνεία που έδωσε ήταν ότι ο άνθρακας που έλειπε είχε μεταλλαχθεί σε μια αόρατη ουσία, που την ονόμασε «αέριο» ή «άγριο πνεύμα». Πώς παρασκευάζεταιΤο διοξείδιο του άνθρακα μπορεί να παραληφθεί από την απόσταξη του αέρα. Η μέθοδος αυτή όμως χρησιμοποιείται για την παραγωγή μικρών ποσοτήτων. Εργαστηριακές μέθοδοι1. Με αντίδραση των ανθρακικών ή όξινων ανθρακικών αλάτων με οξέα:
2. Με τη θερμική διάσπαση των ίδιων αλάτων:
Βιομηχανικές παρασκευές1. Με την αναγωγή οξειδίων του σιδήρου από άνθρακα σε υψικαμίνους:
2. Με πύρωση του ασβεστόλιθου στα ασβεστοκάμινα για την παραγωγή ασβέστη (CaO):
3. Με καύση του άνθρακα σε περίσσεια οξυγόνου ή αέρα. Έτσι προκύπτει μίγμα με άλλα αέρια (Ν2, CO) από το οποίο το CO2 απομονώνεται με διάφορες μεθόδους.
5. Με την καύση όλων των καυσίμων που περιέχουν άνθρακα όπως είναι το μεθάνιο (ως συστατικό του φυσικού αερίου), τα διάφορα κλάσματα του πετρελαίου (βενζίνη, diesel, κηροζίνη κλπ.) αλλά και το κάρβουνο και το ξύλο.
6. Ως υποπροϊόν των μονάδων παραγωγής υδρογόνου, όπου το μεθάνιο μετατρέπεται σε CO2 Φυσικές ιδιότητες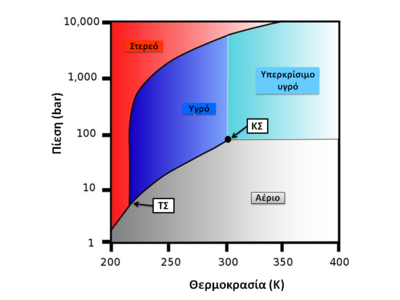 Διάγραμμα φάσεων του CO2 που δείχνει το τριπλό σημείο (ΤΣ) και το κρίσιμο σημείο (ΚΣ) Είναι αέριο άχρωμο και σε μικρές συγκεντρώσεις είναι και άοσμο. Σε κανονικές συνθήκες πίεσης και θερμοκρασίας η πυκνότητα του είναι 1,98 kg/m3, είναι δηλ. 1,5 φορά πυκνότερο του αέρα.
Σε 1 Atm (δηλ. σε πίεση στο επίπεδο της θάλασσας), μετατρέπεται απευθείας σε στερεό, σε θερμοκρασίες κάτω από -78,51 °C και, αν είναι σε στερεή μορφή, εξαχνώνεται πάνω από τους -78,51 °C.
Στη στερεή του κατάσταση, το διοξείδιο του άνθρακα, είναι γνωστό ως «ξηρός πάγος». Χημικές ιδιότητεςΜοριακή δομή Οι διπλοί δεσμοί C=Ο στο μόριο του CO2 είναι διάχυτοι Το μόριο του διοξειδίου του άνθρακα (O=C=O) περιέχει δύο διπλούς δεσμούς, και έχει γραμμική μορφή. Η ενέργεια κάθε δεσμού[1] C=Ο είναι 799 KJ/mol. Χημικές αντιδράσειςΕφόσον στο CO2 ο C έχει αριθμό οξείδωσης +4, είναι όξινο κανονικό οξείδιο και ανυδρίτης του διπρωτικού ανθρακικού οξέος (H2CO3) το οποίο είναι ασταθές οξύ και υπάρχει μόνο με μορφή αλάτων (π.χ. Na2CO3) ή σε υδατικό διάλυμα στα αεριούχα ποτά όπου αποκαθίσταται η ισορροπία : CO2 + H2Ο ⇄ H2CO3. Αντιδρά με βάσεις και ανυδρίτες βάσεων και σχηματίζει ανάλογα με την υπάρχουσα αναλογία mol των αντιδρώντων, δύο σειρές αλάτων, τα όξινα και τα ουδέτερα :
Όταν το CO2 διαβιβάζεται σε διάλυμα ή σε αιώρημα ουδέτερου ανθρακικού άλατος, τότε το μετατρέπει σε όξινο :
Σε κατάλληλες συνθήκες ανάγεται από τον C προς CO και από ορισμένα μέταλλα (K, Na, Mg) προς C :
Ανίχνευση - ποσοτικός προσδιορισμόςΤο CO2 ανιχνεύεται από την ιδιότητά του να σβήνει τη φλόγα και από το ότι σχηματίζει θόλωμα ή ίζημα δυσδιάλυτου ανθρακικού άλατος, όταν διαβιβάζεται σε ασβεστόνερο :
Η αντίδραση με ΚΟΗ (CO2 + 2ΚΟΗ → Κ2CO3 + H2O) χρησιμοποιείται για τον ποσοτικό προσδιορισμό του CO2 σε μίγμα αερίων (δείγμα) : Σε κατάλληλο σκεύος υπάρχει διάλυμα 36 % w/v ΚΟΗ ή 32 % w/v NaOH. Και τα δύο διαλύματα απορροφούν 30/πλάσιο όγκο CO2. Προτιμάται όμως το ΚΟΗ γιατί το σχηματιζόμενο K2CO3 είναι διαλυτό σε διάλυμα ΚΟΗ ενώ το αντίστοιχο Na2CO3 δεν είναι σε διάλυμα NaOH και σχηματίζεται επίπαγος. Στο διάλυμα διοχετεύεται το μίγμα των αερίων που περιέχει το CO2 και από τη μείωση του όγκου προσδιορίζεται τελικά το διοξείδιο του άνθρακα, με την προϋπόθεση βέβαια ότι τα άλλα αέρια του μίγματος δεν αντιδρούν με το ΚΟΗ. Αν οι συγκεντρώσεις του CO2 στο δείγμα είναι μικρές, τότε χρησιμοποιείται διάλυμα Ba(OH)2 και μετά τη διέλευση του δείγματος, ογκομετρείται η περίσσεια του Ba(OH)2. Διαλυτότητα στο νερό Η διαλυτότητα του CO2 (g/L) στο νερό σε συνάρτηση με την πίεση (σε bar) σε διάφορες θερμοκρασίες Η διαλυτότητα του CO2 στο νερό εξαρτάται από πολλούς παράγοντες όπως η πίεση του CO2 σε ισορροπία με το διάλυμα (η διαλυτότητα αυξάνεται με αύξηση της πίεσης), η θερμοκρασία (η διαλυτότητα ελαττώνεται με αύξηση της θερμοκρασίας), το pH (η διαλυτότητα του CO2 αυξάνεται με την αύξηση του pH), η παρουσία άλλων ουσιών (η διαλυτότητα μειώνεται με την παρουσία ενώσεων όπως το χλωριούχο νάτριο, αλλά μπορεί και να αυξηθεί ή να μειωθεί με την αύξηση της συγκέντρωσης των οργανικών ενώσεων). CO2(aq) + H2Ο ⇄ H2CO3 ⇄ HCO3- + H+ ⇄ CO32- + 2H+ Τα ανιόντα του παραπάνω σχήματος αντιδρούν με κατιόντα που πιθανόν υπάρχουν στο νερό, παράγοντας αδιάλυτα άλατα. Έτσι, αν π.χ. υπάρχουν ιόντα Ca2+ ή/και Mg2+ τότε σχηματίζονται αδιάλυτα CaCO3 και MgCO3 τα οποία, δεσμεύοντας τα CO32-, μετατοπίζουν την ισορροπία προς τα δεξιά αυξάνοντας την οξύτητα του νερού. Είναι σημαντικό να σημειωθεί ακόμη ότι το καρβονικό οξύ που παράγεται κατά την διάλυση του CO2 στο νερό είναι ακόμη ένας λόγος που η αύξηση του CO2 από ανθρωπογενείς παράγοντες απειλεί την ισορροπία του οικοσυστήματος, αφού η αυξημένη οξύτητα του νερού προκαλεί προβλήματα στους θαλάσσιους οργανισμούς ΧρήσειςΤο διοξείδιο του άνθρακα χρησιμοποιείται από τη βιομηχανία τροφίμων, τη βιομηχανία πετρελαίου, και τη χημική βιομηχανία. Βρίσκει εφαρμογές σε πολλά καταναλωτικά προϊόντα που απαιτούν πεπιεσμένο αέριο γιατί είναι φθηνό και άφλεκτο, και λόγω του ότι μεταβαίνει από την αέρια φάση στην υγρή σε θερμοκρασία δωματίου και σε χαμηλή, σχετικά, πίεση. Τα σωσίβια γιλέκα συχνά περιέχουν CO2 υπό πίεση. Πωλούνται επίσης μικρές κάψουλες από αλουμίνιο με συμπιεσμένο CO2 για αεροβόλα όπλα, για φούσκωμα των ελαστικών των ποδηλάτων και για την παρασκευή αναβραζόντων δισκίων φαρμάκων. Η ταχεία εξάτμιση του υγρού διοξειδίου του άνθρακα χρησιμοποιείται για ανατινάξεις σε ορυχεία άνθρακα. Οι υψηλές συγκεντρώσεις διοξειδίου του άνθρακα μπορούν επίσης να χρησιμοποιηθούν για την εξολόθρευση επιβλαβών εντόμων, όπως ο σκόρος των ρούχων. ΠοτάΤο διοξείδιο του άνθρακα χρησιμοποιείται για την παραγωγή αεριούχων ποτών και σόδας. Η περιεκτικότητα των ανθρακούχων ποτών σε CO2 οφείλεται σε φυσικούς λόγους (ζύμωση), μπορεί όμως να διοχετευθεί ανθρακικό και με τεχνητούς τρόπους. Σύμφωνα με έρευνες του 2009 από το Πανεπιστημίου της Καλιφόρνια στο Σαν Ντιέγκο και ερευνητών των αμερικανικών Εθνικών Ινστιτούτων Υγείας, τα μόρια διοξειδίου του άνθρακα ενεργοποιούν ένα ένζυμο που υπάρχει στους υποδοχείς της γλώσσας για την γεύση του ξινού, της καρβονική ανυδράση 4, παράγοντας την αίσθηση της αντίστοιχης γεύσης. Επίσης τα μόρια του ενεργοποιούν τους υποδοχείς αφής στο στόμα, αφήνοντας μια χαρακτηριστική αίσθηση.[2] ΤρόφιμαΜια καραμέλα που ονομάζεται Pop Rocks συμπιέζεται με διοξείδιο του άνθρακα περίπου στα 40 bar. Όταν η καραμέλα μπαίνει στο στόμα, διαλύεται και απελευθερώνει φυσαλίδες αερίου. Η μαγιά της αρτοποιίας παράγει διοξείδιο του άνθρακα από τη ζύμωση των σακχάρων στο εσωτερικό της ζύμης, ενώ άλλα προϊόντα, όπως το baking powder και η μαγειρική σόδα, απελευθερώνουν διοξείδιο του άνθρακα όταν θερμαίνονται ή όταν εκτεθούν σε οξέα. ΠυροπροστασίαΤο διοξείδιο του άνθρακα επειδή είναι άφλεκτο χρησιμοποιείται υπό πίεση σε ορισμένους πυροσβεστήρες που είναι σχεδιασμένοι για κατάσβεση πυρκαγιών που οφείλονται σε ηλεκτρικά βραχυκυκλώματα. Επίσης ειδικοί πυροσβεστήρες με CO2 χρησιμοποιούνται και για την πυροπροστασία πλοίων και μηχανοστασίων. Όμως τα συστήματα πυρασφάλειας που βασίζονται στο διοξείδιο του άνθρακα έχουν συνδεθεί και με πολλούς θανάτους. Υδραυλικά συστήματαΤο CO2 είναι ένα από τα πιο συνηθισμένα αέρια που χρησιμοποιούνται κυρίως σε φορητά υδροπνευματικά συστήματα αλλά και σε ρομποτικά συστήματα που χρησιμοποιούν υδραυλικά συστήματα. ΣυγκολλήσειςΤο διοξείδιο του άνθρακα μπορεί να χρησιμοποιηθεί για τη δημιουργία αδρανούς ατμόσφαιρας μέσα στην οποία γίνονται συγκολλήσεις, αν και στις υψηλές θερμοκρασίες που αναπτύσσονται οξειδώνει τα περισσότερα μέταλλα. Η χρήση του στην αυτοκινητοβιομηχανία είναι πολύ συνηθισμένη επειδή είναι πιο φθηνό από το αέριο αργό ή το ήλιο. Πάντως, οι συγκολλήσεις που γίνονται μέσα σε ατμόσφαιρα CO2 είναι πιο εύθραυστες από αυτές που πραγματοποιούνται σε πιο αδρανή ατμόσφαιρα, και με το πέρασμα του χρόνου εξασθενούν λόγω σχηματισμού ανθρακικού οξέος. Απομάκρυνση καφεΐνηςΤο υγρό διοξείδιο του άνθρακα είναι καλός διαλύτης για πολλές λιπόφιλες οργανικές ενώσεις, και χρησιμοποιείται για την αφαίρεση καφεΐνης από τον καφέ : Αρχικά οι πράσινοι κόκκοι καφέ εμποτίζονται με νερό και τοποθετούνται στην κορυφή στήλης ύψους 21 m. Στη συνέχεια, υπερκρίσιμο διοξείδιο του άνθρακα σε υγρή μορφή (περίπου 93 °C) διοχετεύεται από το κάτω μέρος της στήλης με αποτέλεσμα η καφεΐνη να διαχέεται από τους κόκκους μέσα στο διοξείδιο του άνθρακα. Φαρμακευτικές και άλλες χημικές διεργασίεςΤο διοξείδιο του άνθρακα έχει αρχίσει να χρησιμοποιείται στις φαρμακοβιομηχανίες ως λιγότερο τοξική εναλλακτική λύση στη θέση παραδοσιακών διαλυτών όπως είναι το χλωροφόρμιο (CΗCl3) ή άλλες οργανοχλωριωμένες ενώσεις. Επίσης, για τους ίδιους λόγους, χρησιμοποιείται στο ξηρό καθάρισμα των ρούχων στα στεγνοκαθαριστήρια. Στη χημική βιομηχανία, το CO2 χρησιμοποιείται για την παραγωγή ουρίας, ανθρακικών και όξινων ανθρακικών αλάτων και σαλικυλικού νατρίου. Γεωργικές, βιολογικές και ιατρικές εφαρμογέςΤα φυτά χρειάζονται το CO2 για τη φωτοσύνθεση. Λόγω της μικρής ατμοσφαιρικής του συγκέντρωσης, το CO2 είναι πρακτικά ο περιοριστικός παράγοντας της ζωής στη Γη, σε σύγκριση με άλλα δύο εξίσου σημαντικά συστατικά - το νερό και το ηλιακό φως. Εφαρμογές στα λέιζερΟ συνηθέστερος τύπος βιομηχανικού αερίου Λέϊζερ είναι το CO2. Πολυμερή και πλαστικάΤο CO2 μπορεί να συνδυαστεί με το λεμονένιο της φλούδας των πορτοκαλιών ή με άλλα εποξείδια για τη δημιουργία πολυμερών και πλαστικών. Εξόρυξη πετρελαίουΤο διοξείδιο του άνθρακα χρησιμοποιείται στην άντληση του πετρελαίου συνήθως υπό συνθήκες υπερκρίσιμες. Λειτουργεί ταυτόχρονα ως προωθητικό υπό πίεση αλλά και για να μειώσει σημαντικά το ιξώδες του πετρελαίου επιτρέποντας έτσι την καλύτερη και γρηγορότερη ροή του προς την επιφάνεια της γεώτρησης. Χρήσεις ως ψυκτικού Μικρά τεμάχια ξηρού πάγου Το υγρό και το στερεό διοξείδιο του άνθρακα είναι σημαντικά ψυκτικά μέσα, κυρίως στη βιομηχανία τροφίμων, όπου χρησιμοποιούνται για τη μεταφορά και αποθήκευση παγωτών και άλλων κατεψυγμένων προϊόντων. Το στερεό διοξείδιο του άνθρακα ονομάζεται "ξηρός πάγος" και χρησιμοποιείται για μικρές μεταφορές στις οποίες δεν είναι πρακτικά τα ογκώδη ψυγεία. Το υγρό διοξείδιο του άνθρακα (που ονομάζεται στη βιομηχανία R744 ή R-744) χρησιμοποιήθηκε ως ψυκτικό μέσο, πριν από την ανακάλυψη του R-12[3]. Οι φυσικές ιδιότητές του είναι ιδιαίτερα κατάλληλες για κατάψυξη ή και απλή ψύξη. Λόγω της λειτουργίας τους σε πιέσεις μέχρι 130 bar, τα ψυκτικά συστήματα που χρησιμοποιούν CO2 απαιτούν ιδιαίτερα ανθεκτικά εξαρτήματα. Στους κλιματισμούς των αυτοκινήτων, σε πάνω από το 90% του συνόλου των συνθηκών οδήγησης, το R744 λειτουργεί πιο αποτελεσματικά από τα συστήματα που χρησιμοποιούν R-134a[4]. Τα περιβαλλοντικά πλεονεκτήματα του CO2 (μη τοξικό, μη εύφλεκτο, φθηνό) θα μπορούσαν στο μέλλον να αποτελέσουν έναν καλό λόγο για την αντικατάσταση των σημερινών HFCs[5] των ψυκτικών συστημάτων των αυτοκινήτων, των σούπερ-μάρκετ κλπ. Παραγωγή κρασιούΤο διοξείδιο του άνθρακα με τη μορφή του ξηρού πάγου χρησιμοποιείται συχνά στα οινοποιεία για τη γρήγορη ψύξη των σταφυλιών με σκοπό την αποτροπή της πρόωρης ζύμωσης. Το κύριο πλεονέκτημα της χρήσης του ξηρού πάγου σε σχέση με το παγωμένο νερό είναι ότι ψύχει τα σταφύλια χωρίς προσθήκη νερού το οποίο θα μπορούσε να αραιώσει τα σάκχαρα στο γλεύκος των σταφυλιών και, κατά συνέπεια, να μειώσει τη συγκέντρωση αιθανόλης στο τελικό προϊόν. Το αέριο CO2 που προκύπτει από την εξάχνωση του ξηρού πάγου, επειδή είναι βαρύτερο από τον αέρα, συσσωρεύεται στον πυθμένα των δεξαμενών, δημιουργώντας έτσι ένα περιβάλλον που βοηθά στην καταπολέμηση των βακτηρίων, που προέρχονται από τα σταφύλια μέχρι τη στιγμή κατά την οποία θα αρχίσει η ελεγχόμενη ζύμωση. Έλεγχος του pHΤο διοξείδιο του άνθρακα χρησιμοποιείται ως μέσο ελέγχου του pH των κολυμβητηρίων. Με τη συνεχή προσθήκη CO2 στο νερό, διατηρείται το pH σε χαμηλά επίπεδα. Ανάμεσα στα πλεονεκτήματα αυτής της πρακτικής είναι και η αποφυγή χρήσης πιο επικίνδυνων οξέων. Το CO2 στην ατμόσφαιρα Από το ανθρωπογενές CO2 που εκπέμπεται από τα ορυκτά καύσιμα: 50% διαλύεται στους ωκεανούς και απορροφάται από τα επίγεια οικοσυστήματα και το 50% διοχετεύεται στην ατμόσφαιρα. Η ορυκτολογική δέσμευση του διοξειδίου του άνθρακα είναι φυσική μέθοδος δέσμευσης του CO2 σε στερεά ορυκτά, όπως μαγνησίτη (MgCO3), ασβεστίτη (CaCO3) και δολομίτη (CaMg(CO3)2). Τα τελευταία παραμένουν σταθερά για χιλιάδες έως εκατομμύρια χρόνια, εξασφαλίζοντας τη μη διαρροή του CO2 πίσω στην ατμόσφαιρα της Γης. Για το λόγο αυτό, η συγκεκριμένη μέθοδος θεωρείται από πολλούς επιστήμονες ως η ασφαλέστερη μέθοδος αποθήκευσης CO2 με σκοπό την εξισορρόπηση της παγκόσμιας κλιματικής αλλαγής. Η διαδικασία αυτή λαμβάνει χώρα στη φύση με πολύ αργούς ρυθμούς, επομένως τα τελευταία χρόνια σκοπός πολλών επιστημονικών ερευνών είναι να μιμηθούν και να επιταχύνουν αυτό που κάνει η φύση από μόνη της, στα πλαίσια της εξισορρόπησης της υπερθέρμανσης του πλανήτη. Το CO2 στους ωκεανούςΗ διάλυση του άνθρακα στους ωκεανούς με τη μορφή CO2, H2CO3 και ιόντων HCO3- και CO32- είναι περίπου 50 φορές μεγαλύτερη από ότι στην ατμόσφαιρα. Οι ωκεανοί ενεργούν ως μία τεράστια δεξαμενή άνθρακα, και δέχονται περίπου το ένα τρίτο των εκπομπών CO2 από τις ανθρώπινες δραστηριότητες. Η διαλυτότητα του CO2 μειώνεται καθώς η θερμοκρασία του νερού αυξάνεται. Βιολογικός ρόλος του CO2Το διοξείδιο του άνθρακα είναι τελικό προϊόν του μεταβολισμού των οργανισμών που παίρνουν την ενέργειά τους από τη διάσπαση με οξυγόνο των σακχάρων, των λιπών και των αμινοξέων με μια διαδικασία που είναι γνωστή ως κυτταρική αναπνοή. Στους οργανισμούς αυτούς περιλαμβάνονται όλα τα φυτά και τα ζώα, πολλοί μύκητες και ορισμένα βακτήρια. Στους ανώτερους οργανισμούς, το διοξείδιο του άνθρακα μεταφέρεται με το αίμα από τους ιστούς του σώματος στους πνεύμονες, από όπου και εκπνέεται. Ο ρόλος του CO2 στη φωτοσύνθεση και στις φυτικές λειτουργίες Φωτοσύνθεση CO2 + H2Ο → Γλυκόζη + Ο2 Φωτοσύνθεση είναι η διαδικασία κατά την οποία τα φυτά που περιέχουν χλωροφύλλη, με τη βοήθεια του φωτός και με αρχικά αντιδρώντα το νερό και το CO2, μετατρέπουν ανόργανες ουσίες σε τροφή. Πρόκειται για μια φυσιολογική λειτουργία με την οποία τα πράσινα φυτά προμηθεύονται τον άνθρακα και το οξυγόνο, που είναι απαραίτητα για τη θρέψη τους. Η φωτοσύνθεση είναι μια εξώθερμη διαδικασία, η συνολική χημική αντίδραση της οποίας είναι : 6CO2 + 6H2Ο → C6H12O6 + 6O2 + 2817 KJ.
Ο μηχανισμός της φωτοσύνθεσης σε γενικές γραμμές είναι ο ακόλουθος: το νερό διαλύει και μεταφέρει το διοξείδιο του άνθρακα μέχρι τα κύτταρα και τους χλωροπλάστες των φύλλων. Εκεί με την ενέργεια του φωτός που απορροφά η χλωροφύλλη, διασπάται το νερό στα στοιχεία του. Το οξυγόνο απελευθερώνεται, ενώ το ατομικό υδρογόνο δεσμεύεται από διάφορα ένζυμα. Έπειτα το υδρογόνο συμμετέχει στις αντιδράσεις με το διοξείδιο του άνθρακα: CΟ2 + |Η| → (CΗ2Ο)x. Στο δεύτερο στάδιο αντιδράσεων δε χρειάζεται ηλιακή ενέργεια, γι' αυτό οι αντιδράσεις αυτές ονομάζονται "σκοτεινές". Με λίγα λόγια, οι χλωροπλάστες, με την βοήθεια του φωτός και του CO2, παράγουν οξυγόνο και ενέργεια απορροφώντας CO2 κατά την φωτοπερίοδο η οποία δεν θα πρέπει να ξεπερνά τις 12 ώρες ημερησίως. Τις υπόλοιπες ώρες απορροφούν οξυγόνο και παράγουν CO2. Τοξικότητα του CO2 - Επιδράσεις στο νευρικό σύστημαΗ περιεκτικότητα του καθαρού αέρα σε CO2 (κατά μέσο όρο μεταξύ της στάθμης της θάλασσας και μέχρι ύψους περίπου 30 χλμ.) κυμαίνεται από 0,036 % (360 ppm) έως και 0,039% (390 ppm), ανάλογα με την τοποθεσία. 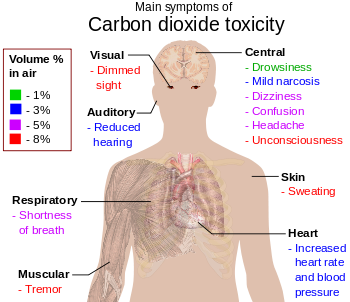 Κύρια συμπτώματα της τοξικότητας του CO2 από την αύξηση της περιεκτικότητάς του στον αέρα. Η τοξικότητα και οι επιπτώσεις της αυξάνονται με την αύξηση της περιεκτικότητας του αέρα σε CO2 :
Το 1984 στη λίμνη Monoun του Καμερούν αναφέρθηκαν 37 θάνατοι που οφείλονταν σε τοπικά πολύ υψηλές συγκεντρώσεις CO2, το οποίο παράχθηκε από την διατάραξη της λίμνης που ήταν κορεσμένη σε CO2. Το 1986 στη λίμνη Nyos πάλι στο Καμερούν αναφέρθηκαν 1700 θάνατοι από τα ίδια αίτια. To CO2 στην ανθρώπινη φυσιολογίαTo CO2 μεταφέρεται στο αίμα με τρεις διαφορετικούς τρόπους. (Τα ακριβή ποσοστά διαφέρουν ανάλογα με το αν το αίμα είναι φλεβικό ή αρτηριακό) :
Η αιμοσφαιρίνη, το κύριο μόριο-μεταφορέας οξυγόνου στα ερυθρά αιμοσφαίρια, μεταφέρει και Ο2 και CO2. Ωστόσο, το CO2 δεσμεύεται στο μόριο της αιμοσφαιρίνης σε διαφορετικό μέρος από το Ο2. Όταν η δέσμευση του Ο2 είναι αυξημένη, ελαττώνεται η ποσότητα του CO2 που δεσμεύεται στην αιμοσφαιρίνη και αντιστρόφως εξαιτίας του αλλοστερικού φαινομένου. Το CO2 απομακρύνεται από το ανθρώπινο σώμα με τον εξής μηχανισμό : Η γλυκόζη οξειδώνεται στα κύτταρα σύμφωνα με το σχήμα : C6H12O6 + 6O2 ⇄ 6CO2 + 6H2Ο + Ενέργεια. Το παραγόμενο CO2 διαλύεται στο νερό και δίνει ανθρακικό οξύ : CO2 + H2Ο ⇄ H2CO3. Το οξύ σύντομα διαχέεται έξω από τα τριχοειδή αγγεία και όταν φθάσει στο αίμα εξουδετερώνεται εν μέρει από το ανθρακικό νάτριο, που υπάρχει εκεί : Na2CO3 + H2CO3 ⇄ 2NaHCO3 (Ι). Παραπομπές
Πηγές
Εξωτερικοί σύνδεσμοι
Δείτε επίσης |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||