|
Chlorure de potassium
Le chlorure de potassium est un composé chimique minéral de formule KCl. Sous sa forme solide, ce sel neutre équivaut au minéral tendre[8] nommé sylvine, ou sel amer, ou encore sylvite en anglais, de structure cristallographique cubique à faces centrées[9]. Extraction de la merDans les marais salants fortement ensoleillés ou les régions maritimes désertiques, il est possible d'extraire de l'eau de mer le sel amer, soit un chlorure de potassium, plus ou moins associé au chlorure de magnésium, qui apparaît sous forme de saumure et de sels déliquescents, déposés après la halite ou sel marin solide. Dans les pays maritimes dépourvus de ces conditions d'évaporation, l'exploitation moderne des cendres d'algues, en particulier d'algues brunes ou varech, est attestée de manière évidente jusqu'au milieu du XIXe siècle, parfois jusqu'à la Belle Époque car on retirait de la soude de varech brome et iode[10].
Propriétés chimiquesSolubilitéLe KCl étant un solide ionique, il est soluble dans de nombreux solvants polaires mais moins dans les solvants apolaires, c'est pourquoi il existe un grand écart de solubilité du chlorure de potassium entre l'eau et l'acétone, par exemple.
En solution aqueuse, les ions majoritairement formés sont K+ et Cl−. 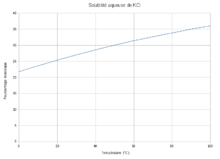 Propriétés rédox et formation de potassium métalliqueBien que le potassium soit plus électropositif que le sodium, KCl peut être réduit à l'état métallique par réaction avec le sodium à 850 °C du fait de la plus grande volatilité du potassium qui peut ainsi être extrait par distillation :
Cette réaction est la principale méthode de fabrication du potassium métallique. L'électrolyse (utilisée pour le sodium) ne fonctionne pas à cause de la forte solubilité du potassium dans le KCl fondu[12]. UtilisationAlimentationLe chlorure de potassium (numéro E508[13]) est utilisé dans les denrées alimentaires comme remplacement du sel de cuisine (halite, NaCl) car il possède une saveur salée similaire. Cependant, il développe aussi un arrière-goût amer qui permet de les différencier. AgricultureLe terme générique « potasse » dans la chimie des engrais peut englober le chlorure de potassium ou sylvine, le chlorure double de potassium et de magnésium (nommé sous une forme hydratée carnallite), le sulfate double de potassium et de magnésium, le sulfate de potassium (obtenu par l'action de l'acide sulfurique sur KCl), le nitrate de potassium et l'hydroxyde de potassium KOH, base bien plus forte que l'hydroxyde de sodium NaOH. PoisonLa dose létale 50 (dose mesurée sur la souris) de chlorure de potassium est à peu près de 2 500 mg kg−1 par voie orale (c'est-à-dire 190 g pour 75 kg ; à titre de comparaison, le chlorure de sodium (sel de table) a une DL50 orale de 3 750 mg kg−1) et de 100 mg kg−1 en voie intraveineuse. Il est utilisé lors des exécutions de condamnés à mort aux États-Unis, par injection létale : l'administration en intraveineuse d'une solution excessive de KCl provoque un arrêt cardiaque. C’est en raison de cette toxicité qu’en pratique médicale une perfusion de ce soluté ne doit pas dépasser un débit de 1,5 g/h. Il peut être aussi utilisé pour les interruptions médicales de grossesse par injection intracardiaque fœtale. Extraction du gaz de schiste par hydrofracturationLe documentaire Gasland (2010) de l'Américain Josh Fox montre que l'industrie américaine de l'extraction du gaz de schiste reconnaît l'usage du chlorure de potassium, dilué dans un mélange d'eau, à d'autres produits chimiques toxiques et de sable pour l'injection dans les puits d'extraction du gaz de schiste comme liquide d'hydrofracturation. Le chlorure de potassium est employé comme absorbeur d'oxygène, mais cette technique visant à libérer le gaz contenu dans la couche de schiste a aussi pour conséquences de polluer les nappes phréatiques avec le liquide de fracturation. Pour un puits d'extraction, il faut entre 10 et 30 000 m3 d'eau, la moitié environ est récupérée après fracturation. PharmacochimieLe chlorure de potassium fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[14]. Notes et références
Voir aussiLiens externes
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||









