|
Syndrome héréditaire de prédisposition au cancer du sein et de l'ovaireSyndrome héréditaire de prédisposition au cancer du sein et de l'ovaire
Les patientes atteintes de cancer de l'ovaire et du sein dans un arbre généalogique familial.
Les syndromes héréditaires de prédispodition au cancer du sein et de l’ovaire ou SHPCSO (en anglais : hereditary breast-ovarian cancer syndromes ou HBOC) sont des syndromes cancéreux entraînant des niveaux anormalement élevés de cancer du sein, de cancer de l'ovaire et d'autres types de cancers au sein de familles génétiquement liées (c'est-à-dire qu'un individu est touché par les deux maladies, ou plusieurs membres de la même famille sont atteints de l'une ou l'autre). Ces syndromes représentent 90 % des cancers d'origine héréditaire[1]. Il est possible de prouver ou de suspecter que des facteurs héréditaires sont responsables du schéma d'apparition du cancer du sein et de l'ovaire au sein de la famille[2]. Le terme SHPCSO peut prêter à confusion, car il suggère que cette susceptibilité génétique au cancer concerne principalement les femmes. En réalité, les deux sexes présentent des taux de mutations génétiques similaires, et le SHPCSO peut également augmenter le risque d'autres cancers, tels que le cancer de la prostate et le cancer du pancréas[3]. C'est pour cette raison que le terme « syndrome de King » est récemment apparu. Le nouveau nom fait référence à Mary-Claire King qui a identifié les gènes BRCA1 et BRCA2. La plupart des syndromes de King sont hérités selon un modèle autosomique dominant. L'hérédité biallélique et homozygote des allèles défectueux qui confèrent ce syndrome est généralement une condition mortelle pour l'embryon ; les cas vivants souffrent généralement d'une forme sévère d'anémie de Fanconi. Causes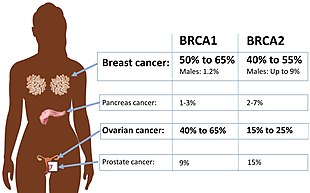 Un certain nombre de gènes sont associés au HBOC[5]. Les causes les plus courantes connues du HBOC sont :
D’autres gènes identifiés incluent :
Pour de nombreux gènes, l'héritage des deux allèles défectueux entraîne généralement un phénotype fatal pour l'embryon. Les individus vivant avec ces mutations présentent une forme grave de l'anémie de Fanconi ; les mutations bialléliques de BRCA1 appartiennent au groupe de complémentation S de cette anémie, tandis que celles de BRCA2 se classent dans le groupe de complémentation D1[9]. Environ 45 % des cas d’HBOC impliquent des gènes non identifiés ou plusieurs gènes[5]. DiagnosticLe diagnostic du syndrome de prédisposition héréditaire au cancer du sein et de l'ovaire repose sur plusieurs éléments clés, notamment l'histoire familiale, les critères individuels et les tests génétiques. L'oncogénétique vise à identifier les personnes à haut risque de développer ces cancers afin de proposer un suivi et des soins optimisés. Une approche familiale, basée sur l'analyse de l'arbre généalogique sur plusieurs générations, permet de repérer les familles avec une forte concentration de cancers. La consultation d'oncogénétique joue un rôle crucial dans l'évaluation du risque individuel à partir de cette histoire familiale[10]. Les critères cliniques qui doivent alerter sont la présence de plusieurs cas de cancer du sein dans une même branche familiale, que ce soit du côté paternel ou maternel, la survenue précoce du cancer (avant l'âge de 50 ans), un cancer du sein multifocal ou bilatéral, la présence d'un cancer de l'ovaire, ou d'un cancer du sein chez l'homme. Des critères spécifiques, établis par l'INCa, incluent un cancer du sein infiltrant isolé avant 36 ans, un cancer du sein et de l'ovaire chez la même femme, un cancer du sein triple négatif ou médullaire avant 51 ans, et un cancer de l'ovaire ou tubaire avant 70 ans. Un score d'orientation vers une consultation d'oncogénétique, tel que le score d'Eisinger, peut être utilisé pour évaluer le niveau de risque[10]. Le test génétique constitutionnel est proposé lorsqu'un risque héréditaire est suspecté. Il consiste à rechercher des mutations génétiques dans les cellules non tumorales d'un individu, généralement à partir d'une prise de sang ou d'un frottis jugal. Ce test est réalisé chez une personne atteinte de cancer, appelée "cas index", dont l'analyse peut bénéficier à l'ensemble de la branche familiale. L'identification d'une mutation délétère dans un gène de prédisposition permet de proposer un test génétique ciblé aux autres membres de la famille qui le souhaitent. Les gènes les plus fréquemment analysés sont BRCA1, BRCA2 et PALB2, mais d'autres gènes peuvent également être étudiés à l'aide de panels multigéniques, notamment TP53, CDH1, PTEN, RAD51C et RAD51D[10]. Les résultats des tests génétiques sont interprétés dans le cadre d'une consultation d'oncogénétique. Un résultat positif signifie que la personne est porteuse d'une mutation et qu'elle a un risque accru de développer un cancer du sein ou de l'ovaire. Un résultat négatif diminue le risque d'une prédisposition familiale, mais ne l'élimine pas complètement. En effet, certaines mutations peuvent échapper aux analyses actuelles ou concerner des gènes encore inconnus. De plus, des variants de signification indéterminée (VSI) sont régulièrement retrouvés, ce qui souligne l'importance d'une analyse familiale pour évaluer leur caractère délétère. Les progrès technologiques, notamment le séquençage à haut débit (NGS), permettent d'analyser plusieurs gènes simultanément et d'identifier de nouveaux gènes de prédisposition[10]. Cependant, l'interprétation des résultats reste complexe et nécessite une expertise en génétique. Malgré les avancées, une mutation causale n'est identifiée que dans moins de 20 % des cas avec un contexte évocateur d'une prédisposition héréditaire, soulignant l'importance prédominante de l'histoire familiale pour orienter la prise en charge. L'étude de l'arbre généalogique et la prise en compte des facteurs individuels restent donc essentielles dans le processus diagnostique[11],[10]. PréventionIl est recommandé aux personnes porteuses de mutations BRCA1 et BRCA2 de subir une échographie transvaginale 1 à 2 fois par an. Un dépistage avec CA-125 est également recommandé. L'ablation préventive des ovaires et des trompes de Fallope (salpingo-ovariectomie prophylactique) est recommandée entre 35 et 40 ans pour les personnes porteuses de mutations BRCA1, et entre 40 et 45 ans pour celles porteuses de mutations BRCA2[6]. De plus en plus de femmes porteuses de mutations BRCA1 ou BRCA2 optent pour une chirurgie préventive afin de réduire leur risque de cancer. Cependant, le délai moyen pour accéder à cette intervention est de deux ans, bien au-delà des recommandations[12],[13]. Références(en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hereditary breast–ovarian cancer syndrome » (voir la liste des auteurs).
Liens externes
Information related to Syndrome héréditaire de prédisposition au cancer du sein et de l'ovaire |
