| Ածխաթթու |
|---|
 |
| Ընդհանուր տեղեկություններ |
|---|
| Քիմիական բանաձև | H2CO3 |
|---|
| Ֆիզիկական հատկություններ |
|---|
| Արտաքին տեսք | անգույն լուծույթ |
|---|
| Մոլային զանգված | 62,03 գ/մոլ |
|---|
| Խտություն | 1,668 գ/սմ³ |
|---|
| Ջերմային հատկություններ |
|---|
| Հալման ջերմաստիճան | 344 °C |
|---|
| Սուբլիմացման ջերմաստիճան | ? = ? |
|---|
| Հալման էնթալպիա | −623 կՋ/մոլ կՋ/մոլ |
|---|
| Քիմիական հատկություններ |
|---|
| pKa | 6,37[1] |
|---|
| Դասակարգում |
|---|
| CAS համար | 463-79-6 |
|---|
| PubChem | 767, 3614646, 22639876 |
|---|
| EINECS համար | 610-295-3 |
|---|
| SMILES | C(=O)(O)O |
|---|
| ЕС | 610-295-3 |
|---|
| ChEBI | 747 |
|---|
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) |
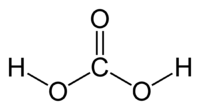
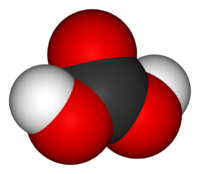
Ածխաթթու, H2CO3, երկհիմն թույլ թթու։ Մաքուր ածխաթթուն կայուն է –30 °C–ում։ Սովորական պայմաններում անկայուն են անգամ ածխաթթվի նոսր լուծույթները, որոնք ստացվում են ածխածնի երկօքսիդը ջրում լուծելիս։ Ածխաթթուն առաջացնում է թթու և չեզոք աղեր՝ բիկարբոնատներ և կարբոնատներ։ Մետաածխաթթվից (H2CO3) բացի հայտնի է նաև օրթոածխաթթուն՝ C(OH)4, որը, սակայն, ազատ վիճակում գոյություն չուևի։ Հայտնի են միայն նրա էսթերները՝ Շ(0&)4։ Ածխաթթվի նոսր լուծույթներն օգտագործվում են որպես զովացուցիչ ջրեր։ Լայն կիրառում ունեն ածխաթթվի աղերը։
Ֆիզիկական հատկություններ
Աշխաթթուն ազատ վիճակում գոյություն չունի, այն գտնվում է ջրային լուծույթների մեջ՝ ածխածնի երկօքսիդի հետ հավասարակշռված։ Ածխաթթվի մոլեկուլն ունի հարթ կառուցվածք։ Ածխածնի կենտրոնական ատոմն ունի sp² հիբրիդացում։
Գազային վիճակում մաքուր ածխաթթուների վարքագիծը հետազոտվել է 2011 թվականին ավստրիացի քիմիկոսների կողմից[2]։
Քիմիական հատկություններ
Հավասարակշռումը ջրային լուծույթներում և թթուներում
Ջրային լուծույթներում ածխածնի երկօքսիդի հիդրատով ածխաթթվի հավասարումը հետևյալն է՝
 , հավասարակշռության հաստատունը 25 °C ջերմաստիճանում
, հավասարակշռության հաստատունը 25 °C ջերմաստիճանում ![{\displaystyle K_{p}={\frac {\mathsf {[H_{2}CO_{3}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=1,70\cdot 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/345999d79c63da9ea452e347fec4a094aefe3de4) :
:
Ուղիղ ռեակցիայի արագությունը 0,039 с−1, հակադարձը՝ 23 с−1:
Լուծվող ածխածնի երկօքսիդի հիդրատն իր հերթին, հավասար է գազային ածխաթթու գազի հետ՝
 :
:
Այս հավասարակշռությունը փոփոխվում է ճիշտ այնպես, ինչպես ջերմաստիճանը բարձրանում է, իսկ ճնշման բարձրացմանը զուգահեռ տեղաշարժվում է դեեպի ձախ։
Ածխաթթունենթարկվում է հիդրոիզի, ստեղծելով թթվային միջավայր։
 , թթվայնության հաստատուն 25 °C ջերմաստիճանում՝
, թթվայնության հաստատուն 25 °C ջերմաստիճանում՝ ![{\displaystyle K_{a1}={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[H_{2}CO_{3}]}}}=2,5\cdot 10^{-4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/44b843bcb6c46a20b2ad462fe247460db137f9ad) :
:
Այնուամենայնիվ, գործնական հաշվարկների համար ակնհայտ թթվայնության կայունությունը հաճախ օգտագործվում է, հաշվի առնելով ածխաթթուների հավասարակշռությունը ածխածնի երկօքսիդի հիդրատ՝
![{\displaystyle K_{a}'={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=4,27\cdot 10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/812574df55bdb6c4ffa01634dbd0f8286c253913)
Հիդրոկարբոնատ-իոնը ենթարկվում է հիդրոլիզի՝
 , թթվայնության հաստատուն 25 °C -ի դեպքում՝
, թթվայնության հաստատուն 25 °C -ի դեպքում՝ ![{\displaystyle K_{a2}={\frac {\mathsf {[CO_{3}^{2-}]\cdot [H_{3}O^{+}]}}{\mathsf {[HCO_{3}^{-}]}}}=4,68\cdot 10^{-11}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/00a32ff131656c7396fcd318bdf3594de7fc7d99) :
:
Այսպիսով, ածխաթթու պարունակող լուծույթներում ստեղծվում է համալիր հավասարակշռության համակարգ, որն կարելի է ներկայացնել հետեւյալ կերպ.
 :
:
 , где L = 0,034 մոլ/լ — CO2 լուծելիությունը ջրի մեջ՝ հատուկ պայմաններում։
, где L = 0,034 մոլ/լ — CO2 լուծելիությունը ջրի մեջ՝ հատուկ պայմաններում։
Տեսակներ
Հեղուկի ջերմաստիճանի բարձրացումը եւ / կամ ածխածնի երկօքսիդի մասնակի ճնշման նվազումը, հավասարակշռությունը փոխում է դեպի ածխաթթու `ջրի եւ ածխածնի երկօքսիդի տարրալուծում։ Լուծույթի եռման ժամանակ ածխաթթում ամբողջությամբ տրոհվում է՝
 :
:
Հիմքերի և աղերի հետ փոխազդեցություն
Հիմքերի և թթուների հետ փոխազդեցության ռեակցիայի օրինակներ են՝
 (կոնց.)
(կոնց.)
 (ջրիկ.)
(ջրիկ.)


Կարբոնատների հետ փոխազդեցությունից առաջանում են հիդրոկարբոնատներ՝


Ծանոթագրություններ
Գրականություն
- Лидин Р. А., Молочко В. А., Андреева Л. Л., ISBN 978-5-358-01303-2։
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5
Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 1, էջ 208)։ 
|



![{\displaystyle K_{p}={\frac {\mathsf {[H_{2}CO_{3}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=1,70\cdot 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/345999d79c63da9ea452e347fec4a094aefe3de4)


![{\displaystyle K_{a1}={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[H_{2}CO_{3}]}}}=2,5\cdot 10^{-4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/44b843bcb6c46a20b2ad462fe247460db137f9ad)
![{\displaystyle K_{a}'={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=4,27\cdot 10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/812574df55bdb6c4ffa01634dbd0f8286c253913)

![{\displaystyle K_{a2}={\frac {\mathsf {[CO_{3}^{2-}]\cdot [H_{3}O^{+}]}}{\mathsf {[HCO_{3}^{-}]}}}=4,68\cdot 10^{-11}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/00a32ff131656c7396fcd318bdf3594de7fc7d99)










