|
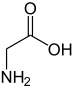
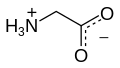
Glicina
A glicina (do grego glykos, "doce", nome devido ao seu sabor adocicado[2]) é um dos aminoácidos codificados pelo código genético, sendo, portanto, um dos componentes das proteínas dos seres vivos. É codificado pelos codões GGU, GGC, GGA e GGG[3]. Devido à sua simplicidade estrutural, este aminoácido tende a ser conservado evolucionariamente em proteínas como o citocromo c, a mioglobina e a hemoglobina. A glicina é o único aminoácido que não apresenta actividade óptica. A maioria das proteínas possui pequenas quantidades de glicina; o colagénio é uma excepção de nota, constituindo a glicina cerca de um terço da sua estrutura primária. A presença de glicina inibe a formação de alfa-hélices mas facilita a formação de folhas-beta na estrutura secundária de proteínas, por ser um aminoácido que apresenta um alto grau de flexibilidade quando integrado numa cadeia polipeptídica.[2] Apesar de ser um aminoácido apolar, a sua cadeia lateral (um átomo de hidrogênio) é demasiado curta para participar em interações hidrofóbicas.[2] No entanto, a glicina pode, em determinadas enzimas como a piruvato:formato liase, ser convertida a radical glicilo através da retirada desse átomo de hidrogênio, sendo este radical importante para a catálise enzimática, embora instável e destruído na presença de O2. BiossínteseA glicina não é um aminoácido essencial na dieta humana, já que é sintetizado pelo organismo a partir do aminoácido serina numa reacção catalisada pela enzima serina hidroximetiltransferase:[2]
Função fisiológicaComo intermediário biossintéticoA glicina serve de precursor a diversas espécies químicas. O ácido aminolevulínico, precursor chave das porfirinas, é sintetizado in vivo a partir de glicina e succinil-coenzima A. A glicina fornece também o bloco C2N central a todas as purinas. Uma das vias de degradação do aminoácido treonina passa pela sua conversão a glicina, embora esta via metabólica seja relativamente pouco importante no metabolismo humano. É ainda precursor na via biossintética da fosfocreatina. A degradação da glicina segue três vias principais:
Como neurotransmissorA glicina é um neurotransmissor inibitório no sistema nervoso central, especialmente a nível da medula espinal, tronco cerebral e retina. Quando receptores de glicina são activados, o ânion cloreto entra no neurônio através de receptores ionotrópicos, causando um potencial pós-sináptico inibitório. A estricnina actua como antagonista nos receptores ionotrópicos de glicina. A glicina é, junto com o glutamato, um co-agonista de receptores NMDA; esta ação facilita a actividade excitatória dos receptores glutaminérgicos, em contraste com a atividade inibitória da glicina. A dose letal de glicina administrada oralmente, em ratos, é de 7930 mg/kg[4], causando morte usualmente por hiperexcitabilidade. Como elemento estruturalAlém de ser um aminoácido importante na formação de colagénio, é essencial na formação da camada de peptidoglicano na parede celular de bactérias Gram-positivas, ao formar um pentapéptido (pentaglicina) que ajuda na ligação entre resíduos de ácido N-acetilmurâmico. A pentaglicina está ausente nas bactérias Gram-negativas. A glutationa, tripéptido essencial na manutenção do equilíbrio redox intracelular, tem na sua constituição glicina. Na fotorrespiraçãoAs mitocôndrias de plantas apresentam uma via alternativa de respiração, a fotorrespiração, em que a glicina é convertida a serina através da seguinte reacção, catalisada pela enzima glicina descarboxilase:
tornando-se esta a principal fonte de NADH mitocondrial para posterior produção de ATP. Esta reacção faz parte do grupo estrutural do RNA ciclo do glicolato. Detectada num cometaA glicina foi descoberta na atmosfera do cometa Júpiter 67P/Churyumov-Gerasimenko, pela sonda europeia Rosetta.[5]
Referências
Bibliografia
Ligações externas
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||