|
Etan
Etanul este un compus organic din categoria alcanilor, o hidrocarbură saturată aciclică, cu o catenă formată din doi atomi de carbon legați printr-o legătură simplă. Formula chimică este C2H6 iar formula de structură este CH3-CH3. În condiții normale de temperatură și presiune, etanul este un compus gazos, incolor și inodor. Ca majoritatea hidrocarburilor, este obținut pe scară industrială din gaze naturale și ca produs secundar al rafinării petrolului.[2] Este unul dintre principalii compuși utilizați pentru obținerea etilenei. Restul organic corespunzător etanului este grupa etil. ObținereEtanul este obținut în mare parte în urma purificării gazelor naturale și ca produs secundar al rafinării petrolului.[2] O cale de sinteză în laborator este reacția de electroliză Kolbe, o metodă prin care o soluție apoasă de acetat este supusă electrolizei.[3] La anod, acetatul este oxidat la dioxid de carbon și radicali metil, iar aceștia, fiind extrem de reactivi, se leagă formând molecula de etan: Proprietăți fizice Etanul este, în condiții standard, un gaz incolor și inodor. Are un punct de fierbere de -88,5 °C și un punct de topire de -182,8 °C. Etanul în fază solidă prezintă câteva modele structurale.[4] Prin răcire în condiții normale, etanul prezintă cristale cubice, plastice, în care atomii de hidrogen nu sunt ficși, iar molecula se poate roti în jurul axului principal. Prin răcirea sub −183,2 °C, cristalele devin monoclinice (grup spațial P 21/n).[5] Proprietăți chimiceConformație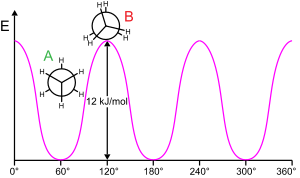 Etanul este cea mai simplă moleculă care prezintă izomerie conformațională. Reacții de substituție radicalicăEtanul, în mod caracteristic alcanilor, dă unele reacții de substituție radicalică a atomilor de hidrogen. Reacțiile sunt cel mai adesea de halogenare (clorurare, bromurare) și decurg cu formarea unor amestecuri de halogeno-derivați (cloroetan, dicloroetan, etc.): Reacția de dehidrogenareEtanul suferă o reacție de dehidrogenare termică la etenă: Pentru ca reacția să aibă loc, este necesară o temperatură foarte ridicată (> 700 °C). Reacția de oxidare
Prin combustia completă a etanului se obțin 1559,7 kJ/mol sau 51,9 kJ/g în termeni de energie, dioxid de carbon și apă, conform ecuației reacției chimice:[7] Pentru ca reacția să fie completă, sunt necesare condiții ideale de reacție (o cantitate suficientă de oxigen).
Note
Vezi șiLegături externe
|
||||||||||||||||||||||||||||||||||||||






