|
Азотная кислота
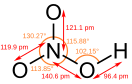
Азо́тная кислота́ (химическая формула — HNO3; лат. Acidum nitricum, azoticum) — сильная химическая неорганическая кислота, отвечающая высшей степени окисления азота (+5). При стандартных условиях азотная кислота — это одноосновная кислота, в чистом виде — бесцветная жидкость с резким удушливым запахом. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками. Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип 120 °C при нормальном атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O). Азотная кислота не является канцерогеном, однако пары сильных неорганических кислот, к которым относится азотная, могут провоцировать рак.[4] Она, а также её соли — нитраты являются сильными окислителями. Исторические сведенияМетодика получения разбавленной азотной кислоты путём сухой перегонки селитры с квасцами и медным купоросом была, по-видимому, впервые описана в трактатах Джабира (Гебера в латинизированных переводах) в VIII веке. Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса железным, применялся в европейской и арабской алхимии вплоть до XVII века. В XVII веке Глаубер предложил метод получения летучих кислот реакцией их солей с концентрированной серной кислотой, в том числе и азотной кислоты из калийной селитры, что позволило ввести в химическую практику концентрированную азотную кислоту и изучить её свойства. Метод Глаубера применялся до начала XX века, причём единственной существенной модификацией его оказалась замена калийной селитры на более дешёвую натриевую (чилийскую) селитру. Во времена М. В. Ломоносова и вплоть до середины XX века азотная кислота в обиходе именовалась крепкой водкой[5]. Физические и физико-химические свойства  Азот в азотной кислоте имеет степень окисления +5. Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C (при нормальном атмосферном давлении) с частичным разложением. Азотная кислота смешивается с водой во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95—0,98 называют «дымящей азотной кислотой», с массовой долей 0,6—0,7 — концентрированной азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см3, Tкип = 120,7 °C) При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
Твёрдая азотная кислота образует две кристаллические модификации:
Моногидрат образует кристаллы ромбической сингонии, пространственная группа P na2, параметры ячейки a = 0,631 нм, b = 0,869 нм, c = 0,544 нм, Z = 4. Плотность водных растворов азотной кислоты как функция её концентрации описывается уравнением где d — плотность в г/см3, c — массовая доля кислоты. Данная формула плохо описывает поведение плотности при концентрации более 97 %.
Химические свойства1. Высококонцентрированная HNO3 имеет бурую окраску вследствие происходящего на свету процесса разложения (фотолиз), в ходе которого она распадается на воду, оксид азота(IV) и кислород: 2. При нагревании азотная кислота частично распадается по той же реакции, однако вполне может быть доведена до ~100% концентрации (соломенного цвета, практически без примесей) простой дистилляцией при атмосферном давлении смеси серной и азотной кислот. В совершенно чистом виде она представляет собой бесцветную прозрачную жидкость. Без разложения азотная кислота перегоняется при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией). 3. Золото, платина, иридий, родий и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. Так, холодная концентрированная азотная кислота не реагирует с алюминием, хромом, железом, свинцом, бериллием, никелем и др. (см. пассивация). При нагревании или добавлении воды реакция идёт (см. ниже). 4. HNO3 как сильная одноосновная кислота протонирует воду: Также, взаимодействует: а) с основными и амфотерными оксидами: б) с основаниями: в) вытесняет слабые кислоты из их солей: 5. Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до различных степеней окисления от +5 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует: а) с металлами, стоящими в ряду напряжений правее водорода: Концентрированная HNO3 (60%): Разбавленная HNO3 (30%): б) с металлами, стоящими в электрохимическом ряду напряжений левее водорода: Все приведённые выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3. Также механизм реакций значительно сложнее. На практике в растворе происходят множественные восстановления нитрат иона и водорода. Подобно реакциям с иными кислотами, атомарный водород также выделяется, и он частично ответственен за восстановление азотной кислоты. Например: Сложив реакции и уравняв их, мы получим вышеупомянутое уравнение: Такого рода восстановления можно описать для всех степеней окисления азота, до которых склонна восстанавливаться азотная кислота: Помимо этого, в некоторых случаях, реакция с разбавленной азотной кислотой проходит с выделением водорода, однако вместе с ним азот также восстанавливает в параллельных реакциях. Это может происходить при её взаимодействии, например, с магнием при концентрации кислоты около 5%: 6. Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
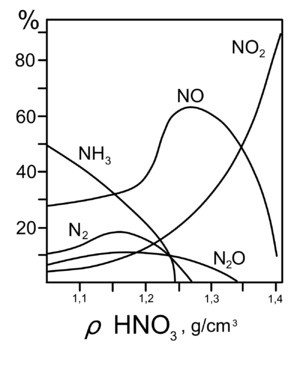 7. С золотом и платиной азотная кислота, даже концентрированная, не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причём в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа: 8. Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2: и сложные вещества, например: Чаще всего, эти реакции требуют начального нагревания
10. Смесь трёх объёмов концентрированной соляной кислоты и одного объёма концентрированной азотной называется «царской водкой». При комнатной температуре в реакции устанавливается равновесие. Оно смещается вправо при нагревании. Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила, который тоже разлагается и выделяет хлор: Итого: Эта же реакция также идёт с бромоводородной кислотой: На практике в данных реакциях визуально заметно выделение рыжего оксида азота(IV) NO2, поэтому часто его записывают в продуктах реакций вместо NO. 11. Взаимодействие концентрированных азотной и соляной кислот с благородными металлами: 12. Азотная кислота, растворяясь в воде, частично и обратимо с ней реагирует с образованием ортоазотной кислоты, которая не существует в свободном виде: Смесь азотной и серной кислот носит название «меланж». Азотная кислота широко используется для получения нитросоединений. 13. В концентрированной азотной кислоте происходит самоионизация: В большинстве окислительно-восстановительных реакциях ион нитрония восстанавливается до бурого газа. 14. Смесь фтористоводородной и азотной кислот может растворять некоторые металлы, нерастворимые в чистой кислоте и царской водке. Например, вольфрам: 15. Используется при проведении качественной реакции на белки, так называемой ксантопротеиновой реакции. В её ходе на исследуемый образец действуют азотной кислотой, что окрашивает его в желтый цвет. Подщелачивание образца даёт оранжевое окрашивание. 16. Важно отметить, что разбавленная водная азотная кислота (HNO3) не выделяет элементарный иод при смешении с иодидами (например, иодидом калия). Напротив, азотистая кислота HNO2 реагирует с иодидами даже при сильном разбавлении, что с успехом используется для её обнаружения на практике, например в реакциях диазотирования (иодкрахмальная индикаторная бумага синеет в присутствии избытка реагента). Однако концентрированная азотная кислота легко окисляет I- до I20, I+3 и I+5. НитратыАзотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы и некоторые соединения неметаллов, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется. 1. Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом: а) нитраты металлов, стоящих в ряду напряжений левее магния (исключая литий): б) нитраты металлов, расположенных в ряду напряжений между магнием и медью (а также литий): в) нитраты металлов, расположенных в ряду напряжений правее ртути: г) нитрат аммония: 2. Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твёрдом состоянии являются сильными окислителями, например, при сплавлении твёрдых веществ: 3. Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3: Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно. 4. С азотной кислотой не реагируют стекло, фторопласт-4. 5. Нитраты металлов при спекании с оксидами металлов образуют соли ортоазотной кислоты — ортонитраты: Промышленное производство и применение Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности. Производство азотной кислотыСовременный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой: Все три реакции — экзотермические, первая — необратимая, остальные — обратимые[6]. Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Для получения концентрированной азотной кислоты либо смещают равновесие в третьей реакции путём повышения давления до 50 атмосфер, либо в разбавленную азотную кислоту добавляют серную кислоту и нагревают, при этом азотная кислота, в отличие от воды и серной кислоты, испаряется[7]. В России масштабное производство азотной кислоты (10000 тонн в год) по этому методу началось в 1917 г. в Юзовке, сырьём служил аммиак из коксового газа по способу И. И. Андреева.[источник не указан 1389 дней] Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса: Дымящую кислоту высокой концентрации можно получить действием концентрированной хлорной кислоты на аммиак: Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой: Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды. Применение
Помимо этого, в ювелирном деле азотная кислота используется для быстрого определения концентрации золота в сплаве. Она будет реагировать со сплавами золота до 583 пробы, что позволяет определять содержание золота. Подбирая различные концентрации кислоты, можно более точно определять пробу. Помимо этого, особенности азотной кислоты возможно применить в очистке внешнего слоя ювелирных изделий. Так, при кипячении золотого украшения некоторой пробы (например, 585) в концентрированной азотной кислоте, она будет растворять металлы, находящиеся во внешнем слое (медь, никель, серебро, и иные), кроме золота, оставляя на поверхности слой более чистого золотого сплава (содержание золота может превышать 90%).[9][10] Действие на организм
При попадании азотной кислоты на кожу, необходимо соблюдать общие рекомендации: промыть место попадания большим количеством чистой воды, после чего промыть содовым раствором. При попадании кислоты в глаза, необходимо срочно промыть глаза большим количеством проточной воды и обратиться за медицинской помощью. ПДК для азотной кислоты в воздухе рабочей зоны по NO2 2 мг/м3[11]. Рейтинг NFPA 704 для концентрированной азотной кислоты:
ЮникодВ Юникоде есть алхимический символ азотной кислоты (лат. Aqua fortis).
См. такжеПримечания
Литература
Ссылки
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




![{\displaystyle {\ce {4HNO3 ->[hv] 4 NO2 ^ + 2H2O + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8410f5283b0b6d2c782a837412142e28a4b1f027)


































![{\displaystyle {\ce {I2 + 10HNO3 (70\%) ->[t] 2HIO3 + 10NO2 ^ + 4H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fdb62826d2c59cb499ee631fb92f35c5cf3fd20c)

![{\displaystyle {\ce {HI + 6HNO3 (60\%) ->[t] HIO3 + 6NO2 ^ + 3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68a30fba2b720c8c0e8240e016c132560e4912cd)
![{\displaystyle {\ce {SO2 + 2HNO3 (60\%) ->[t] H2SO4 + 2NO2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d9110dfb6705f6ed2e54fd5dfe385b68b3c2c3f6)




![{\displaystyle {\ce {Au + HNO3 + 4HCl -> H[AuCl4] + NO ^ + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ae3a5bd1367225a778b385ae260c06f523caaf6)
![{\displaystyle {\ce {3Pt + 4HNO3 + 18HCl -> 3H2[PtCl6] + 4NO ^ + 8H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7d99147147da8f6d12e2b2e1ff472415ffb77c8)



![{\displaystyle {\ce {2KNO3 ->[450^{o}C] 2KNO2 + O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5a828f34de52f0566e612efe343599163fde315)
![{\displaystyle {\ce {4Al(NO3)3 ->[180^{o}C] 2Al2O3 + 12NO2 ^ + 3O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df9bbf6e759de9befb4c73fb1f81d1e7895622bd)
![{\displaystyle {\ce {2AgNO3 ->[400^{o}C] 2Ag + 2NO2 ^ + O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/718e9530aae2ea8e04d84a5d8567e738923025e5)
![{\displaystyle {\ce {NH4NO3 ->[240^{o}C] N2O ^ + 2H2O ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ac99e553e1ecffe3e1b5800935a48081a3e5a0b3)
![{\displaystyle {\ce {Fe + 3KNO3 + 2KOH ->[420^{o}C] K2FeO4 + 3KNO2 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db21d339bd2cf4d5e02807712da952ec9a3328fb)
![{\displaystyle {\ce {3KNO3 + 8Al + 5KOH + 18H2O -> 3NH3 ^ + 8K[Al(OH)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3719f57c31be45ccb17d41b9dcf33f385574342d)
![{\displaystyle {\ce {Na2O + NaNO3 ->[310-320^{o}C] Na3NO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a0ecba42b061decf8e712b3f8fa67bb1d5f74e37)
![{\displaystyle {\ce {4NH3 + 5O2 ->[Pt/Rh] 4NO ^ + 6H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/22109c792bedab25222488274f7c4c771f3f8e62)


![{\displaystyle {\ce {4KNO3 + 2FeSO4*7H2O ->[^{o}t] Fe2O3 + 2K2SO4 + 2HNO3 ^ + 2NO2 ^ + 6H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4c81103ef62154030c04a1588f491291da8da8af)

![{\displaystyle {\ce {KNO3 + H2SO4 ->[^{o}t] KHSO4 + HNO3 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b89d63f0dcc2c55655a3f5c7b434f0fac3b2303d)