|
Уксусная кислота
У́ксусная кислота́ (эта́новая кислота, химическая формула — C2H4O2 или CH3COOH, AcOH) — cлабая одноосновная органическая кислота, относящаяся к классу предельных карбоновых кислот. При стандартных условиях уксусная кислота — бесцветная жидкость с характерным резким запахом и кислым вкусом. Соли и сложные эфиры уксусной кислоты называются ацета́тами. История Уксус является продуктом брожения вина и известен человеку с давних времен. Первое упоминание о практическом применении уксусной кислоты относится к III веку до н. э. Греческий учёный Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения свинцовых белил, а также ярь-медянки (зелёной смеси солей меди, содержащей, помимо прочего, ацетат меди). В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». Сапа содержала большое количество ацетата свинца, который также называют свинцовым сахаром или сахаром Сатурна. Высокая популярность сапы была причиной хронического отравления свинцом, распространённого среди римской аристократии[8]. В VIII веке арабский алхимик Джабир ибн Хайян впервые изложил способы получения уксуса. Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон). Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреасом Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Огюстом Аде (фр. Pierre Auguste Adet)[8][9]. В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту[10]. В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия — в 1910 году ею было произведено более 10 тысяч тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго[8][11]. Физические свойства Уксусная кислота — бесцветная жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Смешивается с водой в любых соотношениях, а также со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. В растворах и парах присутствует в виде циклических и линейных димеров[12]. Абсолютная уксусная кислота называется ледяной, так как при замерзании образует льдовидную массу. Способ получения ледяной уксусной кислоты в 1789 году открыл российский химик немецкого происхождения Товий Егорович Ловиц.
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
ПолучениеВ промышленностиРанними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана[13]. Ацетальдегид окислялся в присутствии ацетата марганца(II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 % при температуре +50—+60 °С. Окисление н-бутана проводилось при 150 атм. Катализатором этого процесса являлся ацетат кобальта. Оба метода основаны на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными и были вытеснены более совершенными каталитическими процессами карбонилирования метанола[13]. Каталитическое карбонилирование метанола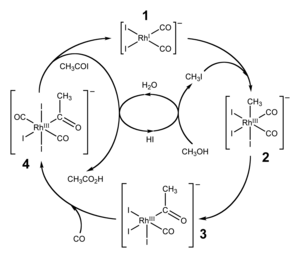 Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола монооксидом углерода[14], которое происходит по формальному уравнению: Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом[15]. Катализатором превращения служил йодид кобальта. Метод заключался в барботировании монооксида углерода при температуре 180 °С и давлениях 200—700 атм через смесь реагентов. Выход уксусной кислоты составляет 90 % по метанолу и 70 % по СО. Одна из установок была построена в Гейсмаре (шт. Луизиана) и долго оставалась единственным процессом BASF в США[16]. Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году[17][18]. Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO)[13]. Этим способом получают чуть более 50 % всей промышленной уксусной кислоты[19]. В процессе фирмы BP в качестве катализаторов используются соединения иридия. Биохимический способ производстваПри биохимическом производстве уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этанола[20]. Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольдегидрогеназы. Это сложный многоступенчатый процесс, который описывается формальным уравнением[21]: Химические свойстваУксусная кислота обладает всеми свойствами карбоновых кислот и иногда рассматривается как их наиболее типичный представитель (в отличие от муравьиной кислоты, которая обладает некоторыми свойствами альдегидов). Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства. В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1,0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %. На слабой диссоциации уксусной кислоты в водном растворе основана качественная реакция на наличие солей уксусной кислоты: к раствору добавляется сильная кислота (например, серная), если появляется запах уксусной кислоты, значит, соль уксусной кислоты в растворе присутствует (кислотные остатки уксусной кислоты, образовавшиеся из соли, связались с катионами водорода от сильной кислоты и получилось большое количество молекул уксусной кислоты)[22].  Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями[23]. Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты: Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота:  Этим путём могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты. Уксусная кислота может быть восстановлена до этанола действием алюмогидрида лития. Она также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусной кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана и карбоната натрия. Взаимодействует как с растворимыми гидроксидами (щелочами), так и с нерастворимыми гидроксидами Уксусная кислота в биохимии организмовУксусная кислота образуется в живых организмах в процессе углеводного обмена, в том числе в организме человека в процессе биохимических реакции, в частности в цикле Кребса, утилизации алкоголя. ПрименениеУксусную кислоту, концентрация которой близка к 100 %, называют «ледяной». 70—80%-й водный раствор уксусной кислоты называют «уксусной эссенцией», а 3—15%-й — «уксусом»[24]. Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии[25], а также в консервировании и для избавления от накипи. Однако количество уксусной кислоты, используемой в качестве уксуса, очень мало, по сравнению с количеством уксусной кислоты, используемой в крупнотоннажном химическом производстве. Уксусную кислоту применяют для получения лекарственных и душистых веществ, таких как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении. Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту. Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния (что является нежелательным, если только это необходимо для его эвакуации из опасного места его собственными силами). Токсикология
Местное действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %[12]. Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины[28]. Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена[29]. Смертельная разовая доза составляет примерно 20 мл (при энтеральном приёме в перерасчёте на 100 % кислоту). Последствиями приёма внутрь концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; общетоксические последствия отравления уксусной кислотой — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени. В качестве первой помощи при приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог, также кислое содержимое может попасть в дыхательные пути. Допускается в целях нейтрализации кислоты и защиты слизистой приём жжёной магнезии, сырого яичного белка, киселя. Нельзя употреблять в этих целях соду, так как образующийся углекислый газ и вспенивание будет также способствовать забросу кислоты обратно в пищевод, гортань, а также может привести к прободению стенок желудка. Показано промывание желудка через зонд. Необходима немедленная госпитализация. При ингаляционном отравлении парами требуется ополоснуть слизистые водой или 2 % раствором пищевой соды, приём внутрь молока, слабого щелочного раствора (2 % сода, щелочные минеральные воды) с последующей госпитализацией. Примечания
Ссылки |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||









![{\displaystyle {\mathsf {C_{2}H_{2}+H_{2}O{\xrightarrow[{}]{Hg^{2+}}}CH_{3}CHO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1265093ffe50f2d20201276ae0bccb06deb88b78)
![{\displaystyle {\mathsf {CH_{3}CHO{\xrightarrow[{}]{CrO_{3},H_{2}SO_{4}}}CH_{3}COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d2454a6f7a2d61114024a921740f2b40dc6fad18)


