|
Химические индикаторыИндика́тор (лат. indicator — указатель) — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH, еН и другие параметры. История открытияКислотно-основные индикаторы применяются для установления между кислотами и основаниями, или других реакций, если в них участвуют ионы Н+, а также для химического определения рН водных растворов. Причина изменения цвета индикатора в том, что присоединение или отдача протонов его молекулами связаны с заменой одних хромофорных групп другими или с появлением новых хромофорных соединений. Вероятно, самым древним кислотно-основным индикатором является лакмус. Лакмус был известен уже в Древнем Египте и Древнем Риме. Лакмус (от гол. lakmoes) — красящее вещество, добываемое из некоторых видов лишайников. Фактически природный лакмус представляет собой сложную смесь. Его основными компонентами являются: азолитмин (C9H10NO5) и эритролитмин (С13H22O6). Лакмус в древности использовали в качестве фиолетовой краски, но со временем рецепт его приготовления был утерян. В 1640 ботаники описали гелиотроп (Heliotropium Turnesole) — душистое растение с тёмно-лиловыми цветками, из которого было выделено красящее вещество. Этот краситель, наряду с соком фиалок, стал широко применяться химиками в качестве индикатора, который в кислой среде был красным, а в щелочной — синим. В 1667 году знаменитый химик и физик Роберт Бойль предложил пропитывать фильтровальную бумагу отваром тропического лишайника — лакмуса, а также отварами фиалок и васильков, и таким образом положил начало применению индикаторной (лакмусовой) бумаги. Применение индикаторовИндикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции. Индикаторы, удовлетворяющие ряду требований (высокое светопоглощение индикатора; контрастный переход окраски; узкая область перехода окраски), применяются для фиксирования конца титрования[1]. Широко используются кислотно-основные индикаторы, разбавленные растворы которых обладают способностью заметно изменять цвет, в зависимости от кислотности раствора[2]. Причина изменения цвета — изменения в строении молекул индикатора в кислой и щелочной среде, что приводит к изменению спектра поглощения раствора. Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки. Структура молекул и цвет индикаторовТрифенилметановые красители-индикаторы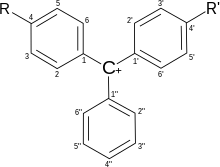 Трифенилметановые красители широко используются в качестве индикаторов. В зависимости от типа заместителей изменения структуры молекулы приводят к широкой гамме цветных соединений, большинство из которых могут служить химическими индикаторами.
Производные азобензола . Виды индикаторов
Распространённые кислотно-основные индикаторы
МеталлоиндикаторыОкислительно-восстановительные индикаторыОкислительно-восстановительные индикаторы изменяют цвет в зависимости от присутствия в растворе окислителей или восстановителей. Дифениламин бесцветен в восстановленной форме, но имеет фиолетовый цвет в окисленном состоянии. Метиленовый синий (синька) также бесцветен в восстановленной форме и имеет синий цвет в окисленном состоянии. Некоторые ярко окрашенные вещества сами могут служить индикатором. Например, при перманганатометрическом определении железа(II) 10FeSO4 + 2KMnO4+ 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O добавляемый в ходе титрования раствор перманганата обесцвечивается, пока не будут окислены все ионы Fe2+, имевшиеся в исследуемом растворе. Точка эквивалентности определяется по розовой окраске раствора, из-за возникшего избытка перманганат-анионов. Хингидрон также является окислительно-восстановительным индикатором. Это смесь хинона и гидрохинона. Адсорбционные индикаторыТермоиндикаторыВ качестве термоиндикатора можно использовать бумагу, смоченную хлоридом кобальта(II). При нагревании кристаллогидрат теряет связанную воду и меняет последовательно цвет с розового через красный, фиолетовый и синий на бесцветный. Химические индикаторы влажностиРастительные пигментыПигменты — органические соединения, присутствующие в клетках и тканях растений и окрашивающие их. Расположены пигменты в хлоропластах и хромопластах. В растительном мире известно около 2 тысяч пигментов. Наиболее стойкими являются 150. Некоторые из них представлены в таблице. Накапливаются пигменты главным образом в корнях, цветках, кожуре плодов и в листьях растений. Общее название растительных пигментов — биофлавоноиды. Это фенольные соединения, продукты жизнедеятельности растений. Большинство хорошо растворимы в воде, не растворимы в этиловом эфире, хлороформе и бензоле. Особенно богаты ими листья чая, цветы и листья гречихи, софоры японской, плоды цитрусовых, шиповника и черноплодной рябины (эти растения служат сырьём для производства медицинских препаратов). Значительные количества содержатся также в красном перце, чёрной смородине, землянике, малине, вишне, облепихе, некоторых сортах яблок, слив и винограда. Многие биофлавоноиды придают окраску цветам и плодам растений. Все пигменты можно разделить на три группы — хлорофиллы, каротиноиды, антоцианы. Хлорофилл определяет зелёную окраску листьев. Без этого изумрудного пигмента невозможна жизнь на планете, так как он осуществляет фотосинтез. Спутниками хлорофилла являются каротиноиды, которые определяют жёлтое, оранжевое и красное окрашивание. Так, жёлтые зерна кукурузы, оранжевая кожура мандарина, красные плоды шиповника своей окраской обязаны каротиноидам. Третья группа пигментов — антоцианы, которые определяют практически все краски растений — от оранжевой и красной до синей. Особый интерес представляют пигменты третьей группы — антоцианы, которые обладают хорошими индикаторными свойствами.
См. такжеПримечания
Литература
|