Chemical compound
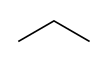
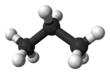
โพรเพน (อังกฤษ : propane ) เป็นสารประกอบอินทรีย์ ที่มีสูตรเคมี C3 H8 ลักษณะเป็นแก๊สไม่มีสี ไม่มีกลิ่น มีความไวไฟสูง สามารถบีบอัดให้เป็นของเหลวเพื่อใช้ขนส่งได้ ค้นพบโดยมาร์เซลแล็ง แบร์เธโล ในปี ค.ศ. 1857[ 5] เอดมันด์ โรนัลส์ ในปี ค.ศ. 1864[ 6] กรดโพรพิโอนิก ซึ่งมีรากศัพท์มาจากคำภาษากรีกโบราณสองคำคือ πρῶτος (prôtos) แปลว่า แรก และ πίων (píōn) แปลว่า ไขมัน[ 7]
โพรเพนเป็นสารไฮโดรคาร์บอน ชนิดแอลเคน ที่มีคาร์บอน 3 อะตอมเชื่อมต่อกันด้วยพันธะเดี่ยว โพรเพนมีโครงสร้างเป็นโซ่ตรง ทำให้มีพื้นที่ผิวสัมผัสระหว่างโมเลกุลมาก ส่งผลให้มีแรงระหว่างโมเลกุลมากตามไปด้วย การมีแรงระหว่างโมเลกุลมากทำให้ต้องใช้พลังงานในการสลายแรงดังกล่าวของโพรเพนมากกว่าแอลเคนที่มีโมเลกุลน้อยกว่าอย่างมีเทน และอีเทน [ 8] [ 9] ไฮโดรเจน และคาร์บอน มีค่าอิเล็กโตรเนกาทิวิตี ใกล้เคียงกัน จึงไม่เกิดโมเมนต์ขั้วคู่ (dipole moment) ส่งผลให้โพรเพนไม่ละลายน้ำ แต่ละลายในตัวทำละลายมีขั้ว เช่น เฮกเซน เบนซีน โทลูอีน และคลอโรฟอร์ม [ 10] น้ำมันดิบ และแก๊สธรรมชาติ และเป็นสารกลุ่มแรก ๆ ที่ถูกแยกออกเมื่อมีการกลั่นลำดับส่วนเนื่องจากมีจุดเดือดต่ำกว่าสารชนิดอื่น[ 11]
โพรเพนใช้เป็นแก๊สเชื้อเพลิง และเป็นแก๊สปิโตรเลียมเหลว (LPG) หรือแก๊สหุงต้มเมื่อผสมกับบิวเทน และสารไฮโดรคาร์บอนอื่น ๆ นอกจากนี้โพรเพนยังใช้เป็นสารขับดัน สารทำความเย็น และเป็นสารตั้งต้นในการผลิตโพรพีน ซึ่งเป็นวัตถุดิบหลักในอุตสาหกรรมพลาสติก[ 12] [ 13] สารระเหย ที่เมื่อสูดดมเข้าไปจะทำให้ปวดศีรษะ เวียนศีรษะ คลื่นไส้ อ่อนแรง หมดสติและอาจเสียชีวิตจากภาวะขาดอากาศหายใจ [ 14] [ 15]
↑ 1.0 1.1 "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book) . Cambridge: The Royal Society of Chemistry . 2014. p. 4. doi :10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 Similarly, the retained names 'ethane', 'propane', and 'butane' were never replaced by systematic names 'dicarbane', 'tricarbane', and 'tetracarbane' as recommended for analogues of silane, 'disilane’; phosphane, 'triphosphane'; and sulfane, 'tetrasulfane'. ↑ Record of Propane in the GESTIS Substance Database of the Institute for Occupational Safety and Health↑ 3.0 3.1 3.2 NIOSH Pocket Guide to Chemical Hazards. "#0524" . National Institute for Occupational Safety and Health (NIOSH). ↑ GOV, NOAA Office of Response and Restoration, US. "PROPANE – CAMEO Chemicals – NOAA" . cameochemicals.noaa.gov . ↑ "Comptes rendus hebdomadaires des séances de l'Académie des sciences" (ภาษาฝรั่งเศส). 140 . 1905.↑ Roscoe, H.E.; Schorlemmer, C. (1881). Treatise on Chemistry . Vol. 3. Macmillan. pp. 144–145. ↑ "propane" . Online Etymology Dictionary . สืบค้นเมื่อ December 8, 2019 .↑ Rawn, J. David; Ouellette, Robert J. (2018). Organic Chemistry: Structure, Mechanism, Synthesis ISBN 9780128128398 ↑ "Physical Properties of Alkanes" . Chemistry LibreTexts . February 13, 2019. สืบค้นเมื่อ December 8, 2019 .↑ "Chemical Formula for Propane" . Sciencing . October 25, 2018. สืบค้นเมื่อ December 8, 2019 .↑ Nolan, Dennis P. (2013). Handbook of Fire & Explosion Protection Engineering Principles for Oil, Gas, Chemical, & Related Facilities ISBN 9780080946313 ↑ "Propane" . Britannica . สืบค้นเมื่อ December 8, 2019 .↑ "Propane" . New World Encyclopedia . June 16, 2019. สืบค้นเมื่อ December 8, 2019 .↑ "Propane - Tox Town" . National Institutes of Health (NIH) . คลังข้อมูลเก่าเก็บจากแหล่งเดิม เมื่อ 2019-12-07. สืบค้นเมื่อ December 8, 2019 .↑ "Propane poisoning" . MedlinePlus Medical Encyclopedia . January 12, 2019. สืบค้นเมื่อ December 8, 2019 .