|
Klorin
Klorin (bahasa Latin: chlorum; bahasa Inggris: chlorine), yang juga disebut klor, adalah unsur kimia dengan lambang Cl dan nomor atom 17. Senyawa ini adalah halogen kedua paling ringan, berada diantara fluor dan bromin dalam tabel periodik dan sifat-sifatnya sebagian besar di antara mereka. Klorin berwujud gas berwarna kuning-hijau pada suhu kamar. Unsur ini merupakan elemen sangat reaktif dan oksidator kuat: klorin mempunyai afinitas elektron tertinggi dan elektronegativitas ketiga tertinggi di belakang oksigen dan fluor. Senyawa klorin yang paling umum seperti natrium klorida (garam dapur), telah dikenal sejak zaman kuno. Sekitar tahun 1630, gas klorin pertama kali disintesis melalui reaksi kimia, tetapi belum dikenal sebagai substansi yang penting. Carl Wilhelm Scheele menulis deskripsi gas klorin pada tahun 1774, menganggapnya itu sebagai oksida sebuah unsur baru. Pada tahun 1809, ahli kimia menyatakan bahwa gas ini mungkin adalah elemen murni, dan hal ini dikonfirmasi oleh Sir Humphry Davy pada tahun 1810, yang dinamai dari bahasa Yunani Kuno: χλωρός berdasarkan warnanya. Karena reaktivitasnya, semua klorin di kerak Bumi dalam bentuk senyawa ion klorida (termasuk juga garam dapur). Unsur ini adalah halogen paling melimpah kedua di bumi (setelah fluor) dan unsur kimia ke-21 paling melimpah di kerak Bumi. Deposit yang besar ini terlihat kecil karena sebagian besar klorida terdapat dalam air laut. Unsur klorin secara komersial diproduksi dari air garam dengan elektrolisis. Tingginya potensial oksidasi dari unsur klorin memicu pengembangan pemutih dan desinfektan komersial, serta reagen untuk banyak proses di industri kimia. Klorin digunakan dalam pembuatan berbagai macam produk konsumen, sekitar dua-pertiganya merupakan bahan kimia organik seperti polivinil klorida. Klorin juga digunakan sebagai intermediet dalam produksi plastik dan produk akhir lain yang tidak mengandung unsur ini. Sebagai disinfektan, unsur maupun senyawa klorin digunakan langsung di kolam renang untuk kebersihan dan sanitasi. Unsur klorin dalam konsentrasi yang tinggi sangat berbahaya dan beracun bagi semua makhluk hidup. Senyawa ini digunakan dalam Perang Dunia I sebagai yang gas senjata kimia pertama. Dalam bentuk ion klorida, klorin diperlukan untuk semua spesies hidup. Jenis senyawa klorin lain jarang ada dalam organisme hidup, dan senyawa organik lain yang mengandung klor dibuat dari yang inert sampai beracun. Di atas atmosfer, molekul organik yang mengandung klorin seperti klorofluorokarbon telah mengakibatkan penipisan ozon. Sejarah Senyawa klorin paling umum, natrium klorida, telah dikenal sejak zaman kuno, para arkeolog telah menemukan bukti bahwa batu garam telah digunakan sejak awal 3000 SM dan air garam sejak awal 6000 SM.[5] Pentingnya zat ini dalam makanan sangat terkenal di zaman klasik dan kadang-kadang digunakan sebagai pembayaran layanan jenderal Romawi dan tribun militer. Unsur klorin adalah mungkin pertama kali diisolasi sekitar 1200 dengan penemuan aqua regia dan kemampuannya untuk melarutkan emas, karena gas klorin adalah salah satu produk dari reaksi ini: namun saat itu tidak diakui sebagai zat baru. Sekitar tahun 1630, klorin dikenal sebagai gas oleh ahli kimia Flemish dan dokter Jan Baptist van Helmont.[note 1][6] Elemen ini pertama kali dipelajari secara rinci pada tahun 1774 oleh kimiawan Swedia Carl Wilhelm Scheele, dan ia dianggap sebagai penemunya.[7][8] Scheele memproduksi klorin dengan mereaksikan MnO2 (sebagai mineral pirolusit) dengan HCl:[6]
Scheele mengamati beberapa sifat klorin: efek pemutihan pada lakmus, mematikan pada serangga, berwarna kuning-hijau, dan bau mirip dengan aqua regia.[9] Saat itu ia belum berhasil membuat klorin sebagai elemen tersendiri.[8] Teori kimia umum pada waktu itu menyatakan bahwa asam adalah senyawa yang mengandung oksigen (sisa-sisa ini bertahan di Jerman dan Belanda untuk nama-nama oksigen: sauerstoff atau zuurstof, apabila diterjemahkan ke dalam bahasa Indonesia adalah zat asam), sehingga sejumlah ahli kimia, termasuk Claude Berthollet, menyarankan bahwa senyawa yang ditemukan Scheele ini merupakan kombinasi dari oksigen dan unsur yang belum ditemukan, muriaticum.[10][11] Pada tahun 1809, Joseph Louis Gay-Lussac dan Louis-Jacques Thénard mencoba untuk menguraikan senyawa yang ditemukan Scheele dengan mereaksikannnya dengan arang untuk melepaskan elemen muriaticum bebas (dan karbon dioksida). Mereka tidak berhasil dan menerbitkan laporan di mana mereka menganggap adanya kemungkinan bahwa zat ini merupakan unsur, tapi belum yakin.[12] Pada tahun 1810, Sir Humphry Davy mencoba percobaan ini kembali, dan disimpulkan bahwa substansi ini adalah suatu unsur, dan bukan senyawa.[8] Ia mengumumkan hasilnya ke Royal Society tanggal 15 November tahun itu.[6] Pada waktu itu, ia menamai elemen baru ini sebagai "klorin", dari kata yunani χλωρος (chlōros), yang berarti hijau-kuning.[13] Nama "halogen", yang berarti "penghasil garam", awalnya digunakan untuk klorin pada tahun 1811 oleh Johann Salomo Christoph Schweigger.[14] Istilah Ini kemudian digunakan sebagai istilah umum untuk menggambarkan semua unsur-unsur keluarga klorin (fluor, bromin, yodium), setelah saran dari Jöns Jakob Berzelius pada tahun 1826.[15][16] Pada tahun 1823, Michael Faraday membuat klorin cair untuk pertama kalinya,[17][18][19] dan menunjukkan apa yang kemudian dikenal sebagai "klorin padat" yang memiliki struktur klorin hidrat (Cl2·H2O).[6] Gas klorin pertama kali digunakan oleh kimiawan Prancis Claude Berthollet untuk pemutih tekstil pada tahun 1785.[20][21] Pemutih modern dihasilkan dari pekerjaan lebih lanjut oleh Berthollet, yang pertama kali memproduksi natrium hipoklorit pada tahun 1789 di laboratorium di Javel (sekarang bagian dari Paris, Prancis), dengan melewatkan gas klorin pada larutan natrium karbonat. Cairan yang dihasilkan, yang dikenal sebagai "Eau de Javel" ("air Javel"), adalah larutan lemah dari natrium hipoklorit. Proses ini sangat tidak efisien, dan alternatif metode produksi dicari. Kimiawan Skotlandia dan industrialis Charles Tennant pertama kali menghasilkan larutan kalsium hipoklorit ("kapur klorinasi"), kemudian kalsium hipoklorit padat (bubuk pemutih).[20] Senyawa-senyawa ini menghasilkan kadar unsur klorin yang rendah dan lebih efisien diangkut daripada natrium hipoklorit, yang tetap sebagai larutan encer karena ketika dimurnikan dengan menghilangkan kandungan air, senyawa ini menjadi oksidator sangat kuat dan tidak stabil. Menjelang akhir abad kesembilan belas, S. E. Smith mematenkan metode produksi natrium hipoklorit yang melibatkan elektrolisis air garam untuk menghasilkan natrium hidroksida dan gas klorin, yang kemudian dicampur untuk membentuk natrium hipoklorit.[22] Hal Ini dikenal sebagai proses kloroalkali, pertama kali diperkenalkan pada skala industri pada tahun 1892, dan sekarang menjadi sumber untuk produksi sebagian besar unsur klorin dan natrium hidroksida.[23] Pada tahun 1884 Chemischen Fabrik Griesheim, Jerman mengembangkan lagi proses kloroalkali yang mulai diproduksi komersial pada tahun 1888.[24] Larutan klorin yang dilarutkan dalam kimia dasar (natrium dan kalsium hipoklorit) pertama kali digunakan sebagai agen anti-pembusukan dan desinfektan pada tahun 1820-an, di Prancis, jauh sebelum pembentukan teori kuman penyakit. Praktek ini dirintis oleh Antoine-Germain Labarraque, yang menyesuaikan pemutih "air Javel" Berthollet.[25] Unsur klorin kemudian berperan sebagai antisepsis (luka irigasi solusi dan sejenisnya) dan sanitasi masyarakat, khususnya dalam kolam dan air minum.[9] Gas klorin pertama kali digunakan sebagai senjata pada tanggal 22 April 1915, di Ypres oleh Tentara Jerman.[26][27] Efeknya pada sekutu sangat menghancurkan karena masker gas yang ada saat itu sulit untuk disebarkan dan belum secara luas didistribusikan.[28][29] IsotopKlorin memiliki 2 isotop stabil, 35Cl dan 37Cl. 2 isotop ini merupakan 2 isotop alam yang ada, dengan perbandingan di alam 35Cl 76% dan 37Cl 24% sisanya. Keduanya disintesa di bintang pada proses pembakaran oksigen dan pembakaran silikon.[30] Keduanya memiliki spin nuklir 3/2+ dan oleh karena itu dapat digunakan untuk resonansi magnetik nuklir, meski besaran spin lebih besar dari 1/2 akan menghasilkan distribusi muatan nuklir non-lingkar dam akhirnya resonansi meluas sebagai akibat dari momen kuadrupol nuklir dan resultan relaksasi kuadrupolar tidak nol. Isotop klorin yang lain semuanya radioaktif dengan waktu-paruh yang terlalu cepat. Dari semuanya, yang paling umum digunakan di laboratorium adalah 36Cl (t1/2 = 3.0×105 thn) dan 38Cl (t1/2 = 37.2 menit), yang bisa dibuat dari aktivasi neutron klorin alam.[31] Radioisotop klorin yang paling stabil adalah 36Cl. Mode peluruhan utama isotop yang lebih ringan dari 35Cl adalah penangkapan elektron terhadap isotop-isotop sulfur; isotop yang lebih berat dari 37Cl adalah peluruhan beta terhadap isotop-isotop argon; dan 36Cl dapat meluruh menjadi 36S atau 36Ar stabil.[32] Dalam lingkungan subpermukaan, penangkapan muon oleh 40Ca digunakan untuk menghasilkan 36Cl.[33][34] Kimia dan senyawa
Klorin bersifat intermediet dalam hal reaktivitas diantara fluor dan bromin, dan merupakan salah satu elemen paling reaktif. Klorin merupakan oksidator yang lebih lemah dari fluor namun lebih kuat dari bromin atau yodium. Hal ini dapat dilihat dari potensial elektrode standar pasangan X2/X− (F, +2.866 V; Cl, +1.395 V; Br, +1.087 V; I, +0.615 V; At, +0.3 V). However, this trend is not shown in the bond energies because fluorine is singular due to its small size, low polarisability, and lack of low-lying d-orbitals available for bonding (which chlorine has). As another difference, chlorine has a significant chemistry in positive oxidation states while fluorine does not. Chlorination often leads to higher oxidation states than bromination or iodination but lower oxidation states to fluorination. Klorin cenderung untuk bereaksi dengan senyawa yang memiliki ikatan M–M, M–H, atau M–C untuk membentuk ikatan M–Cl.[35] Diketahui bahwa E°(12O2/H2O) = +1.229 V (kurang dari +1.395 V) maka dapat diperkirakan bahwa klorin semestinya dapat mengoksidasi air menjadi oksigen dan asam hidroklorat. However, the kinetics of this reaction are unfavorable, and there is also a bubble overpotential effect to consider, so that electrolysis of aqueous chloride solutions evolves chlorine gas and not oxygen gas, a fact that is very useful for the industrial production of chlorine.[36] Asam klorida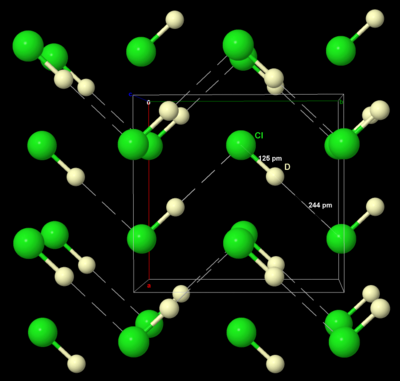 Senyawa klorin yang paling sederhana adalah asam klorida, HCl, merupakan bahan kimia utama dalam industri dan laboratorium, baik dalam bentuk gas maupun larut dalam air dalam bentuk asam hidroklorat. Sering juga diproduksi dengan membakar gas hidrogen dalam gas klorin, atau sebagai produk samping dalam klorinasi hidrokarbon. Pendekatan lainnya adalah mencampur natrium klorida dengan asam sulfat pekat untuk menghasilkan asam hidroklorat, disebut juga dengan proses "salt-cake":[37]
Dalam laboratorium, gas asam klorida dapat dibuat dengan mengeringkan asam ini dengan asam sulfat pekat. Deuterium klorida, DCl, dapat dibuat dengan mereaksikan benzoil klorida dengan air berat (D2O).[37] Pada suhu ruang, asam klorida berwujud gas tak berwarna, sama seperti semua hidrogen halida kecuali hidrogen fluorida, karena hidrogen tak dapat membentuk ikatan hidrogen yang kuat dengan atom klorin yang keelektronegatifannya lebih besar.[37] Asam klorida merupakan asam kuat (pKa = −7) karena ikatan hidrogen dengan klorin terlalu lemah untuk terdisosiasi. Sistem HCl/H2O memiliki banyak bentuk hidrat HCl·nH2O untuk n = 1, 2, 3, 4, dan 6. Campuran HCl dan H2O melebihi 1:1 akan membuat sistem terpisah menjadi 2 fase liquid yang berbeda. Asam klorida membentuk azeotrop dengan titik didih 108.58 °C pada 20.22 g HCl per 100 g larutan, maka asam klorida tidak dapat dipekatkan lebih jauh lagi melewati ini melalui distilasi.[38] Tidak seperti asam fluorida, asam klorida anhidrat sulit untuk digunakan sebagai pelarut, karena titik didihnya rendah, rentang cairnya kecil, konstanta dielektriknya kecil dan tidak terdisosiasi merata menjadi ion-ion H2Cl+ dan HCl−2 dan jauh lebih tak stabil daripada ion bifluorida (HF−2) karena lemahnya ikatan hidrogen antara klorin dan hidrogen. Asam klorida anhidrat adalah pelarut yang buruk, hanya dapat melarutkan senyawa yang kecil seperti nitrosil klorida dan fenol, atau garam dengan energi kisi sangat rendah seperti tetraalkilamonium halida. Senyawa ini siap memprotonasi elektrofil yang berisi ikatan π. Solvolisis, reaksi penggantian ligan, dan oksidasi telah dikarakterisasi dengan baik pada larutan asam klorida:[39]
Senyawa poliklorinMeskipun klorin adalah oksidator kuat dengan energi ionisasi pertama tinggi, senyawa ini dapat teroksidasi pada kondisi ekstrim membentuk kation Cl+2 . Senyawa ini sangat tak stabil dan hanya dikarakterisasi oleh spektrum pita elektronik ketika diproduksi dalam tabung discharge bertekanan rendah. Kation Cl+3 yang berwarna kuning lebih stabil dan dapat diproduksi sebagai berikut:[40]
Reaksi ini dilakukan dalam pelarut arsenik pentafluorida. Anion triklorida, Cl−3, juga telah dikarakterisasi, analog dengan triiodida.[41] Fluorida klorinTiga fluorida klorin membentuk sekelompok senyawa interhalogen yang semuanya diamagnetik.[41] Beberapa turunan kation dan anion diketahui, seperti ClF−2, ClF−4, ClF+2, dan Cl2F+.[42] Beberapa pseudohalida klorin juga diketahui, seperti sianogen klorida (ClCN, linear), klorin sianat (ClNCO), klorin tiosianat (ClSCN, unlike its oxygen counterpart), dan klorin azida (ClN3).[41] Klorin monofluorida (ClF) stabil secara termal, dan dijual komersial dalam botol 500-gram. Merupakan gas tak berwarna yang melebur pada −155.6 °C dan mendidih pada −100.1 °C. It may be produced by the direction of its elements at 225 °C, though it must then be separated and purified from klorin trifluorida dan reaktannya. Karakteristiknya sendiri berada di tengah-tengah antara klorin dan fluor. It will react with many metals and nonmetals from room temperature and above, fluorinating them and liberating chlorine. It will also act as a chlorofluorinating agent, adding chlorine and fluorine across a multiple bond or by oxidation: for example, it will attack karbon monoksida to form karbonil klorofluorida, COFCl. It will react analogously with heksafluoroaseton, (CF3)2CO, dengan katalis kalium fluorida untuk menghasilkan heptafluoroisopropil hipoklorit, (CF3)2CFOCl; with nitriles RCN to produce RCF2NCl2; and with the sulfur oxides SO2 and SO3 to produce ClOSO2F and ClSO2F respectively. Senyawa ini juga bereaksi eksotermis dengan senyawa yang memiliki gugus –OH dan –NH, seperti air:[41]
Klorin trifluorida (ClF3) berbentuk cairan tak berwarna volatil yang melebur pada −76.3 °C dan mendidih pada 11.8 °C. Senyawa ini dapat dibuat dengan memfluorinasi langsung gas klorin atau klorin monofluorida pada 200–300 °C. Senyawa ini merupakan salah satu senyawa kimia paling reaktif, bereaksi dengan banyak substansi termasuk yang beberapa diantaranya dianggap inert, seperti asbestos, beton, dan pasir. Senyawa ini meledak apabila berkontak dengan air dan sebagian besar senyawa organik lain. The list of elements it sets on fire is diverse, containing hidrogen, kalium, fosfor, arsenik, antimon, sulfur, selenium, telurium, bromin, iodine, dan molibdenum, tungsten, rodium, iridium, serta besi bubuk. An impermeable fluoride layer is formed by natrium, magnesium, aluminium, seng, timah, and perak, which may be removed by heating. Ketika dipanaskan, golongan logam mulia seperti paladium, platina, dan emas juga bereaksi ditambah juga golongan gas mulia seperti xenon dan radon juga tak dapat mengelak dari fluorinasi. Nikel containers are usually used due to that metal's great resistance to attack by chlorine trifluoride, stemming from the formation of an unreactive nickel fluoride layer. Its reaction with hidrazin to form hydrogen fluoride, nitrogen, and chlorine gases was used in experimental rocket motors, but has problems largely stemming from its extreme hypergolicity resulting in ignition without any measurable delay. For these reasons, it was used in bomb attacks during the Perang Dunia Kedua by the Nazis. Sekarang, senyawa ini banyak digunakan dalam pemrosesan bahan bakar nuklir, untuk mengoksidasi uranium menjadi uranium heksafluorida untuk pengayaannya dan pemisahan dari plutonium. Senyawa ini dapat berperan sebagai donor atau akseptor ion fluor (asam atau basa Lewis), meskipun tak terdisosiasi merata menjadi ion ClF+2 dan ClF−4 .[43] Klorin pentafluorida (ClF5) dibuat dalam skala besar dengan fluorinasi klorin dengan gas fluorin pada suhu 350 °C dan 250 atm. Untuk skala kecil dapat diperoleh dengan mereaksikan logam klorida dengan gas klorin pada suhu 100–300 °C. Senyawa ini melebur pada −103 °C dan mendidih pada −13.1 °C. Merupakan fluonator yang sangat kuat, meski tidak seefektif klorin trifluorida. Hanya beberapa reaksi stoikiometrik yang telah dikarakterisasi. Arsenik pentafluorida dan antimoni pentafluorida form ionic adducts of the form [ClF4]+[MF6]− (M = As, Sb) and water reacts vigorously as follows:[44]
The product, kloril fluorida, is one of the five known chlorine oxide fluorides. These range from the thermally unstable FClO to the chemically unreactive perkloril fluorida (FClO3), the other three being FClO2, F3ClO, and F3ClO2. All five behave similarly to the chlorine fluorides, both structurally and chemically, and may act as Lewis acids or bases by gaining or losing fluoride ions respectively or as very strong oxidising and fluorinating agents.[45] Produksi dan keberadaan Klorin sangat reaktif dalam bentuk elemen bebas di alam namun jumlahnya sangat melimpah dalam bentuk garam klorida. Unsur ini merupakan elemen paling melimpah ke-20 di kerak bumi dan jumlahnya mencapai 126 bagian per juta. Jumlahnya paling besar dalam bentuk natrium klorida di laut. Di beberapa tempat, ada sejumlah natrium klorida dengan konsentrasi lebih tinggi, seperti Danau Garam Besar di Utah dan Laut Mati di Israel.[46] Sejumlah kecil gas klorin didapatkan di laboratorium dengan mencapur asam hidroklorat dan mangan dioksida, namun hal ini jarang dilakukan karena ketersediaannya melimpah. Di industri, klorin diproduksi dengan elektrolisis natrium klorida yang terlarut dalam air. Proses ini, dikenal dengan proses kloroalkali, muncul tahun 1892 dan saat ini menjadi metode proses produksi gas klorin terbesar.[23] Bersama dengan klorin, metode ini menghasilkan gas hidrogen dan Natrium hidroksida. Prosesnya berjalan melalui persamaan reaksi berikut ini:[47]
Elektrolisis larutan klorida berjalan menurut persamaan berikut:
Pada proses Deacon, asam klorida yang didapat dari produksi senyawa organoklorin diproses lagi menjadi klorin. Proses ini mengandalkan oksidasi menggunakan oksigen:
Reaksi ini membutuhkan katalis. Seperti digunakan oleh Deacon, katalis-katalis awal berbasis dari tembaga. Proses komersial, seperti proses Mitsui MT-Klorin, berganti menggunakan katalis berbasis krom dan rutenium.[48] Klorin yang dihasilkan tersedia dalam bentuk silinder dengan ukuran bervariasi mulai dari 450 gram hingga 70 kg, drum (865 kg), mobil tangki (15 ton dengan truk; 27–90 ton dengan kereta), dan tongkang (600–1200 ton).[49] AplikasiNatrium klorida adalah senyawa klorin yang paling umum, dan merupakan sumber utama untuk bahan baku klorin dan asam hidroklorat yang diproduksi di industri kimia saat ini. Ada sekitar 15.000 senyawa mengandung klorin yang diperdagangkan secara komersial, diantaranya metana dan etana terklorinasi, vinil klorida dan polimernya polivinil klorida (PVC), aluminium triklorida untuk katalisis, klorida magnesium, titanium, zirkonium, dan hafnium yang digunakan sebagai prekursor untuk produksi elemen murni.[9] Secara kuantitatif, dari semua klorin yang diproduksi, sekitar 63% digunakan untuk produksi senyawa organik, dan 18% untuk produksi senyawa klorin anorganik.[50] Sisanya 19% digunakan sebagai produk pemutih dan desinfektan.[49] Produk senyawa organik yang paling umum dalam hal volume produksi adalah 1,2-dikloroetana dan vinil klorida, intermediet dalam produksi PVC. Senyawa organoklorida penting lainnya adalah metil klorida, metilena klorida, kloroform, vinilidena klorida, trikloroetilena, perkloroetilena, alil klorida, epiklorohidrin, klorobenzena, diklorobenzena, dan triklorobenzena. Senyawa anorganik yang utama diantaranya HCl, Cl2O, HOCl, NaClO3, isosianurat terklorinasi, AlCl3, SiCl4, SnCl4, PCl3, PCl5, POCl3, AsCl3, SbCl3, SbCl5, BiCl3, S2Cl2, SCl2, SOCI2, ClF3, ICl, ICl3, TiCl3, TiCl4, MoCl5, FeCl3, dan ZnCl2.[49] Sanitasi, desinfektan, dan antiseptikMelawan pembusukan Di Prancis, usus binatang diproses untuk membuat senar instrumen musik, kulit Goldbeater, dan produk lainnya. Proses ini dilakukan di "pabrik usus" (boyauderies), dan prosesnya berbau dan tidak sehat. Sekitar tahun 1820, Société d'encouragement pour l'industrie nationale mengadakan sayembara untuk penemuan sebuah metode, entah kimia atau mekanis, untuk memisahkan membran peritoneum dari usus binatang tanpa pembusukan.[51][52] Hadiah ini dimenangkan oleh kimiawan dan apoteker Prancis Antoine-Germain Labarraque, yang menemukan cairan pencuci klorin Berthollet ("Eau de Javel"). Cairan ini tidak hanya menghilangkan bau pembusukan dekomposisi jaringan hewan, namun juga melambatkan dekomposisinya sendiri.[52][53] Penelitian Labarraque menghasilkan penggunaan klorida dan hipoklorit dari kapur (kalsium hipoklorit) dan natrium (natrium hipoklorit) di boyauderies. Senyawa kimia yang sama ternyata juga berguna untuk desinfektan dan deodorisasi jamban, selokan, pasar, rumah jagal, laboratorium anatomi, dan kamar mayat.[54] Maka dengan cepat senyawa ini digunakan di rumah sakit, penjara, kandang kuda, dan lazaretto. Senyawa ini sangat penting dalam proses penguburan,[55] pembalseman, mewabahnya suatu penyakit, demam, dan infeksi pada ternak.[51] BahayaKlorin adalah gas beracun yang menyerang sistem pernapasan, mata, dan kulit.[56] Karena kerapatannya lebih tinggi dari udara, gas ini cenderung akan terakumulasi pada dasar ruangan dengan ventilasi yang buruk. Gas klorin adalah oksidator kuat yang dapat bereaksi dengan zat yang mudah terbakar.[57][58] Klorin dapat terdeteksi dengan alat ukur dengan konsentrasi mulai 0.2 bagian per juta (ppm), dan akan tercium mulai. Batuk dan muntah dapat muncul pada kadar 30 ppm dan kerusakan paru-paru pada kadar 60 ppm. Pada kadar 1000 ppm akan sangat fatal setelah terhirup beberapa kali.[9] Kadar konsentasi IDLH (immediately dangerous to life and health) adalah 10 ppm.[59] Menghirup gas ini pada konsentrasi rendah dapat mengganggu sistem pernapasan dan paparan gas ini dapat menyebabkan iritasi mata.[60] Sifat beracun klorin ini muncul dari kemampuan oksidasinya. Ketika klorin terhirup pada konsentrasi diatas 30 ppm, maka senyawa ini akan bereaksi dengan air dan cairan sel menghasilkan asam klorida (HCl) dan asam hipoklorat (HClO). Ketika digunakan sebagai desinfektan pada level tertentu, reaksi klorin dengan air tidak berbahaya bagi kesehatan manusia. Material lain yang ada dalam air dapat saja menghasilkan produk samping desinfektan yang dapat berakibat negatif pada kesehatan manusia.[61][62] Di Amerika Serikat, Occupational Safety and Health Administration (OSHA) telah mengatur batas paparan yang diperbolehkan untuk klorin sekitar 1 ppm, atau 3 mg/m3. National Institute for Occupational Safety and Health menetapkan batas paparan yang direkomendasikan sekitar 0.5 ppm maksimum 15 menit.[59] Di rumah, beberapa kali terjadi kasus dimana cairan hipoklorit terkontak dengan pembersih saluran pembuangan yang bersifat asam, dan menghasilkan gas klorin.[63] Cairan hipoklorit (merupakan aditif binatu yang populer) dicampur dengan amoniak akan menghasilkan kloroamina, grup senyawa kimia lain yang beracun.[64] Referensi
Catatan
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


