|
Proses Klor-alkaliProses kloralkali (juga klor-alkali dan klor alkali ) adalah proses industri untuk elektrolisis larutan natrium klorida (NaCl). Ini adalah teknologi yang digunakan untuk memproduksi klorin dan natrium hidroksida (soda kaustik), yang merupakan bahan kimia komoditas yang dibutuhkan oleh industri. Tiga puluh lima juta ton klorin dibuat melalui proses ini pada tahun 1987. Klorin dan natrium hidroksida yang dihasilkan dalam proses ini banyak digunakan dalam industri kimia.[1][2][3][4][5][6] Biasanya proses ini dilakukan pada air garam (larutan NaCl), yang menghasilkan natrium hidroksida (NaOH), hidrogen, dan klor. Saat menggunakan kalsium klorida atau kalium klorida, produknya mengandung kalsium atau kalium, bukan natrium. Proses terkait diketahui menggunakan NaCl cair untuk menghasilkan klorin dan logam natrium atau hidrogen klorida terkondensasi untuk menghasilkan hidrogen dan klorin. Proses tersebut memerlukan konsumsi energi yang tinggi, misalnya sekitar 2.500 kWh (9.000 MJ) listrik per ton natrium hidroksida yang dihasilkan. Karena proses ini menghasilkan klorin dan natrium hidroksida dalam jumlah yang setara (dua mol natrium hidroksida per mol klorin), maka perlu dicari kegunaan produk-produk ini dalam proporsi yang sama. Untuk setiap mol klorin yang dihasilkan, dihasilkan satu mol hidrogen. Sebagian besar hidrogen ini digunakan untuk menghasilkan asam klorida , amonia , hidrogen peroksida , atau dibakar untuk produksi listrik dan/atau uap. SejarahProses kloralkali telah digunakan sejak abad ke-19 dan merupakan industri utama di Amerika Serikat, Eropa Barat, dan Jepang. Ini telah menjadi sumber utama klorin selama abad ke-20. Proses sel diafragma dan proses sel merkuri telah digunakan selama lebih dari 100 tahun namun tidak ramah lingkungan karena masing-masing menggunakan asbes dan merkuri. Proses sel membran, yang baru dikembangkan dalam 60 tahun terakhir, merupakan metode unggul dengan peningkatan efisiensi energi dan kurangnya bahan kimia berbahaya. Proses kloralkali yang paling umum melibatkan elektrolisis larutan natrium klorida (air garam) dalam sel membran. Membran, seperti yang terbuat dari Nafion, Flemion atau Aciplex, digunakan untuk mencegah reaksi antara ion klorin dan hidroksida. 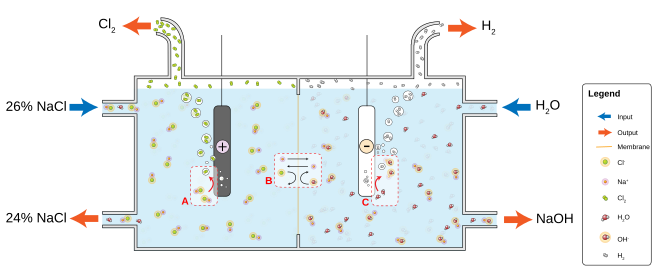 Meskipun pembentukan klorin pertama kali melalui elektrolisis air garam dilakukan oleh ahli kimia William Cruikshank pada tahun 1800, 90 tahun kemudian metode elektrolitik berhasil digunakan dalam skala komersial. Produksi skala industri dimulai pada tahun 1892. Pada tahun 1833, Faraday merumuskan hukum yang mengatur elektrolisis larutan air, dan paten diberikan kepada Cook dan Watt pada tahun 1851 dan kepada Stanley pada tahun 1853 untuk produksi elektrolitik klorin dari air garam. Sistem prosesTiga metode produksi sedang digunakan. Meskipun metode sel merkuri menghasilkan natrium hidroksida bebas klorin, penggunaan beberapa ton merkuri menyebabkan masalah lingkungan yang serius. Dalam siklus produksi normal, beberapa ratus pon merkuri per tahun dilepaskan dan terakumulasi di lingkungan. Selain itu, klorin dan natrium hidroksida yang dihasilkan melalui proses kloralkali sel merkuri juga terkontaminasi dengan sejumlah kecil merkuri. Metode membran dan diafragma tidak menggunakan merkuri, tetapi natrium hidroksida mengandung klorin, yang harus dihilangkan. Lihat pulaReferensi
|