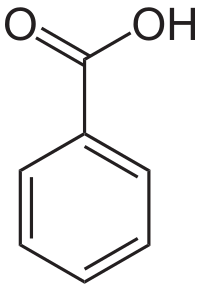
Βενζοϊκό οξύ
Γενικά
Όνομα IUPAC Βενζοϊκό οξύ
Άλλες ονομασίες Βενζενοκαρβονικό οξύ
Χημικά αναγνωριστικά
Χημικός τύπος C7 H6 O2
Μοριακή μάζα 122,12 amu
Σύντομος C6 H5 COOH
Συντομογραφίες PhCOOH
Αριθμός CAS 65-85-0
SMILES O=C(O)c1ccccc1
InChI 1S/C7H6O2/c8-7(9)6-4-2-1-3-5-6/h1-5H,(H,8,9)
Αριθμός EINECS 200-618-2
Αριθμός RTECS DG0875000
Αριθμός UN 8SKN0B0MIM
PubChem CID 243
ChemSpider ID 238
Κωδικός προσθέτου E210
Δομή
Διπολική ροπή 1,72 D
Μοριακή γεωμετρία επίπεδη
Ισομέρεια
Φυσικές ιδιότητες
Σημείο τήξης 122,35 °C
Σημείο βρασμού 249 °C
Πυκνότητα 1.320 kg/m3
Διαλυτότητα στο νερό 3,4 kg/m3
Δείκτης διάθλασης D 1,5397
Εμφάνιση Άχρωμο κρυσταλλικό στερεό
Χημικές ιδιότητες
pKa 4,21
Ελάχιστη θερμοκρασία 121 °C
Σημείο αυτανάφλεξης 570 °C
Επικινδυνότητα
Κίνδυνοι κατάNFPA 704
Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa).
Το βενζοϊκό οξύ[ 1] (αγγλικά Benzoic acid ) είναι αρωματική οργανική χημική ένωση , που περιέχει άνθρακα , υδρογόνο και οξυγόνο , με μοριακό τύπο C7 H6 O2 Ph COOHκαρβοξυλικό οξύ . Το χημικά καθαρό βενζοϊκό οξύ, στις κανονικές συνθήκες περιβάλλοντος , δηλαδή σε δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm , είναι άχρωμο κρυσταλλικό οξύ . Το όνομά του προήλθε από το «gum benzoin »[ 2] αιώνες . Αλλά, το βενζοϊκό οξύ βρίσκεται με φυσικό τρόπο και σε πολλά άλλα φυτά ,[ 3] βιοσύνθεση πολλών δευτερευόντων μεταβολιτών .
Είναι γνωστά πολλά βενζοϊκά άλατα, βενζοϊκοί εστέρες , καθώς και διάφορα άλλα βενζοϊκά «θυγατρικά» παράγωγα, του «μητρικού βενζοϊκού οξέος». Τόσο, η «μητρική» ένωση, όσο και πολλά από τα άμεσα παράγωγά της είναι άμεσα χρήσιμα βιομηχανικά προϊόντα, όπως συντηριτικά τροφίμων ή και σημαντικές πρόδρομες ενώσεις άλλων χρήσιμων οργανικών ενώσεων.
Το βενζοϊκό οξύ ανακαλύφθηκε το 16ο αιώνα . Η ξηρή απόσταξη του «gum benzoin » πρωτοπεριγράφηκε από το Νοστράδαμο (1556 ), τον Αλέξιο Πεντεμοντάνους (Alexius Pedemontanus , 1560 ) και το Μπλαισέ ντε Βιγκενέρ (Blaise de Vigenère , 1596 )[ 4]
Μετά από κάποιες πρωτοπόρες εργασίες το 1830 , διαμέσου μιας ποικιλίας πειραμάτων που βασίστηκαν στην αμυγδαλίνη , που λαμβάνεται από τα πικραμύγδαλα (δηλαδή τον καρπό του Prunus dulcis ) , από τους Πιερ Ρομπικέτ (Pierre Robiquet ) και Αντουάν Μπουτρόν-Χαρλάρντ (Antoine Boutron-Charlard ), δυο Γάλλους χημικούς , παράχθηκε βενζαλδεΰδη [ 5] βενζοϊκής ρίζας (PhCOO·). Αυτό το βήμα πραγματοποιήθηκε αργότερα, από τους Γιούστους φον Λήμπιχ (Justus von Liebig ) και Φρήντριχ Βέλερ (Friedrich Wöhler ), που καθόρισαν τη δομή του βενζοϊκού οξέος το 1832 [ 6] ιππουρικό οξύ (PhCONHCH2 COOH) σχετίζεται με το βενζοϊκό οξύ.
Το 1875 ο Σαλκόβσκι (Salkowski ) ανακάλυψε τις αντισηπτικές ιδιότητες του βενζοϊκού οξέος, που ήδη για πολύ καιρό χρησιμοποιούνταν ως συντηρητικό[ 7]
Επίσης, το βενζοϊκό οξύ είναι μια από τις χημικές ενώσεις που βρίσκονται στο καστορέλαιο , το οποίο είναι ένα υγρό μείγμα που συλλέγεται από τους καστορικούς σάκους.
Κρύσταλλοι βενζοϊκού οξέος
Το βενζοϊκό οξύ παράγεται βιομηχανικά με καταλυτική μερική οξείδωση τολουολίου από ατμοφαιρικό οξυγόνο . Η αντίδραση αυτή καταλύεται από ναφθαλινικό κοβάλτιο ή ναφθαλινικό μαγγάνιο . Η διεργασία αυτή χρησιμοποιεί φθηνές πρόδρομες ύλες και παρουσιάζει υψηλή απόδοση .
P
h
C
H
3
+
2
O
2
→
C
o
η
´
M
n
P
h
C
O
O
H
+
H
2
O
{\displaystyle \mathrm {PhCH_{3}+2O_{2}{\xrightarrow {Co\ {\acute {\eta }}\ Mn}}PhCOOH+H_{2}O} }
1. Με οξείδωση τολουολίου με υπερμαγγανικό κάλιο (KMnO4 )[ 9]
3
P
h
C
H
3
+
2
K
M
n
O
4
+
H
2
S
O
4
→
3
P
h
C
O
O
H
+
2
M
n
O
2
+
K
2
S
O
4
+
4
H
2
O
{\displaystyle \mathrm {3PhCH_{3}+2KMnO_{4}+H_{2}SO_{4}{\xrightarrow {}}3PhCOOH+2MnO_{2}+K_{2}SO_{4}+4H_{2}O} }
2. Με οξείδωση 1,2-διφαινυλοαιθένιου με υπερμαγγανικό κάλιο[ 10]
3
P
h
C
H
=
C
H
P
h
+
8
K
M
n
O
4
+
4
H
2
S
O
4
→
6
P
h
C
O
O
H
+
8
M
n
O
2
+
4
K
2
S
O
4
+
4
H
2
O
{\displaystyle \mathrm {3PhCH=CHPh+8KMnO_{4}+4H_{2}SO_{4}{\xrightarrow {}}6PhCOOH+8MnO_{2}+4K_{2}SO_{4}+4H_{2}O} }
3. Με οξείδωση βενζυλικής αλκοόλης [ 11]
3
P
h
C
H
2
O
H
+
4
K
M
n
O
4
+
2
H
2
S
O
4
→
3
P
h
C
O
O
H
+
4
M
n
O
2
+
2
K
2
S
O
4
+
5
H
2
O
{\displaystyle \mathrm {3PhCH_{2}OH+4KMnO_{4}+2H_{2}SO_{4}{\xrightarrow {}}3PhCOOH+4MnO_{2}+2K_{2}SO_{4}+5H_{2}O} }
4. Με οξείδωση βενζαλδεΰδης [ 12]
3
P
h
C
H
O
+
K
2
C
r
2
O
7
+
H
2
S
O
4
→
3
P
h
C
O
O
H
+
C
r
2
O
3
+
K
2
S
O
4
+
3
H
2
O
{\displaystyle \mathrm {3PhCHO+K_{2}Cr_{2}O_{7}+H_{2}SO_{4}{\xrightarrow {}}3PhCOOH+Cr_{2}O_{3}+K_{2}SO_{4}+3H_{2}O} }
5. Με οξειδοαναγωγή βενζαλδεΰδης , μέθοδος Cannizzaro [ 13]
2
P
h
C
H
O
+
K
O
H
→
−
P
h
C
H
2
O
H
+
P
h
C
O
O
K
→
+
H
C
l
P
h
C
O
O
H
+
K
C
l
{\displaystyle \mathrm {2PhCHO+KOH{\xrightarrow {-PhCH_{2}OH}}+PhCOOK{\xrightarrow {+HCl}}PhCOOH+KCl} }
6. Από φαινυλοαλογονίδιο
α. Με αντίδραση Fittig :
P
h
X
+
2
N
a
→
−
N
a
X
P
h
N
a
→
+
X
C
O
O
H
P
h
C
O
O
H
+
N
a
X
{\displaystyle \mathrm {PhX+2Na{\xrightarrow {-NaX}}PhNa{\xrightarrow {+XCOOH}}PhCOOH+NaX} }
β. Μέσω ενώσεων Grignard [ 14]
P
h
X
+
M
g
→
|
E
t
2
O
|
P
h
M
g
X
→
+
C
O
2
P
h
C
O
O
M
g
X
→
+
H
2
O
P
h
C
O
O
H
+
M
g
(
O
H
)
X
{\displaystyle \mathrm {PhX+Mg{\xrightarrow {|Et_{2}O|}}PhMgX{\xrightarrow {+CO_{2}}}PhCOOMgX{\xrightarrow {+H_{2}O}}PhCOOH+Mg(OH)X} }
7. Από βενζονιτρίλιο με υδρόλυση [ 15]
P
h
C
N
+
H
2
O
→
P
h
C
O
N
H
2
→
+
H
2
O
P
h
C
O
O
N
H
4
→
+
H
C
l
P
h
C
O
O
H
+
N
H
4
C
l
{\displaystyle \mathrm {PhCN+H_{2}O{\xrightarrow {}}PhCONH_{2}{\xrightarrow {+H_{2}O}}PhCOONH_{4}{\xrightarrow {+HCl}}PhCOOH+NH_{4}Cl} }
8. Από βενζόλιο και φωσγένιο με αντίδραση Friedel-Crafts [ 16]
P
h
H
+
C
O
C
l
2
→
A
l
X
3
P
h
C
O
C
l
→
H
+
+
H
2
O
P
h
C
O
O
H
+
H
C
l
{\displaystyle \mathrm {PhH+COCl_{2}{\xrightarrow {AlX_{3}}}PhCOCl{\xrightarrow[{H^{+}}]{+H_{2}O}}PhCOOH+HCl} }
1. Έχει όξινο χαρακτήρα και άρα σχηματίζει άλατα . Π.χ.[ 17]
P
h
C
O
O
H
+
N
a
O
H
→
P
h
C
O
O
N
a
+
H
2
O
{\displaystyle \mathrm {PhCOOH+NaOH{\xrightarrow {}}PhCOONa+H_{2}O} }
2. Αποκαρβοξυλίωση (αποτελεσματικότερη στα άλατά του)[ 18]
α. Θερμική προς βενζόλιο :
P
h
C
O
O
H
→
△
P
h
H
+
C
O
2
{\displaystyle PhCOOH{\xrightarrow {\triangle }}PhH+CO_{2}}
β. Ηλεκτρολυτική (μέθοδος Kolbe) προς διφαινύλιο [ 19]
2
P
h
C
O
O
H
→
η
λ
ϵ
κ
τ
ρ
o
´
λ
υ
σ
η
P
h
2
+
2
C
O
2
+
H
2
{\displaystyle 2PhCOOH{\xrightarrow {\eta \lambda \epsilon \kappa \tau \rho {\acute {o}}\lambda \upsilon \sigma \eta }}Ph_{2}+2CO_{2}+H_{2}}
γ. Με θέρμανση αλάτων του με ασβέστιο (ή βάριο ) παράγεται βενζοφαινόνη [ 20]
(
P
h
C
O
O
)
2
C
a
→
△
P
h
C
O
P
h
+
C
a
C
O
3
↓
{\displaystyle \mathrm {(PhCOO)_{2}Ca{\xrightarrow {\triangle }}PhCOPh+CaCO_{3}\downarrow } }
δ. Με επίδραση βρωμίου σε βενζοϊκό άργυρο παράγεται φαινυλοβρωμίδιο - Αντίδραση Hunsdiecker [ 21]
P
h
C
O
O
A
g
+
B
r
2
→
P
h
B
r
+
A
g
B
r
↓
+
C
O
2
↑
{\displaystyle \mathrm {PhCOOAg+Br_{2}{\xrightarrow {}}PhBr+AgBr\downarrow +CO_{2}\uparrow } }
3. Αναγωγή προς βενζυλική αλκοόλη [ 22]
2
P
h
C
O
O
H
+
L
i
A
l
H
4
→
2
P
h
C
H
2
O
H
+
L
i
A
l
O
2
{\displaystyle \mathrm {2PhCOOH+LiAlH_{4}{\xrightarrow {}}2PhCH_{2}OH+LiAlO_{2}} }
4. Εστεροποίηση προς βενζοϊκό αλκυλεστέρα[ 23]
P
h
C
O
O
H
+
R
O
H
⟵
→
P
h
C
O
O
R
=
H
2
O
{\displaystyle \mathrm {PhCOOH+ROH{\overrightarrow {\longleftarrow }}PhCOOR=H_{2}O} }
5. Με χλωριωτικά μέσα προς βενζοϋλοχλωρίδιο [ 24]
α. Με SOCl2 :
P
h
C
O
O
H
+
S
O
C
l
2
→
P
h
C
O
C
l
+
S
O
2
+
H
C
l
{\displaystyle \mathrm {PhCOOH+SOCl_{2}{\xrightarrow {}}PhCOCl+SO_{2}+HCl} }
β. Με PCl5 :
P
h
C
O
O
H
+
P
C
l
5
→
P
h
C
O
C
l
+
P
O
C
l
3
+
H
C
l
{\displaystyle \mathrm {PhCOOH+PCl_{5}{\xrightarrow {}}PhCOCl+POCl_{3}+HCl} }
γ. Με PCl3 :
3
P
h
C
O
O
H
+
P
C
l
3
→
3
P
h
C
O
C
l
+
H
3
P
O
3
{\displaystyle \mathrm {3PhCOOH+PCl_{3}{\xrightarrow {}}3PhCOCl+H_{3}PO_{3}} }
Η παρουσία του καρβοξυλίου απενεργοποιεί σημαντικά τον βενζολικό δακτύλιο στο βενζοϊκό οξύ. Άρα οι αντίστοιχες αντιδράσεις γίνονται αρκετά πιο αργά απ' ό,τι στο βενζόλιο και παράγονται κυρίως μ-διπαράγωγα του βενζολίου[ 25] 1. Με νίτρωση παράγει μ-νιτροβενζοϊκό οξύ :
P
h
C
O
O
H
+
H
N
O
3
→
π
.
H
2
S
O
4
μ
−
O
2
N
C
6
H
4
C
O
O
H
+
H
2
O
{\displaystyle \mathrm {PhCOOH+HNO_{3}{\xrightarrow {\pi .H_{2}SO_{4}}}\mu -O_{2}NC_{6}H_{4}COOH+H_{2}O} }
2. Με σουλφούρωση παράγει μ-σουλφοξυβενζοϊκό οξύ :
P
h
C
O
O
H
+
H
2
S
O
4
→
μ
−
H
S
O
3
C
6
H
4
C
O
O
H
+
H
2
O
{\displaystyle \mathrm {PhCOOH+H_{2}SO_{4}{\xrightarrow {}}\mu -HSO_{3}C_{6}H_{4}COOH+H_{2}O} }
3. Με αλογόνωση παράγει μ-αλοβενζοϊκό οξύ:
P
h
C
O
O
H
+
X
2
→
A
l
X
3
μ
−
X
C
6
H
4
C
O
O
H
+
H
2
O
{\displaystyle \mathrm {PhCOOH+X_{2}{\xrightarrow {AlX_{3}}}\mu -XC_{6}H_{4}COOH+H_{2}O} }
όπου Χ Cl ή Br . Τα άλλα αλοβενζοϊκά οξέα προκύπτουν σε δεύτερη φάση με υποκατάσταση αυτών με χρήση HI ή Hg2 F2 , αντίστοιχα.
Ειδικά για το βρώμιο καλύτερος καταλύτης είναι ο FeBr2 . 4. Αλκυλίωση κατά Friedel-Crafts:
P
h
C
O
O
H
+
R
X
→
A
l
X
3
μ
−
R
C
6
H
4
C
O
O
H
+
R
X
{\displaystyle \mathrm {PhCOOH+RX{\xrightarrow {AlX_{3}}}\mu -RC_{6}H_{4}COOH+RX} }
5. Ακυλίωση κατά Friedel-Crafts:
P
h
C
O
O
H
+
R
C
O
X
→
A
l
X
3
μ
−
R
C
6
H
4
C
O
O
H
+
H
X
{\displaystyle \mathrm {PhCOOH+RCOX{\xrightarrow {AlX_{3}}}\mu -RC_{6}H_{4}COOH+HX} }
6. Αναγωγή προς κυκλοεξυλομεθανικό οξύ :
P
h
C
O
O
H
+
3
H
2
→
P
t
C
6
H
11
C
O
O
H
{\displaystyle \mathrm {PhCOOH+3H_{2}{\xrightarrow {Pt}}C_{6}H_{11}COOH} }
P
h
C
O
O
H
+
C
H
2
N
2
→
h
v
N
2
+
5
12
C
H
3
C
6
H
4
C
O
O
H
+
1
2
C
7
H
7
C
O
O
H
+
1
12
P
h
C
O
O
C
H
3
{\displaystyle \mathrm {PhCOOH+CH_{2}N_{2}{\xrightarrow {hv}}N_{2}+{\frac {5}{12}}CH_{3}C_{6}H_{4}COOH+{\frac {1}{2}}C_{7}H_{7}COOH+{\frac {1}{12}}PhCOOCH_{3}} }
Αυτό το μέτρια ασθενές οξύ και τα άλατά του (κυρίως το βενζοϊκό νάτριο ) χρησιμοποιούνται κυρίως ως συντηρητικά τροφίμων (Ε210-Ε213). Επιπλέον αποτελεί μια σημαντική ενδιάμεση ένωση για τη σύνθεση και την παραγωγή πολλών άλλων οργανικών ενώσεων, που χρησιμεύουν ως αρωματικά πρόσθετα τροφίμων, φάρμακα κ.ά..
↑ Δείτε τις εναλλακτικές ονομασίες στον παρακείμενο πίνακα πληροφοριών χημικής ένωσης.
↑ Δείτε το βενζόλιο για περισσότερες σχετικές λεπτομέρειες
↑ «Scientists uncover last steps for benzoic acid creation in plants» . Purdue Agriculture News. Αρχειοθετήθηκε από το πρωτότυπο στις 25 Ιανουαρίου 2021. Ανακτήθηκε στις 16 Ιουλίου 2017 . ↑ Neumüller O-A (1988). Römpps Chemie-Lexikon (6 έκδοση). Stuttgart: Frankh'sche Verlagshandlung. ISBN 3-440-04516-1 . OCLC 50969944 . ↑ Nouvelles expériences sur les amandes amères et sur l'huile volatile qu'elles fournissent Robiquet, Boutron-Charlard, Annales de chimie et de physique, 44 (1830), 352–382,↑ Liebig J , Wöhler F (1832). «Untersuchungen über das Radikal der Benzoesäure». Annalen der Chemie 3 : 249–282. doi :10.1002/jlac.18320030302 ↑ Salkowski E (1875). Berl Klin Wochenschr 12 : 297–298. ↑ D. D. Perrin; W. L. F. Armarego (1988). Purification of Laboratory Chemicals (3rd έκδοση). Pergamon Press. σελ. 94. ISBN 0-08-034715-0 . ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 411, §19.2Γ.1.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.200, §8.4.6α.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.1,2.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.4.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 411, §19.2Γ2.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 304, §13.7.1↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 411, §19.2Γ3.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 285, §12.4.2.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3α.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3β.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3γ.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3δ.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.4.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8α.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8β.
↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: σελ.355, §16.1.1, σελ.357, §16.1.3Β, σελ.360, §16.5.1.
Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία , Αθήνα 1972
Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
Αλκανικά οξέα Αλκενικά οξέα Αλκινικά οξέα Αλκαδιενικά οξέα Αλκανοδιικά οξέα Αλκενοδιικά οξέα Αρωματικά οξέα Αλαλκανικά οξέα Διαλαλκανικά οξέα Τριαλαλκανικά οξέα Αλαλκενικά οξέα Υδροξυοξέα Αλδεϋδοξέα και κετοξέα Υδροθειοξέα Νιτροαλκανικά οξέα













![{\displaystyle \mathrm {PhH+COCl_{2}{\xrightarrow {AlX_{3}}}PhCOCl{\xrightarrow[{H^{+}}]{+H_{2}O}}PhCOOH+HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0857a53034e81799197b4ada59453787d61bd755)

















