|
Maladie de CastlemanMaladie de Castleman
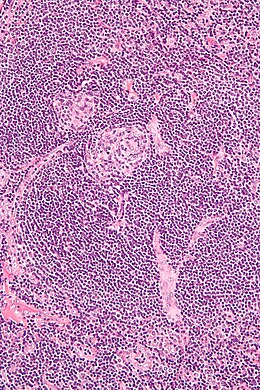
La maladie de Castleman (ou tumeur de Castleman, aussi dénommée hyperplasie géante ou angiofolliculaire ganglionnaire, hamartome lymphovasculaire, ou hyperplasie angio-folliculaire des ganglions lymphatiques) regroupe plusieurs troubles lymphoprolifératifs des ganglions lymphatiques qui partagent certaines caractéristiques histologiques communes. Elle atteint au total plus de 5 000 nouveaux patients par an aux États-Unis. Cette maladie peut être localisée à une unique aire lymphatique (forme « unicentrique ») ou en toucher plusieurs (formes « multicentriques ») avec alors des effets plus systémiques et dangereux. Un sous-type se développe souvent chez des patients infectés par le virus de l'herpès humain HHV8[1] et peut être associé à la maladie de Kaposi. La maladie de Castleman fait l'objet d'intenses recherches, et depuis peu, d'un processus de recherche collaborative impliquant des médecins, chercheurs et patients : le Castleman Disease Collaborative Network (CDCN)[1]. HistoireLe nom de cette maladie se réfère à Benjamin Castleman[1], le médecin de Boston qui fut le premier à décrire cette maladie, en 1954, à partir du cas d'un cadre de 40 ans qui souffrait de fièvres accompagnées d'une faiblesse inexpliquée, tout en présentant une masse inhabituelle dans la poitrine[1]. Les médecins ont d'abord soupçonné un cancer ou d'autres maladies mais, une fois la masse retirée chirurgicalement, elle s'est avérée être différente des tumeurs habituelles, présentant des caractéristiques qui la font depuis désigner comme « maladie de Castleman unicentrique », ou localisée[1],[2]. D'autres formes de la maladie ont été ensuite décrites, classées comme suit. TypologieDe multiples sous-types de la maladie de Castleman ont été décrits[3],[4]. Ces formes sont très différentes les unes des autres, au point d'être parfois considérées comme des pathologies distinctes. Tout d'abord, on distingue les maladies de Castleman « unicentrique », qui ne touchent qu'une seule aire lymphatique, des formes « multicentriques » qui en atteignent plusieurs. Forme unicentriqueSous sa forme monocentrique, il s'agit d'une tumeur bénigne de ganglion lymphatique qui siège toujours[source insuffisante] dans le médiastin[5], classiquement chez les sujets jeunes, avant la quatrième décennie, mais avec des exceptions. Son aspect à l'imagerie est celui d'une adénopathie unique. Cette forme est généralement asymptomatique et son pronostic est le plus souvent favorable[4]. Forme multicentriqueSous sa forme multicentrique, la maladie de Castleman correspond à une hyperactivation du système immunitaire, ce qui se traduit notamment par la libération excessive de protéines pro-inflammatoires (cytokines), la prolifération de cellules immunitaires (cellules B et les cellules T) associée à de multiples dysfonctionnements d'organes[6]. Dans ce cas-là, ses effets sont systémiques et le risque de complications sérieuses est plus important que dans la forme unicentrique. Les formes multicentriques sont divisées par les auteurs entre les formes associées au virus HHV-8 (herpèsvirus responsable de la maladie de Kaposi) et les formes idiopathiques, non associées à HHV-8. Parmi ces dernières, on retrouve les maladies de Castleman associées au syndrome POEMS et le syndrome « TAFRO » (sigle correspondant à l'association thrombocytopénie, anasarque, fièvre, fibrose, insuffisance rénale et organomégalie)[7]. Physiopathologie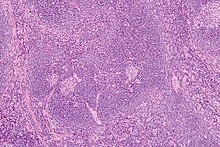 Bien que non considérée comme un cancer, cette prolifération de lymphocytes est assez similaire à un lymphome, et d'autres recherches sont nécessaires pour caractériser les petites populations de cellules néoplasiques[8]. Une hypothèse encore à l'étude est qu'il pourrait s'agir d'une sorte de « pré-lymphome » présentant aussi des caractéristiques auto-immunes, où des cellules dans les ganglions lymphatiques se mettent à proliférer et attaquer divers tissus[9]. Les médecins ont mis en évidence le rôle clé d'un messager du système immunitaire, l'interleukine-6 (IL-6) qui est, lors des phases d'expression de la maladie, sécrété en trop grande quantité par les ganglions lymphatiques, déclenchant une réaction inflammatoire massive et délétère soit localement, soit dans tout le corps si plusieurs zones ganglionnaires sont touchées. Mais on ne comprend pas encore l'origine de cette sécrétion anormale. D'une part un médicament supprimant la sécrétion d'IL-6 est dans certains cas inopérant[1], et d'autre part dans un certain nombre de cas la maladie semblerait pouvoir être reliée à un herpèsvirus humain de type 8 (HHV-8), mais ce virus n'est pas retrouvé chez tous les patients (jamais dans les formes monocentriques et dans la moitié des cas des formes multicentriques)[9]. Les patients victimes de la forme multicentrique idiopathique de la maladie ont aussi un risque accru de présenter une hémopathie maligne dans les 2 ans suivant leur diagnostic. Les raisons de cette association sont encore mal comprises[9]. Une hypothèse en cours d'étude est que la prolifération cellulaire dans ces ganglions ne serait pas la cause première de la maladie, mais l'une de ses conséquences[1]. ÉpidémiologieDes estimations récentes suggèrent que les différents sous-types de cette maladie sont moins rares qu'on ne l'a d'abord cru. Il y aurait environ 6 500 à 7 700 nouveaux cas par an rien qu'aux États-Unis et dans environ 1 cas sur 4, il s'agit de la forme multicentrique. Elle est par exemple plus fréquente aux États-Unis que la maladie de Charcot qui touche environ 5 600 nouvelles personnes chaque année[10]. La maladie peut survenir à tout âge (même chez de jeunes enfants) et toucher des hommes comme des femmes. La forme monocentrique apparaît plutôt chez les 20-30 ans et la forme multicentrique plus tardivement (plutôt chez les 40-60 ans)[9]. DiagnosticSymptômes et examen cliniqueLes patients peuvent être asymptomatiques[11] ou présenter de nombreux symptômes peu spécifiques[9] :
BiologieLes analyses biologiques de personnes atteintes présentent souvent des valeurs de laboratoire anormales pour les paramètres suivants :
Examens complémentairesCe diagnostic est complexe et nécessite un avis spécialisé en hématologie ou en médecine interne, si possible dans un centre de référence[4]. Il est confirmé par biopsie ganglionnaire pouvant être pratiquée par guidage radiologique ou exérèse chirurgicale[11]. (et par la même occasion le traitement définitif) L'histologie (biopsie ostéomédullaire) montre des lésions qui peuvent orienter le diagnostic, associant une hyperplasie lymphatique et vasculaire, une plasmocytose, des atypies sur les mégacaryocytes, une fibrose. Toutefois, ces constatations ne sont pas spécifiques[12] et les données histologiques ne permettent pas d'orienter le traitement médicamenteux[13]. La forme idiopathique est de diagnostic difficile et des critères ont été établis par un consensus international[14]. Diagnostic différentielLa maladie de Castleman doit être distinguée de troubles d'apparence identique (« Castelman-like ») caractéristiques d'atteintes des ganglions lymphatiques, y compris l'hyperplasie réactive des ganglions lymphatiques, des troubles auto-immuns ou certaines tumeurs malignes[15]. Prise en chargeRecommandationsEn France, un protocole national de diagnostic et de soin (PNDS) a été élaboré en 2019 pour la maladie de Castleman[4]. Au niveau international, des recommandations internationales sont parues en 2018 pour la forme idiopathique[16] et en 2020 pour la forme unicentrique[17]. Chirurgie et radiothérapieLa forme unicentrique peut bénéficier d'une chirurgie d'exérèse pour retirer le ganglion touché. Quand elle est possible, elle permet la guérison définitive dans la majorité des cas. La radiothérapie peut également être une alternative possible dans ces cas-là[4],[18]. MédicamentsLes traitements utilisés sont des anti-inflammatoires ou des immunosuppresseurs. Le siltuximab, un anticorps monoclonal dirigé contre l'interleukine 6 permet d'améliorer les symptômes de la forme multicentrique[19]. Le rituximab et le cyclophosphamide permettent une réponse dans un patient sur deux[20]. Les corticoïdes sont également utilisés[21]. PronosticLa forme monocentrique a un très bon pronostic et ne semble avoir aucun impact sur l'espérance de vie[4]. En revanche, les formes multicentriques ont un pronostic plus variable d'un cas à l'autre[4]. Certains sous-types étaient associés à une mortalité de 35 % des cas en 2016 malgré les progrès dans le traitement[9]. Recherche et perspectivesUn médecin lui-même victime de la maladie (qui a failli le tuer à 5 reprises) a abandonné son traitement classique (inhibiteur de l'interleukine 6) au profit d'un immunosuppresseur, traitement qui semble l'avoir protégé (depuis 2,5 ans mi-2016, délai qui n'est pas encore suffisant pour être considéré comme efficace, car des périodes de rémission existent chez les malades)[1]. La piste de facteurs génétiques est également explorée avec le séquençage du génome d'environ 10 patients atteint de la maladie de Castleman et de leurs parents, en comparant les éventuelles variations de niveaux de protéines exprimées lors des phases de poussées et des rémissions de la maladie. Une stratégie de travail collaboratif a été mise en place par un groupe de médecins, patients et donateurs (« Castleman Disease Collaborative Network » ou CDCN) pour accélérer la recherche sur cette maladie, avec la volonté de traiter les questions prioritaires suivantes (liste 2016)[9] :
En , le CDCN, l'UPenn, et une société pharmaceutique (encore anonyme) ont signé un accord pour mettre en place un « registre des patients » afin de mieux comprendre la maladie et l’efficacité relative de différents traitements. Notes et références
Voir aussiBibliographieArticles connexesLiens externes |