|
פלואוריד פלואוריד (באנגלית: Fluoride) הוא יון חד-אטומי של אטום הפלואור, כלומר אטום פלואור שנוסף לו אלקטרון אחד: -F. מטענו של היון הוא 1-. הייחודיות של יון הפלואור נובעת מהאלקטרושליליות הגבוהה שלו. בניגוד להלוגנים אחרים, HF הוא חומצה חלשה. חמצן דו-פלואורי למשל, מגיב עם מים ויוצר מימן פלואורי. תכונה ייחודית נוספת של יון הפלואור הוא יכולת ליצירת קשר קוולנטי עם ארגון, קסנון, או קריפטון למרות שהם גזים אצילים. רוב התרכובות הללו אינן יציבות ומשמשות ביצירת לייזר אקסיימר. קסנון דו-פלואורי, קסנון ארבע-פלואורי וקסנון שש-פלואורי הם תרכובות יציבות שיוצרות מבנים גבישיים. האלקטרושליליות הגדולה של הפלואור הופכת אותו ליון המתאים לשימוש ביצירת ממסים טובים ולרעלים. פלואוריד משמש גם ביצירת פולימרים וחומרים בעלי פעילות ביולוגית, ובכמה מדינות הוא מוסף למי השתייה על-מנת להגן מפני עששת השן. תכונותפלואור הוא הקל שבהלוגנים והוא אחד מהיסודות הכימיים הריאקטיביים ביותר. הוא אינו מופיע כפלואור בסביבה. הוא בעל האלקטרושליליות הגבוהה ביותר מבין כל היסודות ולכן נטייתו לרכוש מטען שלילי חזקה ובתמיסה הוא לרוב יופיע כיון -F. מצבי חמצון אחרים לא נתגלו במערכות הטבעיות, למרות שתרכובות חסרות מטען אפשריות. יוני הפלואוריד הם בעלי אותו מטען וכמעט אותו רדיוס כמו יוני הידרוקסיד ויכולים להחליף זה את זה במבנים מינרלים. כך יוצר הפלואוריד תרכובות כימיות עם כמה קטיונים ונפוצים למדי מספר מינרלים בעלי מסיסות נמוכה המכילים פלואוריד. מלח הפלואוריד cryolite משמש לייצור אלומיניום וכקוטל מזיקים. סלעי פוספט (rock phosphates) מומרים לדשני פוספט באמצעות הרחקה של עד 4.2 אחוזי פלואוריד; הפלואוריד המורחק ומטוהר (כפלואורוסיליקטים) הוא מקור פלואוריד המוסף במספר מדינות למי השתייה על-מנת להגן כנגד עששת השן. הימצאות בטבעהפלואוריד מרכיב כ-0.06–0.09 אחוזים מקרום כדור הארץ. הריכוז הממוצע בקרום הוא 300 מ"ג לק"ג. פלואורידים קיימים בריכוזים ניכרים במגוון רחב של מינרלים, בהם פלואוריט, פוספוריט, קריאוליט, אפטיט, נציץ, הורנבלנדה ואחרים. הפלואוריט, , הוא מינרל פלואוריד נפוץ בעל מסיסות נמוכה הקיים בסלעים געשיים ובסלעי משקע. הפלואוריד קשור, אופיינית, באפר געשי ובגזים חמים. גם מים תרמיים, במיוחד אלו בעלי pH גבוה, הם עשירים בפלואוריד. מינרלים להם חשיבות מסחרית כוללים קריאוליט ופוספוריט. 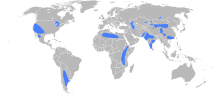 הפלואוריד נמצא בכל המים הטבעיים בריכוז מסוים. מי ים מכילים ריכוז אופייני של 1 מ"ג לליטר בזמן שבנהרות ובאגמים ערכי הריכוז קטנים מ-0.5 מ"ג לליטר. במי תהום עשויים להיות ריכוזים משתנים של פלואוריד. הרכבו של המסלע הסובב את מי התהום, הוא יהיה המשפיע העיקרי על ריכוזים אלה: ריכוזי הפלואוריד במים מוגבלים, מכיוון שמסיסותו של המקור העיקרי ליוני פלואוריד, פלואוריט , מוגבלת. לפיכך, בנוכחות 40 מ"ג סידן לליטר, יוגבל ריכוז הפלואוריד ל-3.1 מ"ג לליטר. רק במצב של חוסר סידן בתמיסה, יכולים ריכוזים גבוהים יותר להיות יציבים. ריכוזי פלואוריד גבוהים צפויים, אם כן, במי תהום מאקוויפרים עניי סידן ובאזורים בהם נפוצים מינרלים מכילי פלואוריד. ריכוזי פלואוריד עשויים להיות גבוהים, גם במי תהום בהם התרחש חילוף קטיוֹנִי של סידן בנתרן. מים שבהם ריכוזי פלואוריד גבוהים, נפוצים ברצועות גאוגרפיות נרחבות, שבהן מתקיים אחד משלושה גורמים:
שימוש ברפואת שינייםיון הפלואוריד משפר עמידות אמייל השן לעששת משום שהפלואוריד הופך חלק מההידרוקסילאפטיט שיוצר את האמייל לפלואוראפטיט שהוא בסיס חלש יותר ולכן נתקף פחות על ידי חומצה (כדוגמת חומצת חלב שנוצרת על ידי רובד חיידקי השן).
פלואוריד משמש מאז 1945 במדינות שונות להפלרת מי שתייה לצורך הגנה על השיניים מעששת. הפלואוריד הוא גם מרכיב ברוב משחות השיניים ד״ר מרקו כהן היה ממקדמי השימוש בפלואוריד בחיי היום-יום ובזכות מחקריו נעשה שימוש נרחב בפלואוריד. נוסף על כך, קיימים תוספי פלואוריד נוספים נפרדים ממי שתייה וממשחות השיניים, הניתנים לילדים ומבוגרים שנמצאים בסיכון גבוה לעששת שיניים ואינם מקבלים הגנה מספקת מפלואוריד במי שתייה או במשחות שיניים. תוספים אלו כוללים:
ראו גםקישורים חיצוניים
|

