|
Oxálsav
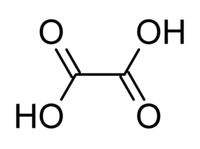
Oxálsav, más néven: sóskasav, etándisav. Két bázisú (azaz besorolása: dikarbonsav), széntartalmú organikus sav. A legegyszerűbb kétértékű karbonsav. Kémiai képlete: HOOC–COOH. Sói és észterei az oxalátok. Az oxálsav szó a görög okszálisz (ὀξαλίς = erdei sóska) szóból származik, latin közvetítéssel (oxalis).[4] TörténeteFrançois Pierre Savary (Fribourg, Svájc) fedezte fel 1773-ban. Az oxálsav volt az első szerves anyag, amit szervetlen anyagokból állítottak elő ezzel bizonyítva, hogy az élő szervezetre a szervetlen környezet is biokémiailag hatással van. A XIX. század második felétől elkezdődött a szerves és szervetlen kémia ötvözése. Megindult a szerves molekulák szervetlen anyagokból történő szintetizálása, amely a gyógyszeripar egyik alappillére lett a XXI. századra. TulajdonságaiFehér kristályos vegyület. Az oxálsav egyhajlású prizmákban kristályosodik, amelyek két molekula kristályvizet tartalmaznak (H2C2O4·2 H2O). Vízben és alkoholban könnyen oldódik (2 sr. kristályos oxálsav szobahőmérsékleten 9 sr. vízben feloldódik), oldata erősen savanyú ízű és savas kémhatású. Oxidáló anyagok (kálium-permanganát) igen könnyen szén-dioxiddá és vízzé oxidálják, ezért az oxálsav erélyes redukálószer. Az iparban a karton-, selyem- és gyapotfestészetben, a kémiai laboratóriumokban pedig normál (szabályos) oldatok készítésére és a különféle oxálsavsók előállítására használják. Nagyobb adagban a szervezetre mérgező hatású. Az oxálsav legegyszerűbben mészvízzel ismerhető fel, amellyel fehér, ecetsavban oldhatatlan csapadékot ad. Mennyiségi meghatározása leginkább kálium-permanganát oldattal történik titrálás útján. Analitikai kémiában az egyik legelterjedtebb titeralapanyag, mivel 99,9 %-os tisztaság is elérhető. Általában lúgok mennyiségi meghatározására használják. ElőfordulásaElőfordul a sóskában, spenótban és számos más növényben (az Oxalis és a Rumex fajokban), azonkívül az állati szervezetben (a vizeletben) részint szabad állapotban, részint különféle sók alakjában. Kalciumsója a vesekő leggyakoribb alkotója. A természetben található humboltin nevű ásvány nem egyéb, mint vas(II)-oxalát, a whewellit pedig kalcium-oxalát. Oxálsav képződik igen sok széntartalmú vegyület oxidációjakor, így a cukorféleségeknek, a szénhidrátoknak stb. salétromsavval való oxidálásakor. Kalciumsója vízben oldhatatlan (ezért okozhat vesekövet). Savanyú kálium sója (HOOC-COOK) a rozsdafoltot eltávolítja. Reakcióképessége, reakcióiAz oxálsav kétbázisú sav lévén, számos sót alkot, amelyeket oxalátoknak neveznek. Ezek közül fontosabbak:
Az oxálsav hidrogénatomjai különféle szénhidrogéncsoportokkal (metil, etil stb.) helyettesíthetők, ekkor az oxálsavnak különféle észterei keletkeznek. Az oxálsav amidja, az oxamid formamid elektrolízisével állítható elő.[5] ElőállításaNagy mennyiségben való előállítása úgy történik, hogy fűrészport kálium- és nátrium-hidroxid elegyével összekeverve, vasüstökben 200-220 °C-ra hevítenek, ekkor nátrium- és kálium-oxalát képződik. A megolvadt barna tömeget vízzel kivonják, és oltott mésszel főzik; ekkor kalcium-oxalát válik ki, amelyet kénsavval bontanak el, és a megszűrt oldatból kikristályosítják. Kis mennyiségben előállítható glükóz és salétromsav 1:5 arányú keverékének főzésével és a folyadék kristályosításával. A kereskedelemben előforduló oxálsav rendszerint nem tiszta, de igen könnyen megtisztítható vízben feloldva lassú hűtéssel. Jegyzetek
Források
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||