|
Ајнштајниум
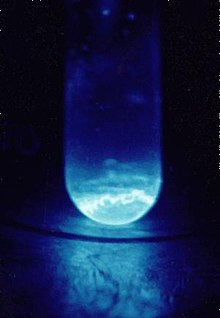
Ајнштајниум — вештачки елемент со симбол Es и атомски број 99. Член на актиноид серија, тоа е седмиот поурански елемент. Елементот бил откриен како составен дел на остатоците од првата експлозија на водородна експлозија во 1952 година и именувана по Алберт Ајнштајн. Неговиот најчест изотоп einsteinium-253 (полуживот 20,47 дена) се произведува вештачки од распаѓање на californium -253 во неколку посветени моќни јадрени реактори со вкупен принос од еден милиграм годишно. Синтезата на реакторот е проследена со комплексен процес на одвојување на еинстеиниум-253 од други актиноиди и производи од нивното распаѓање. Други изотопи се синтетизираат во различни лаборатории, но во многу помали количини, со бомбардирање на тешки актиноидни елементи со лесни јони. Благодарение на малите количини на произведени еинтеиниум и краткиот полуживот на најлесно произведениот изотоп, во моментов практично нема практични апликации надвор од основните научни истражувања. Особено, ајнстеиниум се користи за синтеза, за првпат, 17 атоми на новиот елемент менделевиум во 1955 година. Ајнштајн е мек, сребрен, парамагнетски метал. Нејзината хемија е типична за доцните актиноиди, со превласт на оксидациската состојба +3; +2 оксидациската состојба е исто така достапна, особено во цврсти материи. Високата радиоактивност на einsteinium-253 произведува видлив сјај и брзо ја оштетува својата кристална метална решетка со ослободена топлина од околу 1000 вати по грам. Тешкотии во проучувањето на нејзините својства се должи на einsteinium-253 распаѓање е да berkelium -249 а потоа californium -249 по стапка од околу 3% дневно. Изотопот на einsteinium со најдолг полуживот, einsteinium-252 (полуживот 471,7 дена) би бил посоодветен за испитување на физичките својства, но се докажал многу потешко да се произведе и е достапен само во мали количини, а не рефус.[1] Ајнштајнумот е елементот со највисок атомски број кој е забележан во макроскопските количества во чиста форма, а тоа е обичниот краткотраен изотоп einsteinium-253.[2] Како и сите вештачки трансуранозни елементи, изотопите на ајнштаниумот се многу радиоактивни и се сметаат за високо опасни за здравјето при ингестија.[3] Историја Ајнштајнумот првпат беше идентификуван во декември 1952 година од Алберт Џирсо и соработници на Универзитетот во Калифорнија, Беркли, во соработка со националните лаборатории Аргон и Лос Аламос, во последиците од јадрениот тест на Иви Мајк. Тестот беше спроведен на 1 ноември 1952 година во Атлетот Енеметка во Тихиот Океан и беше првиот успешен тест на водородната бомба.[4] Првично испитување на остатоците од експлозијата покажало производство на нов изотоп на плутониум, 244 Во тоа време, апсорпцијата на повеќе неутрони се сметаше за исклучително редок процес, но идентификацијата на 244  Ghiorso и соработниците ги анализирале документите за филтер, кои биле пренесен преку експлозивниот облак на авиони (истата техника за земање мостри која била користена за откривање на 244 Меѓутоа, некои 238 U-атоми можат да апсорбираат два дополнителни неутрони (вкупно 17), што резултира со 255 Ес, како и во изотопот од 255 Fm на друг нов елемент, фермиум.[7] Откривањето на новите елементи и придружните нови податоци за повеќекратно собирање на неутроните првично биле чувани во тајност по наредба на САД воена до 1955 година поради тензиите на Студената војна и конкуренцијата со Советскиот Сојуз во јадрените технологии.[4][8][9] Сепак, брзото зафаќање на толку многу неутрони ќе обезбеди потребна директна експериментална потврда на таканаречената апсорпција на апсорпција на неутрони на г-процес потребна за објаснување на космичката нуклеосинтеза (производство) на одредени тешки хемиски елементи (потешки од никел) во експлозии на супернови бета распаѓање. Таквиот процес е потребен за да се објасни постоењето на многу стабилни елементи во универзумот.[10] Во меѓувреме, во лабораториите Беркли и Аргон беа произведени изотопи на елементот 99 (како и на нов елемент 100, фермиум ), во јадрена реакција помеѓу азот- 14 и ураниум-238,[11] а подоцна и со интензивно неутронско зрачење на плутониум или калифорниум: Овие резултати беа објавени во неколку статии во 1954 година со одрекувањето дека тие не биле првите студии што биле спроведени на елементите.[12][13][14][15][16] Тимот на Беркли, исто така, објави некои резултати за хемиските својства на ајнштајнумот и фермиумот.[17][18] Резултатите на Ivy Mike беа декласифицирани и објавени во 1955 година.[8]  Во откривањето на елементите 99 и 100, американските тимови се натпреваруваа со група во Нобеловиот институт за физика, Стокхолм, Шведска. Кон крајот на 1953 година - почетокот на 1954 година, шведската група успеала во синтезата на светли изотопи на елементот 100, особено 250 Fm, со бомбардирање на ураниум со јадра на кислород. Овие резултати беа објавени во 1954 година.[19] Сепак, приоритетот на тимот на Беркли беше општо признаен, бидејќи неговите публикации му претходеа на шведскиот напис, а тие беа засновани на претходно неизложените резултати од термојадрената експлозија од 1952 година; така што на тимот на Беркли им беше дадена привилегија да ги именуваат новите елементи. Како што напорите што доведоа до дизајнот на Ајви Мајк беа со кодно име Project PANDA,[20] елементот 99 беше шега наречен "Пандамониум" [21] но официјалните имиња предложени од групата Беркли извлечени од два истакнати научници, Алберт Ајнштајн и Енрико Ферми : "Предложуваме за името на елементот со атомскиот број 99, ајнштаниум (симбол Е) по Алберт Ајнштајн и за името на елементот со атомски број 100, фермиум (симбол Fm), по Енрико Ферми".[8] И Ајнштајн и Ферми умреле меѓу времето кога првично биле предложени имињата и кога биле објавени. Откривањето на овие нови елементи го објави Алберт Џирсо на првата Женевска атомска конференција одржана на 8-20 август 1955 година.[4] Симболот за einsteinium за првпат беше даден како "E", а подоцна се промени во "Es" од IUPAC.[22][23] ОсобеностиФизички Ајнштајниумот е вештачки, сребрено-бел, радиоактивен метал. Во периодниот систем, се наоѓа десно од actinide калифорниум, лево од actinide фермиум и под лантаноидниот холмиум со кој има многу сличности во физичките и хемиските својства. Неговата густина е 8,84 г/см3 е пониска од онаа на californium (15.1 г/см3 ) и е речиси иста како онаа на холмиум (8.79 г/см3 ), и покрај тоа што атомскиот ајнштајн е многу потежок од холмиум. Точка на топење на ајнштаниум (860 °C) е исто така релативно ниско - под калифорниум (900 °C), фермиум (1527 °C) и холмиум (1461 °C).[3][25] Ајнштајнумот е мек метал, со модул на само 15 GPa, чија вредност е една од најниските кај не- алкалните метали.[26] Спротивно на полесните актиноиди калифорниум, берклиум, кириум и америциум кои кристализираат во двојна шестаголна структура во амбиентални услови, се верува дека ајнштаниумот има симетрична кубика ( fcc ) центрирана со просторна група Fm 3 m и константата на решетката a = 575 часот. Сепак, постои извештај на соба температура шестаголни einsteinium метал со 398 = часот и c = 650 часот, на кој се обратија во фаза FCC при загревање на 300 °C.[27] Самоповредувањето предизвикано од радиоактивноста на ајнштаниумот е толку силно што брзо ја уништува кристалната решетка [28] а ослободувањето на енергија за време на овој процес, 1000 вати по грам од 253 ЕС, предизвикува видлив сјај.[2] Овие процеси може да придонесат за релативно ниската густина и точката на топење на ајнштаниумот.[29] Понатаму, поради малата големина на расположливите примероци, точката на топење на ајнштаниумот често се добива преку набљудување на примерокот што се загрева во електронскиот микроскоп.[30] Така, површинските ефекти кај мали примероци може да ја намалат вредноста на точката на топење. Металот е двовалентен и има значително висока нестабилност.[31] Со цел да се намали оштетувањето на само-зрачење, повеќето мерења на цврстиот ајнштајум и неговите соединенија се изведуваат веднаш по топлински жарење.[32] Исто така, некои соединенија се изучуваат во атмосферата на гасот за редукција, на пример H 2 O + HCl за EsOCl, така што примерокот делумно се загрева за време на неговото распаѓање.[33] Освен самоуништувањето на цврстиот ајнштајум и неговите соединенија, другите суштински потешкотии во проучувањето на овој елемент вклучуваат недостиг - најчестиот 253 Es изотоп е достапен само еднаш или двапати годишно во сума милиграмски количини - и самозатушеност поради брзото претворање на еинтеиниум во берклиеум, а потоа на калифорниум со стапка од околу 3,3% дневно:[34][35][36] Така, повеќето примероци од еинстеиниум се контаминирани, а нивните вродени својства често се добиваат со екстраполација на експерименталните податоци акумулирани со текот на времето. Други експериментални техники за заобиколување на проблемот со контаминација вклучуваат селективно оптичко возбудување на еинстеиниумските јони од страна на подеслив ласер, како што е при проучувањето на нејзините својства на луминисценција.[37] Магнетни својства се изучуваат за метан на еинстеиниум, неговиот оксид и флуорид. Сите три материјали покажаа парамагнетно однесување на Curie-Weiss од течен хелиум до собна температура. Делотворните магнетни моменти беа изведени како 10,4 ± 0,3 за Es 2 O 3 и 11,4 ± 0,3 за EsF 3, кои се највисоки вредности меѓу актиноидите, а соодветните температури на Кјури се 53 и 37 K.[38][39] ХемискиКако и сите актиноиди, ајнштаниумот е прилично реактивен. Нејзината тривалентна оксидациона состојба е најстабилна во цврсти материи и воден раствор каде што предизвикува бледа розова боја.[40] Постоењето на двовалентен еинтениеум е цврсто утврдено, особено во цврстата фаза; таквата +2 состојба не е забележана кај многу други актиноиди, вклучувајќи пропактиниум, ураниум, нептуниум, плутониум, кириум и берклиум. Енстетиниум (II) соединенија може да се добијат, на пример, преку намалување на еинстеиниум (III) со самариум (II) хлорид.[41] Оксидационата состојба 4 беше претпоставена од студии на пареа и сè уште е неизвесна.[42] ИзотопиДеветнаесет нуклиди и три јадрени изомери се познати по еинстеиниум со атомски тежини кои се движат од 240 до 258. Сите се радиоактивни и најстабилниот нуклид, 252 ЕС, има полуживот од 471,7 дена.[43] Следни најстабилни изотопи се 254 ЕС (полуживот 275,7 дена),[44] 255 ЕС (39,8 дена) и 253 ЕС (20,47 дена). Сите останати изотопи имаат полуживот пократко од 40 часа, а повеќето од нив се распаѓаат за помалку од 30 минути. Од трите јадрени изомери, најстабилен е 254 m ЕС со полуживот од 39.3 часа.[45] Јадрено цепењеАјнштајнумот има висока стапка на јадрено цепење што резултира со ниска критична маса за одржлива јадрена верижна реакција. Оваа маса е 9,89 килограми за голи сфера од 254 Es изотоп и може да се намали на 2,9 со додавање на рефлектор од челик од 30 сантиметри, или дури и до 2,26 килограми со рефлектор изработен од вода од 20 см. Меѓутоа, дури и оваа мала критична маса во голема мера го надминува вкупниот износ на досега изолинеиум, особено на ретките 254 Es изотопи.[46] Природна појаваПоради краткиот полуживот на сите изотопи на ајнштаниум, секој исконски ајнштаниум - тоа е, ајнштаниум кој би можел да е присутен на Земјата за време на нејзиното формирање - одамна се распадна. Синтезата на ајнштаниум од природно-случуваат актиноиди ураниум и ториум во Земјината кора бара повеќекратно заробување на неутроните, што е крајно неверојатен настан. Затоа, сите копнени ајнштајниум се произведуваат во научни лаборатории, високоенергетски јадрени реактори или во тестови за јадрено оружје и е присутен само во рок од неколку години од времето на синтезата.[6] Трансуранските елементи од америциум до фермиум, вклучувајќи и еинстеиниум, природно се појавија во природниот јадрен реактор во Окло, но повеќе не го сторат тоа.[47] Ајнштајнум бил забележан во Пшибилскиевата Ѕвезда во 2008 година.[48] Синтеза и екстракција Ајнштајнумот се произведува во мали количини со бомбардирање на полесни актиноиди со неутрони во посветени јадрени реактори со висок флукс. Најголемите светски извори на зрачење се изворот на реакторот со високи флуксни изотопи (HFIR) од 85 мегавати во Националната лабораторија Ок Риџ во Тенеси, САД,[50] и СМ-2 јамскиот реактор во Институтот за истражување на атомски реактори (НИААР) во Димитровград, Русија,[51] кои се посветени на производство на транскириум ( Z > 96) елементи. Овие објекти имаат слични нивоа на моќ и флукс и се очекува да имаат споредливи производствени капацитети за транскириумски елементи,[52] иако количините произведени на NIIAR не се широко пријавени. Во "типична процесна обработка" во Оук Риџ, десетици грамови кириум се озрачени за да произведат дециграфски количини на калифорниум, милиграмни количини на берклиум ( 249 Bk) и еинстеиниум и пикограми количини на фермиум.[53][54] Првиот микроскопски примерок од примерок од 253 Е, кој тежи околу 10 нанограми, бил подготвен во 1961 година во HFIR. Посебна магнетна рамнотежа е дизајнирана да ја процени неговата тежина.[3][55] Поголеми серии беа произведени подоцна, почнувајќи од неколку килограми плутониум со приносите од еинстеиниум (најчесто 253 Ес) од 0,48 милиграми во 1967-1970, 3,2 милиграми во 1971-1973 година, проследено со стабилно производство од околу 3 милиграми годишно помеѓу 1974 и 1978 година.[56] Овие количини сепак се однесуваат на интегралното количество во целта веднаш по зрачењето. Последователните постапки на поделба го намалија износот на изотопично чист ајнштајум приближно десет пати.[52] Лабораториска синтезаТешките неутронски зрачења на плутониум резултираат со четири главни изотопи на ајнштајниум: 253 Е (α-емитер со полуживот од 20,47 дена и со спонтан полураспад на цепење од 7 × 10 5 години); 254 m Es (β-емитер со полуживот од 39,3 часа), 254 Es (α-емитер со полуживот од околу 276 дена) и 255 Es (β-емитер со полуживот од 39,8 дена).[57][58] Алтернативен пат вклучува бомбардирање на ураниум-238 со високоинтензивни азотни или кислородни јонски зраци.[59] Ајнштајнум-247 (полуживо 4,55 минути) беше произведена со израчење на америциум-241 со јаглерод или ураниум-238 со азотен јон.[60] Втората реакција прво беше реализирана во 1967 година во Дубна, Русија, а вклучените научници добија награда Ленин Комсомол.[61] Изотопот 248 Е е произведен со озрачување 249 Cf со деутериум јони. Тоа главно се распаѓа со емисија на електрони до 248 Cf со полуживот од 25 ± 5 минути, но исто така ослободува α-честички од 6,87 MeV енергија, со соодносот на електрони со α-честички од околу 400.[62] Потешите изотопи 249 Es, 250 Es, 251 Es и 252 Es беа добиени со бомбардирање на 249 Bk со α-честички. Во овој процес се ослободуваат 1-4 неутрони, со што се овозможува формирање на четири различни изотопи во една реакција.[63] Ајнштајнум-253 беше произведен со озрачување на 0,1-0,2 милиграма 252 Cf цел со топлински неутронски флукс од (2-5) × 10 14 неутрони · cm −2 · s −1 за 500-900 часа:[64] Синтеза во јадрени експлозии Анализата на остатоците на јадрениот тест на 10 мегабајти Ivy Mike беше дел од долгорочниот проект. Една од целите на која беше проучувањето на ефикасноста на производството на transuranium елементи во високоенергетски јадрени експлозии. Мотивот за овие експерименти беше дека синтезата на таквите елементи од ураниум бара повеќекратно заробување на неутроните. Веројатноста за такви настани се зголемува со неутронскиот флукс, а јадрените експлозии се најмоќните вештачки извори на неутрони, кои обезбедуваат густини на редот 10 23 неутрони / см 2 во микросекунда или околу 10 29 неутрони / (cm 2 · s ). За споредба, флуксот на реакторот HFIR е 5 ×1015 неутрони / (cm 2 · s). Посебна лабораторија е поставена токму на Атол Енететак за прелиминарна анализа на остатоци, бидејќи некои изотопи можеа да се распаднат до времето кога примероците од остатоците стигнаа до копното САД. Лабораторијата добија примероци за анализа колку што е можно поскоро, од авиони опремени со хартиени филтри кој леташе над атолот по тестовите. Додека се надеваше дека ќе откријат нови хемиски елементи потешки од фермиум, ниту еден од нив не беше пронајден ни по серија мегатон експлозии спроведени помеѓу 1954 и 1956 година во атолот.[5] Резултатите од атмосферата беа надополнети со податоците за подземните тестови акумулирани во 1960-тите години на тестот за тестирање во Невада, бидејќи се надеваа дека моќните експлозии во затворен простор може да резултираат со подобрени приноси и потешки изотопи. Освен традиционалните ураниумски надоместоци, биле користени комбинации на ураниум со америциум и ториум, како и мешан полнеж со плутониум-нептуниум, но тие биле помалку успешни во однос на приносот и се припишувале на посилни загуби на тешки изотопи поради зголемени стапки на цепење во обвиненија за тешки елементи. Изолацијата на производот беше проблематична, бидејќи експлозиите ширеа остатоци преку топење и испарување на околните карпи на длабочина од 300-600 метри. Дупчењето до такви длабочини за извлекување на производите беше и бавно и неефикасно во однос на собраните количини.[5][65] Меѓу деветте подземни тестови кои биле извршени помеѓу 1962 и 1969 година,[66][67] последниот бил најмоќниот и имал највисок принос на трансураниумските елементи. Милиграми од einsteinium кои вообичаено траеле една година на зрачење во реактор со висока моќност, биле произведени во микросекунда.[65] Сепак, главниот практичен проблем на целиот предлог беше собирањето на радиоактивните остатоци дисперзирани од моќната експлозија. Авионите филтри се адсорбирани само околу 4 ×10−14 од вкупната количина, а собирањето тони корали на атолот Енеметка ја зголеми оваа фракција за само два реда на големина. Екстракција од околу 500 килограми подземни карпи 60 дена по експлозијата на Хатх се опорави само околу 1 ×10−7 од вкупниот полнеж. Количината на трансураниумски елементи во оваа серија од 500 кг беше само 30 пати повисока отколку во 0,4 kg рок се подигнал 7 дена по тестот, кој ја демонстрираше високолинеарната зависност на трансуранските елементи врз износот на извлечената радиоактивна карпа.[68] Шахтите беа пробиени на местото пред тестот, со цел да се забрза собирањето примероци по експлозијата, така што експлозијата би протекувала радиоактивен материјал од епицентарот низ шахтите и до собирање на волумени во близина на површината. Овој метод се обиде во два теста и веднаш обезбедил стотици килограми материјал, но со актиноид концентрација 3 пати пониска отколку кај примероците добиени по дупчење. Бидејќи таков метод можеше да биде ефикасен во научните истражувања на краткотрајните изотопи, тој не можеше да ја подобри целокупната ефикасност на собирањето на произведените актиноиди.[69] Иако нови елементи (освен еинстеиниум и фермиум) може да се откријат во остатоците од јадрените тестови, а вкупните приноси на трансуранските елементи беа разочарувачки ниски, овие тестови даваа значително повисоки количини на ретки тешки изотопи од претходно достапни во лаборатории.[70] Одделување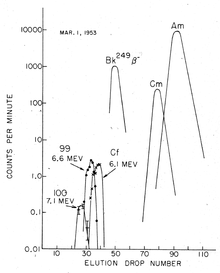 Постапката на поделба на ајнштаниумот зависи од методот на синтеза. Во случај на бомбардирање со светло-јон во циклотронот, тешката јонска цевка е прицврстена за тенка фолија, а генерираниот ајнштаниум едноставно е измиен од фолија по зрачење. Сепак, произведените количини во таквите експерименти се релативно ниски.[71] Приносите се многу повисоки за зрачење на реакторот, но таму, производот е мешавина од разни изотопи на актиноид, како и лантаноиди произведени во распаѓањето на јадреното цепење. Во овој случај, изолацијата на ајнштаниум е досадна постапка која вклучува неколку повторувачки чекори на размена на катјони, при покачена температура и притисок и хроматографија. Одделувањето од берклиум е важно, бидејќи најчестиот изотоп на еинтеиниум произведен во јадрени реактори, 253 Ес, се распаѓа со полуживот од само 20 дена до 249 Бк, што е брз во временската рамка на повеќето експерименти. Ваквото одвојување се потпира на фактот дека берклиевиот лесно се оксидира до цврстата +4 состојба и преципитира, додека други актиноиди, вклучувајќи го и еинтеиниумот, остануваат во нивната +3 состојба во растворите.[72] Одделувањето на тривалентни актиноиди од производи за фицијација на лантаноид може да се направи со колона со размена на катјони со употреба на 90% вода / 10% раствор на етанол заситен со хлороводородна киселина (HCl) како елуант. Обично е проследена со анјоноразмена хроматографија користејќи 6 моларни HCl како елуантна. Потоа се користи колонска колона за размена на катјони (колона за размена на Dowex-50) третирана со соли на амониум за да се одделат фракции кои содржат елементи 99, 100 и 101. Овие елементи може да се идентификуваат едноставно врз основа на нивната позиција / време на елуција, со користење на раствор на α-хидроксиизобутират (α-HIB), на пример, како елуанс.[73] Поделбата на 3 + актиноидите исто така може да се постигне со хроматографија со екстракција на растворувач, со користење на бис- (2-етилхексил) фосфорна киселина (скратено како HDEHP) како стационарна органска фаза и азотна киселина како мобилна водена фаза. Актиноидната елуциска секвенца е обратна од онаа на колоната на размена на катјони. Ејнштиниумот разделен со овој метод има предност да биде ослободен од органски комплексен агенс, во споредба со одделување со смола колона.[73] Подготовка на металАјнштајнумот е многу реактивен и поради тоа се потребни силни агенси за редукција за да се добие чист метал од неговите соединенија.[74] Ова може да се постигне со редукција на еинстеиниум (III) флуорид со метален литиум : Сепак, поради неговата ниска точка на топење и висока стапка на оштетување на само-зрачење, ајнштаниумот има висок притисок на пареа, што е повисоко од оној на литиум флуорид. Ова ја прави оваа редукција реакција прилично неефикасна. Тоа беше пробано во почетокот на обидите за подготовка и брзо се напушти во корист на редукција на еинстеиниум (III) оксид со лантан метал:[27][29][75] Хемиски соединенија
ОксидиАјнштајнум (III) оксид (Es 2 O 3 ) се добива со горење на еинстеиниум (III) нитрат. Таа формира безбојни кубни кристали, кои први се одликуваат од примероци од микрограми со големина околу 30 нанометри.[28][35] Две други фази, моноклинни и шестаголни, се познати по овој оксид. Формирањето на одредена фаза Es 2 O 3 зависи од техниката на подготовка и историјата на примерокот, и не постои јасен фазен дијаграм. Интерконверзиите меѓу трите фази може да се појават спонтано, како резултат на самооблучение или самозагревање.[84] Шестаголната фаза е изотипична со лантан (III) оксид каде што Es 3+ јон е опкружен со 6-координирана група на O 2- јони.[76][81] Халиди Ајнштаниум (III) флуорид (EsF 3 ) може да се преципитира од растворите на еинстеиниум (III) хлорид по реакција со флуоридните јони. Алтернативна процедура за подготовка е експлоатација на еинстеиниум (III) оксид во хлорен трифлуорид (ClF 3 ) или F 2 гас под притисок од 1-2 атмосфери и температура помеѓу 300 и 400 °C. Кристалната структура на EsF 3 е шестаголна, како кај калифорниумот (III) флуорид (CfF 3 ), каде што Es 3 + јоните се 8-пати координирани од флуорните јони во бикопчани триаголни призми.[34][85][86] Ајнштаниум (III) хлорид (EsCl 3 ) може да се подготви со annealing einsteinium (III) оксид во атмосферата на сува пареа на хлороводород на околу 500 °C околу 20 минути. Кристализира по ладење на околу 425 °C во портокалова цврста форма со шестаголна структура од типот UCl <sub id="mwAfA">3</sub>, каде атомите на ајнштаниумот се 9 пати координирани со атоми на хлор во геометриската триаголна призма.[79][85][87] Einsteinium (III) бромид (EsBr 3) е бледо-жолта солидна со monoclinic структура на AlCl <sub id="mwAfQ">3</sub> тип, каде што einsteinium атоми се octahedrally координирани од страна на бром (координација број 6).[82][85] Двавалентните соединенија на еинстеиниум се добиваат со редуцирање на тривалентните халиди со водород :[88]
Einsteinium (II) хлорид (EsCl 2), [89] einsteinium (II) бромид (EsBr 2), [90] и einsteinium (II) јодид (ЕСИ 2) [83] се произведени и се одликува со оптички апсорпција, без сè уште постојат структурни информации.[82] Познати оксихариди на еинстеиниум вклучуваат EsOCl,[83] EsOBr [88] и EsOI.[83] Тие се синтетизираат со третирање на трихалид со пареа смеса од вода и соодветниот водороден халид: на пример, EsCl 3 + H 2 O / HCl за да се добие EsOCl.[33] Органоинтеиниеви соединенијаВисоката радиоактивност на ајнштаниумот има потенцијална употреба во зрачната терапија, а органометални комплекси се синтетизирани со цел да се доставуваат амините на ајнштајните на соодветен орган во телото. Експериментите се направени за инјектирање на еинстеиниум цитрат (како и соединенија на фермиум) кај кучињата.[2] Ајнштајнум (III) исто така беше инкорпориран во бета-дикетон хелатните комплекси, бидејќи аналогните комплекси со лантаноиди претходно покажаа најсилна УВ-возбудена луминисценција меѓу металоорганските соединенија. Кога се подготвуваат еинтеиниумски комплекси, Es 3 + јоните беа 1000 пати разредени со Gd 3 + јони. Ова овозможи намалување на оштетувањето од зрачењето, така што соединенијата не се распаднаа во период од 20 минути потребни за мерење. Резултирачката луминисценција од Es 3+ беше премногу слаба за да се открие. Ова беше објаснето со неповолните релативни енергии на поединечните состојки на соединението што го оневозможија ефикасниот трансфер на енергија од хелатната матрица до Es 3 + јоните. Сличен заклучок беше извлечен и за други актиноиди америциум, берклиум и фермиум.[91] Сепак, луминисценцијата на Es 3+ јони беше забележана во раствори на неоргански соли на хлороводородна киселина, како и во органски раствор со ди (2-етилхексил) ортофосфорна киселина. Тоа покажува широк врв на околу 1064 нанометри (половина ширина околу 100 nm) што може да биде резонантно возбудена со зелено светло (околу 495 nm бранова должина). Луминисценцијата има животен век од неколку микросекунди и квантниот принос под 0.1%. Релативно високиот, споредено со лантаноидите, нерадијативните стапки на распаѓање кај Es 3 + се поврзуваат со посилната интеракција на f-електроните со внатрешните електрони Es 3+.[92] АпликацииРечиси нема корист за било кој изотоп на ајнштаниум надвор од основните научни истражувања со цел производство на повисоки трансуранински елементи и трансактиноиди.[93] Во 1955 година, менделевиумот се синтетизира со израчење на целна која се состои од околу 10 9</supозрачување атоми од 253 Ес во 60-инчниот циклотрон во Лабораторијата Беркли. Резултирачката 253 Es (α, n) 256 Md реакција даде 17 атоми на новиот елемент со атомски број од 101.[94] Реткиот изотоп einsteinium-254 е фаворизиран за производство на ултрависоки елементи поради неговата голема маса, релативно долг полуживот од 270 дена и достапност во значителни количини од неколку микрограми.[95] Оттука, einsteinium-254 беше искористен како цел во обидот за синтеза на невенлиум (елемент 119) во 1985 година, бомбардирајќи ја со јони на калциум-48 на линеарен акцелератор superHILAC во Беркли, Калифорнија. Не се идентификувани атоми, поставувајќи го горната граница за пресекот на оваа реакција на 300 нанобарни.[96] Ајнштајнум-254 беше користен како маркер за баждарење во спектрометарот за хемиска анализа (" алфа-расфрлачки површински анализатор ") на месечевата сонда " Surveyor 5". Големата маса на овој изотоп го намали спектралното преклопување помеѓу сигналите од маркерот и проучуваните полесни елементи на површината на Месечината.[97] БезбедностПовеќето од достапните податоци за токсичноста на еинтеиниум потекнуваат од истражување на животни. По ингестија од стаорци, само околу 0,01% еинстеиниум завршува во крвотокот. Од таму, околу 65% одат во коските, каде што останува околу 50 години, 25% во белите дробови (биолошки полуживот околу 20 години, иако ова е нерелевантно поради кратките полуживоти на еинтеиниум изотопи), 0.035 % на тестисите или 0,01% на јајниците - каде што еинстеиниумот останува на неодредено време. Околу 10% од внесената количина се излачува. Дистрибуцијата на ајнштаниум врз површините на коските е еднаква и е слична на онаа на плутониум.[98] Наводи
Библиографија
Надворешни врски
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


![{\displaystyle {\ce {^{238}_{92}U->[{\ce {+6(n,\gamma )}}][-2\ \beta ^{-}]{}_{94}^{244}Pu}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/adc5607f4aa66702f7f8331613b838b19e5fbccc)
![{\displaystyle {\ce {^{238}_{92}U ->[{\ce {+15n}}][6 \beta^-] ^{253}_{98}Cf ->[\beta^-] ^{253}_{99}Es}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/54c4fccdd01ebda8ab75c3aac855a348c6f5ea2c)
![{\displaystyle {\ce {^{252}_{98}Cf ->[{\ce {(n,\gamma)}}] ^{253}_{98}Cf ->[\beta^-][17.81 {\ce {d}}] ^{253}_{99}Es ->[{\ce {(n,\gamma)}}] ^{254}_{99}Es ->[\beta^-] ^{254}_{100}Fm}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/63f13874738d0dfe8637d3dd71bef4ba0cbc6b14)