|
Raio atómico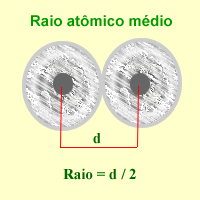 O raio atômico (português brasileiro) ou raio atómico (português europeu) é uma estimativa de distância do núcleo à última camada eletrônica. Ao contrário do que se poderia pensar, o raio atômico não depende apenas do peso do átomo e/ou da quantidade de elétrons presentes na eletrosfera, sendo fortemente influenciado pela carga nuclear efetiva (Zef) de cada elemento.[1][2][3] Numa explicação simplificada, o raio atômico é a distância entre o centro do átomo e a sua camada de valência, que é o nível de energia com elétrons mais externo deste átomo. Como consequência do átomo não ser rígido é impossível calcular o seu raio atômico exato. Deste modo, calcula-se o seu raio atômico médio.[1] Devido a dificuldade em obter-se o raio de átomos isolados determina-se (através de raio X) a distância entre os núcleos de dois átomos ligados do mesmo elemento, no estado gasoso. O raio atômico será metade da distância calculada. Tendências Periódicas nos Raios Atômicos
PropriedadesOs núcleos atômicos encontram-se, em condições normais, no seu estado fundamental. Algumas propriedades observáveis podem ser extraídas desses núcleos. O raio nuclear é uma das propriedades mais fáceis de observar e pode ser obtido a partir de experiências de dispersão como as realizadas por Rutherford. Como base nessas experiências, percebeu-se que era uma boa aproximação considerar o raio nuclear R como relacionado à massa nuclear pela expressão
Onde . O raio nuclear determina a forma da distribuição angular, a partir da qual se pode então calculá-lo.[4] Partículas Alfa Uma experiência de espalhamento elástico envolvendo núcleos pesados foi feita em 1954 por Farwell e Wegner. Com energia intermediária de 13 a 43 MeV usando um cíclotron de 60 polegadas. O resultado obtido envolvendo uma amostra de Pb (chumbo) a 60º esta reproduzido na figura. A curva de Coulomb corrigida está normalizada pelos dados experimentais de baixa energia. Esta curva segue aproximadamente a dependência com o inverso do quadrado da seção de choque de Coulomb (Rutherford) com a energia, mas está levemente alterada a fim de levar em conta pequenas variações do ângulo de espalhamento com a energia devido ao campo magnético do cíclotron.[4] Em baixas energias observa-se a teoria do espalhamento de Rutherford correta; porém, a partir de energias por volta de 27 MeV, com o aumento da energia de partícula alfa, a seção do choque cai rapidamente, obrigando a partir disso a adotar outros modelos a fim de explicar a aproximação da partícula alfa do núcleo atômico. Tendo essas dúvidas em cheque, os cientistas Farwell e Wegner baseados em um modelo apresentado por Blair, que explicava as absorções de partículas alfa pelo núcleo. Blair supôs que a soma dos raios nuclear com a partícula alfa seria aproximadamente igual à distância de máxima aproximação calculada na energia para a qual a seção de choque experimental é 1/4 da seção de choque Coulomb. Tendo a expressão:
Onde D1/4 é a distância de máxima aproximação, Rn é o raio do núcleo e R α. Raio atômico medido empiricamenteO raio atômico pode ser medido empiricamente em picômetros (pm) com uma precisão aproximada de 5 pm.[5]
Raio atômico calculadoRaio atômico calculado em picômetros (pm)
Veja tambémReferências
Information related to Raio atómico |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


