环辛四烯
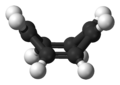
环辛四烯的结构式 环辛四烯的球棍模型
IUPAC名
别名
[8]-轮烯
缩写
COT
识别
CAS号
629-20-9 Y
ChemSpider
553448
SMILES
InChI
1/C8H8/c1-2-4-6-8-7-5-3-1/h1-8H/b2-1-,3-1-,4-2-,5-3-,6-4-,7-5-,8-6-,8-7-
InChIKey
KDUIUFJBNGTBMD-BONZMOEMBR
RTECS
CY1400000
性质
化学式
C
摩尔质量
104.15 g·mol⁻¹
外观
金黄色液体
密度
0.9250 g/cm³ (液体)
熔点
−5 – −3°C (268-270K)
沸点
142-143°C (415-416K)
溶解性 (水 )
不互溶
危险性
警示术语
R:R45 R46 R11 R36/38 R48/23/24/25 R65
安全术语
S:S53 S45
欧盟分类
可燃 (F )第一类致癌物质 第二类致诱变剂 T )
NFPA 704
闪点
−11 °C
自燃温度
561 °C
相关物质
相关化学品
环丁二烯 、苯 、环辛烷
若非注明,所有数据均出自标准状态(25 ℃,100 kPa) 下。
环辛四烯 (英語:Cyclooctatetraene )是指环辛烷 的完全不饱和 衍生物 ,化学式
C
8
H
8
{\displaystyle {\ce {C8H8}}}
环状多烯烃 ,结构与苯 相似。
与苯 不同的是,环辛四烯不具芳香性 。它的化学性质类似于不饱和烃 ,可以发生加成反应 : 加氢 生成环辛烷 ; 也容易被氧化 和发生聚合 。相反苯则容易进行亲电取代反应 。
1,3,5,7-环辛四烯最初由里夏德·维尔施泰特 (Willstätter)于1905年在慕尼黑 合成。[ 1] [ 2]
上述合成中的原料伪石榴碱 分子中已经有一个八元环。在经过十三步反应之后,反应的总产率很低‚只有0.75%,最后分离出的产物也只有1g左右。因此环辛四烯在当时是相当难得到的物质,对它性质的研究也很不充分。上述合成方法当时被认为是有机合成中新颖的合成法之一,但受其复杂性所限,它仅被其他化学家重复过一次,这使维尔施泰特感到十分苦恼。
以上合成法中,第一个箭头为钠 /醇还原酮为醇,以及酸性条件下消除水,第二个箭头为胺 的甲基化 和季铵盐 的霍夫曼消除反应 ,第三个箭头同样为胺甲基化和霍夫曼消除,第四个箭头为溴对多烯的共轭加成和二甲胺的亲核取代,最后一个箭头再次为胺甲基化和霍夫曼消除反应。多次对霍夫曼消除反应的利用可能是维尔施泰特能成功合成反应性很强的环辛四烯的秘诀。
1939年至1943年间,美国 的化学家制取环辛四烯均未成功,因此这些人对维尔施泰特的合成产生了质疑,称维尔施泰特并未制出环辛四烯,而是制出了它的同分异构体 苯乙烯 。维尔施泰特在他的自传中回答说,他将环辛四烯催化氢化还原后得到了环辛烷 ,将环辛四烯氧化后也得到了辛二酸 ,从而证明了他制出的不是苯乙烯 。1947年,查尔斯·奥弗贝格 (Charles Overberger)在亚瑟·科雷·科普 (Arthur Cope)的指导下,终于通过重复维尔施泰特的试验,成功制出了环辛四烯。[ 3]
1940年德国 化学家沃尔特·列培 乙炔 的化学性质时,偶然发现了另一条制取环辛四烯的路线,即乙炔四聚法 。他将乙炔在四氢呋喃 (THF)中的溶液、碳化钙 和一种镍盐 催化剂在20个大气压下共热,得到了产率非常高(90%)的环辛四烯。其中使用的镍盐通式为
NiX
2
{\displaystyle {\ce {NiX2}}}
氰化镍 、乙酰乙酸 镍或硫氰酸镍 。[ 4] 镍 原子以八面体分别与两个X(邻位)与四个乙炔配位 (页面存档备份 ,存于互联网档案馆 ),四个乙炔的特定排列方式有利于四聚合进行,使这一在熵 变上不利的环化反应变为可能,而且可以以颇高的收率生成四聚产物。
在1948年列培将这个发现发表后,乙炔四聚法成了制取环辛四烯的最主要方法,用这个方法可以实现环辛四烯的大量生产。
环辛四烯的浴盆型结构。 虽然早期的电子衍射 实验结果显示环辛四烯中的碳-碳键长是等同的,[ 5] 芳香性 。[ 6] [ 7]
这说明,环辛四烯虽然与苯 一样是一种轮烯 ,但它不是芳香烃 ,通常状态下为非平面的澡盆型结构(D 2d ),键角∠C=C-C = 126.1°,∠C=C-H = 117.6°。[ 8] 芳香性 ,也没有反芳香性 ,也不适用于休克尔规则 分析。
如果将环辛四烯浴盆状构象(D 2d )的能量看作0,那么理论计算得出其双键定域的平面结构(D 4d )的能量为44.35kJ/mol,其双键电子离域的平面结构(D 8d )的能量则为61.50kJ/mol (HF/6-31G*结果)。[ 9] [ 10] [ 11]
由于不为平面结构且双键定域,因此取代的环辛四烯可能有两种异构体:环反转(类似于胺 的氮反转 )异构体,以及双键易位的互变异构 体(类似于苯的两种凯库勒式)。延伸阅读
环辛四烯稳定性不高,容易生成爆炸性的有机过氧化物 ,因此市售产品中通常加入少量的氢醌 作稳定剂 。使用环辛四烯之前应当检验过氧化物的存在。过氧化物多以白色晶体的形式附着在瓶盖和瓶颈周围,如果处理方式不当可能引发爆炸 ,因此使用时必须小心。
环辛四烯的化学性质类似于多烯烃 :它可以与过酸 或二甲基过氧化酮 作用生成单或多环氧化 的产物,也可以与溴 、卤化氢 发生加成反应 。烷基 取代的环辛四烯发生开环复分解聚合 ,可以得到稳定的聚乙炔 衍生物。[ 12] [ 13]
环辛四烯可以发生电环化反应 生成双环[4.2.0]辛-2,4,7-三烯,这两者形成平衡但以环辛四烯为主(99.99%),双环形式只占约0.01%。但环辛四烯溴化时,主要生成的是7,8-二溴双环[4.2.0]辛-2,4-二烯。(参考资料 )
在70℃和~300nm光源照射气相环辛四烯时,环辛四烯可以几乎定量地异构为半瞬烯 (Semibullvalene)——三环[3.3.0.02,8 ]辛-3,6-二烯。
环辛四烯双负离子 COT2− 的球棍模型 结构。 双(环辛四烯)合铀 是环辛四烯配合物的一个例子,它属于夹心型配合物 ,两个环辛四烯环分别位于铀原子上下。环辛四烯(
COT
{\displaystyle {\ce {COT}}}
钾 作用时生成
K
2
COT
{\displaystyle {\ce {K2COT}}}
COT
2
−
{\displaystyle {\ce {COT^{2-}}}}
双负离子 。[ 14]
K
2
COT
{\displaystyle {\ce {K2COT}}}
稀土金属 )形成的配合物 ,比如夹心型 的双(环辛四烯基)合铀 (
U
(
COT
)
2
{\displaystyle {\ce {U(COT)2}}}
双(环辛四烯基)合铁 (
Fe
(
COT
)
2
{\displaystyle {\ce {Fe(COT)2}}}
Eu
−
COT
{\displaystyle {\ce {Eu-COT}}}
Fe
(
COT
)
2
{\displaystyle {\ce {Fe(COT)2}}}
甲苯 中与二甲基亚砜 和二甲氧基乙烷 回流5天后,转化为四氧化三铁 (磁铁矿 )和含有碳纳米管 的晶状碳单质。[ 15]
环辛四烯已在某些真菌 中分离出来。[ 16]
^ Mason, S. The Science and Humanism of Linus Pauling (1901-1994). Chemical Society Reviews. 1997, 26 (1). ^ Richard Willstätter , Ernst Waser. Über Cyclo-octatetraen. Berichte der deutschen chemischen Gesellschaft. 1911, 44 (3): 3423–3445. doi:10.1002/cber.191104403216 ^ Cope, A. C.; Overberger C. G. J. Am. Chem. Soc. 1947, (69): 476. ^ Walter Reppe, Otto Schlichting, Karl Klager, Tim Toepel. Cyclisierende Polymerisation von Acetylen I Über Cyclooctatetraen. Justus Liebigs Annalen der Chemie. 1948, 560 (1): 1–92. doi:10.1002/jlac.19485600102 ^ Bastiensen, O.; Hassel, O.; Langseth, A. The ‘Octa-Benzene’, Cyclo-octatetraene (C8 H8 ). Nature . 1947, 160 (4056): 128. doi:10.1038/160128a0 ^ Johnson, A.W., Sci. Progress ; 506; 1947 ; 35.
^ Kaufman, H. S.; Fankuchen, I.; Mark, H. Structure of Cyclo-octatetraene. Nature . 1948, 161 (4083): 165. doi:10.1038/161165a0 ^ Thomas, P. M.; Weber, A. High resolution Raman spectroscopy of gases with laser sources. XIII - the pure rotational spectra of 1,3,5,7-cyclooctatetraene and 1,5-cyclooctadiene . Journal of Raman Spectroscopy. 1978, 7 (6): 353–357. doi:10.1002/jrs.1250070614 ^ Paquette, L. A. Acc. Chem. Res. 1993, 26 (57). ^ Hrovat, D. A.; W. T. Borden. J. Am. Chem. Soc. 1992, 114 (5879). ^ Politzer, P.; J. S. Murray, J. M. Seminario. Int. J. Quantum Chem. 1994, 50 (273). ^ 美國專利第5,198,153号 ^ Jozefiak, T. H.; Ginsburg, E. J.; Gorman, C. B.; Grubbs, R. H.; Lewis, N. S. Voltammetric Characterization of Soluble Polyacetylene Derivatives Obtained from the Ring-Opening Metathesis Polymerization (ROMP) of Substituted Cyclooctatetraenes. J. Am. Chem. Soc. 1993, 115 : 4705–4713. doi:10.1021/ja00064a035 ^ Katz, Thomas J. The cyclooctatetraenyl dianion. J. Am. Chem. Soc. 1960, 82 (14): 3784–3785. doi:10.1021/ja01499a077 ^ Walter, Erich C.; Tobias Beetz, Matthew Y. Sfeir, Louis E. Brus, Michael L. Steigerwald. Crystalline Graphite from an Organometallic Solution-Phase Reaction. J. Am. Chem. Soc. 2006, 128 (49): 15590–15591. doi:10.1021/ja0666203 ^ Stinson, M.; Ezra, D.; Hess, W. M.; Sears, J.; Strobel, G. An endophytic Gliocladium sp. of Eucryphia cordifolia producing selective volatile antimicrobial compounds. Plant Science. 2003, 16 : 913–922. doi:10.1016/S0168-9452(03)00299-1