|
Asam amino Asam amino adalah senyawa organik yang memiliki gugus fungsi karboksil (–COOH) dan amina (biasanya –NH2), serta rantai samping (gugus R) yang spesifik untuk setiap jenis asam amino.[1] Dalam biokimia sering kali pengertiannya dipersempit: gugus karboksil dan amina terikat pada satu atom karbon (C) yang sama (disebut karbon alfa atau karbon-α). Dalam kasus ini, mereka dikenal sebagai asam amino-2 atau asam amino-alfa (rumus umumnya H2NCHRCOOH, kecuali pada prolina[a]). Gugus karboksil memberikan sifat asam dan gugus amina memberikan sifat basa. Dalam bentuk larutan, asam amino bersifat amfoterik: cenderung menjadi asam pada larutan basa dan menjadi basa pada larutan asam. Perilaku ini terjadi karena asam amino mampu menjadi ion zwitter. Ada sekitar 500 asam amino yang telah diketahui, meskipun hanya 20 yang dihasilkan oleh kode genetik.[1] Dua puluh asam amino standar ini, ditambah dengan dua asam amino lainnya, merupakan asam amino yang menjadi komponen penyusun protein sehingga disebut asam amino proteinogenik. Asam amino-asam amino ini bergabung melalui ikatan peptida membentuk molekul besar yang disebut peptida, polipeptida, hingga protein. Selain berperan sebagai residu dalam protein, asam amino (baik proteinogenik maupun nonproteinogenik) juga berpartisipasi dalam sejumlah proses biologis misalnya glutamat (asam glutamat standar) dan asam gamma-aminobutirat (GABA) yang berperan sebagai neurotransmiter. Sembilan asam amino proteinogenik disebut "esensial" bagi manusia karena tidak bisa diproduksi oleh tubuh manusia dari senyawa lain sehingga harus diperoleh dari makanan. Asam amino lainnya mungkin bersifat esensial dalam kondisi tertentu, misalnya untuk usia atau kondisi medis tertentu. Asam amino esensial juga dapat berbeda-beda di antara spesies.[b] Karena signifikansi biologisnya, asam amino penting dalam nutrisi dan biasanya digunakan dalam suplemen nutrisi, pupuk, pakan, dan teknologi makanan. Penggunaan asam amino dalam industri misalnya produksi obat-obatan, plastik terdegradasi biologis, dan katalis kiral. Asam-asam amino yang terdapat dalam protein adalah α-aminokarboksilat, variasi dalam struktur monomer-monomer ini terjadi dalam rantai samping. Asam amino tersederhana adalah asam aminoasetat (H2NCH2CO2H) yang di sebut glisina yang tidak memiliki rantai samping dank arena itu tidak mengandung satu karbon kiral [2] Identifikasi Asam Amino Perkembangan penelitian tentang asam amino menurut Quigley,et al., (2019). Dengan menggunakan GC-MS (Gas Chromatography Mass Spectrometry) menyelidiki kadar asam amino diberbagai ekstrak tumbuhan dan produk makanan, dan pengaruh proses fermentasi terhadap kadar asam amino yang di teliti dalam sosis. Beberapa metode sebelum asam amino dianalisis, maka proteinnya harus dihidrolisis terlebih dahulu sehingga mengahasilkan asam amino bebas. Masalah yang dikuartirkan adalah rusaknya asam amino oleh hidrolisis asam amino. Reaksi menjadi lebh tinggi justru asam amino essensial dan asam amino pembatas yang lebih sering mengalami kerusakan seperti metionin dan sistein, oleh karena prlu adanya prosedur baku. Sejauh ini perkembangan analisis asam amino banyak menggunakan HPLC dan GC-MS keduanya memiliki kompoenen yang berbeda. Dari peneliti-peneliti sebelumnya identifikasi asam amino menggunakan instrument GC-MS, ada beberapa tahap hidrolisis protein dan tahap derivatisasi Analisis Asam AminoAnalisis asam amino atau mengidentifikasi asam amino bisa dilakukan dengan tes xantroprotein, tes biuret, tes hopkins-cole dan tes nin hydrin. Metode analisis asam amino memerlukan perlakuan pendahuluan terhadap sampel, yaitu untuk menghidrolisis protein menjadi asam-asam amino bebas. Masalah utama dalam analisis asam amino bahan pangan adalah kemungkinan terjadinya destruksi asam amino selama proses hidrolisis oleh asam. Masalah ini menjadi lebih besar karena destruksi tersebut dapat terjadi justru pada asam-asam amino esensial, yaitu metionin, sistin, lisin, treonin, dan triptofan.[3] Tes Xantro ProteinPereaksi xantoprotein adalah larutan asam nitrat pekat. Jika larutan HNO3 pekat dimasukkan ke dalam larutan protein secara hati-hati, akan terbentuk endapan putih, dan berubah menjadi kuning jika dipanaskan. Gejala ini akibat nitrasi pada inti benzena yang terdapat dalam protein Tes biuretLarutan protein memberikan hasil yang positif terhadap pereaksi biuret. Tes Biuret dilakukan dengan cara menuangkan larutan natrium hidroksida pekat ke dalam larutan protein. Kemudian, larutan CuSO4 ditambahkan setetes demi setetes yang akan terbentuk warna ungu Tes hopkins-colePereaksi Hopkins-cole dibuat dari asam oksalat dan serbuk magnesium dalam air. Pereaksi ini positif terhadap protein yang mengandung asam amino dengan gugus samping indol, seperti pada asam amino triptofan. Bereaksi dengan asam glioksilat pada prekasi Hopkins-cole dengan penambahan H2SO4 membentuk dua lapisan dibawah protein sampai terbentk cincin ungupada batas antar dua lapisan Tes NinhydrinPereaksi ninhidrin merupakan oksidator lemah, asam amino dapat bereaksi dengan ninhidrin Klasifikasi Asam AminoAsam Amino Non EsensialAsparagin, alanine Aspartat, sistein ,Glutamin, Glutamat Glisin, Prolin, Tirosin, serin Asam Amino EsensialHistidin, Isoleusin, Leusin, Lisin, Metionin, Penilalanin, Treonin, Triptofan, Valin. Arganin SejarahBeberapa asam amino pertama ditemukan pada awal abad ke-19.[4][5] Pada tahun 1806, ahli kimia Prancis Louis-Nicolas Vauquelin dan Pierre Jean Robiquet mengisolasi senyawa dalam asparagus yang kemudian dinamai asparagina, asam amino pertama yang ditemukan.[6][7] Sistin ditemukan pada tahun 1810,[8] meskipun monomernya, sistein, tetap tidak ditemukan hingga tahun 1884.[7][9] Glisina dan leusina ditemukan pada tahun 1820.[10] Treonina adalah jenis terakhir dari 20 asam amino umum yang ditemukan pada tahun 1935 oleh William Cumming Rose, yang juga menentukan asam amino esensial dan menetapkan kebutuhan harian minimum dari semua asam amino untuk pertumbuhan yang optimal.[11][12] Kesatuan kategori kimia diusulkan oleh Wurtz pada tahun 1865, tetapi ia tidak memberikan nama khusus.[13] Penggunaan pertama istilah "amino acid" dalam bahasa Inggris tercatat dari tahun 1898,[14] sedangkan istilah Jerman, Aminosäure, telah digunakan sebelumnya.[15] Protein diketahui menghasilkan asam amino setelah pencernaan enzimatik atau hidrolisis asam dipahami. Pada tahun 1902, Emil Fischer dan Franz Hofmeister secara independen mengusulkan bahwa protein terbentuk dari banyak asam amino, dengan pembentukan ikatan di antara gugus amino dari satu asam amino dengan gugus karboksil dari asam amino lainnya, menghasilkan struktur linier yang disebut Fischer sebagai "peptida".[16] Struktur umum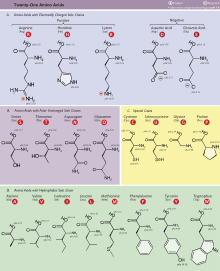  Struktur asam amino secara umum adalah satu atom karbon (C) yang mengikat empat gugus: gugus amina (–NH2), gugus karboksil (–COOH), atom hidrogen (H), dan satu gugus sisa (R, dari residu) sebagai substituen organik yang dikenal sebagai rantai samping yang membedakan satu asam amino dengan asam amino lainnya. Sesuai dengan penamaan senyawa bergugus karboksil, atom C pusat tersebut dinamai atom Cα ("C-alfa"), yaitu atom C yang berikatan langsung dengan gugus karboksil. Karena gugus amina juga terikat pada atom Cα ini, senyawa tersebut merupakan asam amino-α.[17] Asam amino biasanya diklasifikasikan berdasarkan sifat kimia rantai samping tersebut menjadi empat kelompok. Rantai samping dapat membuat asam amino bersifat asam lemah, basa lemah, hidrofilik jika polar, dan hidrofobik jika nonpolar. Isomerisme Karena atom C pusat mengikat empat gugus yang berbeda, maka asam amino—kecuali glisina—memiliki isomer optik: l dan d. Cara sederhana untuk mengidentifikasi isomeri ini dari gambaran dua dimensi adalah dengan "mendorong" atom H ke belakang pembaca (menjauhi pembaca). Jika searah putaran jarum jam (putaran ke kanan) terjadi urutan karboksil-residu-amina maka ini adalah tipe d. Jika urutan ini terjadi dengan arah putaran berlawanan jarum jam, maka itu adalah tipe l. (Aturan ini dikenal dalam bahasa Inggris dengan nama CORN, dari singkatan COOH - R - NH2). Pada umumnya, asam amino alami yang dihasilkan eukariota merupakan tipe l meskipun beberapa siput laut menghasilkan tipe d. Dinding sel bakteri banyak mengandung asam amino tipe d. Polimerisasi asam aminoLihat juga artikel tentang ekspresi genetik.  Protein merupakan polimer yang tersusun dari asam amino sebagai monomernya. Monomer-monomer ini tersambung dengan ikatan peptida, yang mengikat gugus karboksil milik satu monomer dengan gugus amina milik monomer di sebelahnya. Reaksi penyambungan ini (disebut translasi) secara alami terjadi di sitoplasma dengan bantuan ribosom dan tRNA. Pada polimerisasi asam amino, gugus -OH yang merupakan bagian gugus karboksil satu asam amino dan gugus -H yang merupakan bagian gugus amina asam amino lainnya akan terlepas dan membentuk air. Oleh sebab itu, reaksi ini termasuk dalam reaksi dehidrasi. Molekul asam amino yang telah melepaskan molekul air dikatakan disebut dalam bentuk residu asam amino. Zwitter-ion Karena asam amino memiliki gugus aktif amina dan karboksil sekaligus, zat ini dapat dianggap sebagai sekaligus asam dan basa (walaupun pH alaminya biasanya dipengaruhi oleh gugus-R yang dimiliki). Pada pH tertentu yang disebut titik isolistrik, gugus amina pada asam amino menjadi bermuatan positif (terprotonasi, –NH3+), sedangkan gugus karboksilnya menjadi bermuatan negatif (terdeprotonasi, –COO-). Titik isolistrik ini spesifik bergantung pada jenis asam aminonya. Dalam keadaan demikian, asam amino tersebut dikatakan berbentuk zwitter-ion. Zwitter-ion dapat diekstrak dari larutan asam amino sebagai struktur kristal putih yang bertitik lebur tinggi karena sifat dipolarnya. Kebanyakan asam amino bebas berada dalam bentuk zwitter-ion pada pH netral maupun pH fisiologis yang dekat netral. Karena mempunyai muatan negatif dan positif, asam amino dapat mengalami reaksi terhadap asam maupun basa.[18] Asam amino dasar (standar)Protein tersusun dari berbagai asam amino yang masing-masing dihubungkan dengan ikatan peptida. Meskipun demikian, pada awal pembentukannya protein hanya tersusun dari 20 asam amino yang dikenal sebagai asam amino dasar atau asam amino baku atau asam amino penyusun protein (proteinogenik). Asam-asam amino inilah yang disandi oleh DNA/RNA sebagai kode genetik. Berikut adalah ke-20 asam amino penyusun protein (singkatan dalam kurung menunjukkan singkatan tiga huruf dan satu huruf yang sering digunakan dalam kajian protein), dikelompokkan menurut sifat atau struktur kimiawinya: Asam amino alifatik sederhana
Asam amino hidroksi-alifatikAsam amino dikarboksilat (asam)
Amida
Asam amino basaAsam amino dengan sulfurProlin
Asam amino aromatik
Fungsi biologi asam amino
Asam amino esensialAsam amino diperlukan oleh makhluk hidup sebagai penyusun protein atau sebagai kerangka molekul-molekul penting. Ia disebut esensial bagi suatu spesies organisme apabila spesies tersebut memerlukannya tetapi tidak mampu memproduksi sendiri atau selalu kekurangan asam amino yang bersangkutan. Untuk memenuhi kebutuhan ini, spesies itu harus memasoknya dari luar (lewat makanan). Istilah "asam amino esensial" berlaku hanya bagi organisme heterotrof. Bagi manusia, ada delapan (ada yang menyebut sembilan) asam amino esensial yang harus dipenuhi dari diet sehari-hari, yaitu isoleusina, leusina, lisina, metionina, fenilalanina, treonina, triptofan, dan valina. Histidina dan arginina disebut sebagai "setengah esensial" karena tubuh manusia dewasa sehat mampu memenuhi kebutuhannya. Asam amino karnitina juga bersifat "setengah esensial" dan sering diberikan untuk kepentingan pengobatan. Lihat pula
Catatan
Referensi
Pranala luar
|