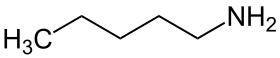
| 1-πενταναμίνη
|
|
| Γενικά
|
| Όνομα IUPAC |
1-πενταναμίνη
|
| Άλλες ονομασίες |
Πεντυλαμίνη
Μονοπεντυλαμίνη
Αμυλαμίνη
1-αμινοπεντάνιο
1-αζεξάνιο
|
| Χημικά αναγνωριστικά
|
| Χημικός τύπος |
C5H13N
|
| Μοριακή μάζα |
87,16 amu
|
Σύντομος
συντακτικός τύπος |
CH3CH2CH2CH2CH2NH2
|
| Συντομογραφίες |
BuCH2NH2
MPeA
|
| Αριθμός CAS |
110-58-7
|
| SMILES |
CCCCCN
|
| InChI |
1S/C5H13N/c1-2-3-4-5-6/h2-6H2,1H3
|
| Αριθμός EINECS |
203-780-2
|
| Αριθμός RTECS |
SC0300000
|
| Αριθμός UN |
1106
|
| PubChem CID |
8060
|
| ChemSpider ID |
7769
|
| Ισομέρεια
|
| Ισομερή θέσης |
17
|
| Φυσικές ιδιότητες
|
| Σημείο τήξης |
-55 °C
|
| Σημείο βρασμού |
94-110 °C
|
| Πυκνότητα |
752 kg/m3
|
Διαλυτότητα
στο νερό |
Αναμείξιμη
|
Δείκτης διάθλασης ,
nD |
1,411
|
| Εμφάνιση |
Υγρό
|
| Χημικές ιδιότητες
|
Ελάχιστη θερμοκρασία
ανάφλεξης |
1 °C
|
| Επικινδυνότητα
|
|
|
 
|
| Εύφλεκτη (F) και διαβρωτική (C).
|
| Φράσεις κινδύνου |
R11, R20/21/22, R34
|
| Φράσεις ασφαλείας |
S16, S26, S33, S36/37/39, S45
|
| LD50 |
470 mg/kg
|
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa).
|
Η 1-πενταναμίνη ή 1-αμινοπεντάνιο ή πεντυλαμίνη ή αμυλαμίνη ή μονοπεντυλαμίνη (ΜPeΑ: MonoPentylAmine) ή 1-αζεξάνιο είναι η πρωτοταγής αμίνη με σύντομο συντακτικό τύπο CH3CH2CH2CH2CH2NH2. Χρησιμοποιείται ως διαλύτης, ως μια πρώτη ύλη για την παραγωγή μιας ποικιλίας άλλων χημικών ενώσεων, που περιλαμβάνουν βερνίκια, γαλακτωματοποιητές, φαρμακευτικά προϊόντα[1], καθώς και ως ένα αρωματικό μέσο[2].
Ισομερή
Με βάση το χημικό της τύπο, C5H13N, έχει τα ακόλουθα 16 ισομερή θέσης:
- 2-πενταναμίνη ή 1-μεθυλοβουτυλαμίνη, με σύντομο συντακτικό τύπο CH3(CH2)2CH(ΝH2)CH3, σε δύο (2) οπτικά ισομερή.
- 3-πενταναμίνη ή (αιθυλοπροπυλ)αμίνη, με σύντομο συντακτικό τύπο (CH3CH2)2CHΝH2.
- 2-μεθυλο-1-βουταναμίνη ή 2-μεθυλοβουτυλαμίνη, με σύντομο συντακτικό τύπο CH3CH2CH(CH3)CH2ΝH2, σε δύο (2) οπτικά ισομερή.
- 3-μεθυλο-1-βουταναμίνη ή 3-μεθυλοβουτυλαμίνη, με σύντομο συντακτικό τύπο (CH3)2CH(CH2)2ΝH2.
- 2-μεθυλο-2-βουταναμίνη ή (1,1-διμεθυλοπροπυλ)αμίνη, με σύντομο συντακτικό τύπο CH3CH2C(ΝH2)(CH3)2.
- 3-μεθυλο-2-βουταναμίνη ή (1,2-διμεθυλοπροπυλ)αμίνη, με σύντομο συντακτικό τύπο (CH3)2CHCH(CH3)ΝH2, σε δύο (2) οπτικά ισομερή.
- διμεθυλοπροπαναμίνη ή νεοπεντυλαμίνη, με σύντομο συντακτικό τύπο (CH3)3CCH2ΝH2.
- N-μεθυλο-1-βουταναμίνη ή βουτυλομεθυλαμίνη, με σύντομο συντακτικό τύπο CH3(CH2)3ΝHCH3.
- N-μεθυλο-2-βουταναμίνη ή δευτεροταγής βουτυλομεθυλαμίνη, με σύντομο συντακτικό τύπο CH3CH2CH(CH3)ΝHCH3, σε δύο (2) οπτικά ισομερή.
- 2,N-διμεθυλο-1-προπαναμίνη ή ισοβουτυλομεθυλαμίνη, με σύντομο συντακτικό τύπο (CH3)2CHCH2ΝHCH3.
- 2,N-διμεθυλο-2-προπαναμίνη ή μεθυλοτριτοταγής βουτυλαμίνη, (CH3)3CΝHCH3.
- N-αιθυλο-1-προπαναμίνη ή αιθυλοπροπυλαμίνη, με σύντομο συντακτικό τύπο CH3(CH2)2ΝHCH2CH3.
- Ν-αιθυλο-2-προπαναμίνη ή αιθυλισοπροπυλαμίνη, με σύντομο συντακτικό τύπο (CH3)2CHΝHCH2CH3.
- N,N-διμεθυλο-1-προπαναμίνη ή διμεθυλοπροπυλαμίνη, με σύντομο συντακτικό τύπο CH3(CH2)2Ν(CH3)2.
- N,N-διμεθυλο-2-προπαναμίνη ή διμεθυλισοπροπυλαμίνη, με σύντομο συντακτικό τύπο (CH3)2CHΝ(CH3)2.
- Ν-αιθυλο-N-μεθυλαιθαναμίνη ή διαιθυλομεθυλαμίνη, με σύντομο συντακτικό τύπο (CH3CH2)2NCH3.
Ονοματολογία
Η ονομασία «1-πενταναμίνη» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «πεντα-» δηλώνει την παρουσία πέντε (5) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-αμίνη» φανερώνει ότι περιέχει μια αμινομάδα ως κύρια χαρακτηριστική ομάδα. Ο αριθμός θέσης «1-» δηλώνει τη θέση του ατόμου άνθρακα με το οποίο ενώνεται η αμινομάδα, ώστε να διαχωρίζονται τα ισομερή θέσης.
Δομή
Η δομή της μπορεί να βρεθεί αν αντικατασταθεί ένα άτομο υδρογόνου από ένα μόριο αμμωνίας με πεντύλιο.
| Δεσμοί[3]
|
| Δεσμός |
τύπος δεσμού |
ηλεκτρονική δομή |
Μήκος δεσμού |
Ιονισμός
|
| C-H |
σ |
2sp3-1s |
109 pm |
3% C- H+
|
| C-C |
σ |
2sp3-2sp3 |
154 pm |
|
| C-N |
σ |
2sp3-2sp3 |
152 pm |
6% C+ Ν-
|
| Ν-H |
σ |
2sp3-1s |
101,7 pm |
17% N- H+
|
Κατανομή φορτίων
σε ουδέτερο μόριο
|
| N |
-0,40
|
| C#5 |
-0,09
|
| C#2-#4 |
-0,06
|
| C#1 |
0,00
|
| H(CH2) |
+0,03
|
| H(NH2) |
+0,17
|
Παραγωγή
Με 1-πεντανόλη και χλωριούχο αμμώνιο
Η 1-πενταμίνη παράγεται συνήθως με επίδραση χλωριούχου αμμωνίου (NH4Cl) σε 1-πεντανόλη (CH3CH2CH2CH2CH2OH) με την παρουσία τριχλωριούχου σιδήρου ως καταλύτη[4]:
![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}OH+NH_{4}Cl{\xrightarrow[{-H_{2}O}]{FeCl_{3}}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{3}Cl{\xrightarrow {NaOH}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{2}+NaCl+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/42767160e1e7e42ead0b02669af61811aff7b529)
Με χλωριούχο αμμώνιο και πεντανάλη
Με επίδραση χλωριούχου αμμωνίου (NH4Cl) σε πεντανάλη (CH3CH2CH2CH2CHO) παράγεται αρχικά υδροχλωρική 1-πεντανιμίνη (CH3CH2CH2CH2CH=NH2Cl) και έπειτα υδροχλωρική 1-πενταναμίνη. Η τελευταία με υδροξείδιο του νατρίου (NaOH) δείνει καθαρή 1-πενταναμίνη[4]:
![{\displaystyle \mathrm {NH_{4}Cl+CH_{3}CH_{2}CH_{2}CH_{2}CHO{\xrightarrow {}}CH_{3}CH_{2}CH_{2}CH_{2}CH=NH_{2}Cl+H_{2}O{\xrightarrow[{-CH_{3}CH_{2}CH_{2}CH_{2}COOH}]{+CH_{3}CH_{2}CH_{2}CH_{2}CHO}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{3}Cl{\xrightarrow {+NaOH}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{2}+NaCl+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/296b3d4c6b6c16b4113489ed280e6e8cf7e36502)
- Μια παραλλαγή της παραπάνω είναι η επίδραση αμμωνίας σε πεντνάλη, που δίνει 1-πεντανιμίνη, και στη συνέχεια υδρογόνωση της τελευταίας, 1-πενταναμίνη:

Με αμμωνία και πεντυλαλογονίδιο
Με επίδραση αμμωνίας (NH3) σε πεντυλαλογονίδιο (CH3CH2CH2CH2CH2X, μέθοδος Hofmann)[5]:

Με πεντυλίωση φθαλιμιδικού καλίου
Με πεντυλίωση φθαλιμιδικού καλίου (σύνθεση Gabriel)[6]:
Με αναγωγή αζωτούχων ενώσεων
1. Με αναγωγή 1-νιτροπεντανίου (CH3CH2CH2CH2CH2NO2)[7]:

2. Με αναγωγή πεντανονιτρίλιου (CH3CH2CH2CH2CN)[8]

3. Με αναγωγή 1-πεντανιμίνης (CH3CH2CH2CH2CH=NH)[9]:

Με αποικοδόμηση εξαναμιδίου
Με αποικοδόμηση εξαναμιδίου (CH3CH2CH2CH2CH2CONH2, μετάθεση Hofmann)[10]:

- Το BrOK παράγεται επιτόπου («in citu») με την αντίδραση:

Με χλωραμίνη σε πεντυλομαγνησιοαλογονίδιο
Με επίδραση χλωραμίνης (NH2Cl) σε πεντυλομαγνησιοαλογονίδιο (CH3CH2CH2CH2CH2MgX)[11]:

Με κυκλοπροσθήκη αμμωνίας σε αιθυλοκυκλοπροπάνιο
Με κυκλοπροσθήκη αμμωνίας (NH3) σε αιθυλοκυκλοπροπάνιο , παράγεται 1-πενταναμίνη[12]:


Με κυκλοπροσθήκη αμμωνίας σε μεθυλοκυκλοβουτάνιο
Με κυκλοπροσθήκη αμμωνίας (NH3) σε μεθυλοκυκλοβουτάνιο, παράγεται 1-πενταναμίνη[12]:


Με κυκλοπροσθήκη υδρογόνου αε 2-αιθυλοκυκλοπροπαναμίνη
Με κυκλοπροσθήκη υδρογόνου (H2) σε 2-αιθυλοκυκλοπροπαναμίνη, παράγεται 1-πενταναμίνη[12]:
![{\displaystyle \mathrm {CH_{3}CH_{2}(CH_{2}CH_{2}CH(NH_{2})]+H_{2}{\xrightarrow {Pt}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/d7f275809ee720e236ebac09bbc6bb01e7776c38)
Με κυκλοπροσθήκη υδρογόνου αε 2-μεθυλοκυκλοβουταναμίνη
Με κυκλοπροσθήκη υδρογόνου (H2) σε 2-μεθυλοκυκλοβουταναμίνη, παράγεται 1-πενταναμίνη[12]:
![{\displaystyle \mathrm {CH_{3}(CH_{2}CH_{2}CH_{2}CH(NH_{2})]+H_{2}{\xrightarrow {Pt}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e9b82ba4d20cd233279f054d2b63313a5e92034)
Με κυκλοπροσθήκη υδρογόνου αε 2-προπυλαζιριδίνη
Με κυκλοπροσθήκη υδρογόνου (H2) σε 2-προπυλαζιριδίνη, παράγεται 1-πενταναμίνη[12]:

Με κυκλοπροσθήκη υδρογόνου αε 2-αιθυλαζετιδίνη
Με κυκλοπροσθήκη υδρογόνου (H2) σε 2-αιθυλαζετιδίνη, παράγεται 1-πενταναμίνη[12]:

Χημικές ιδιότητες και παράγωγα
Συμπεριφορά βάσης
Παράγει άλατα με οξέα. Π.χ.:

Αλκυλίωση
Αντιδρά με αλκυλαλογονίδια (RX), παράγοντας δευτεροταγείς αμίνες:

Ακυλίωση
Αντιδρά με ακυλαλογονίδια (RCOX), παράγοντας δευτεροταγή αμίδια:

Ιμίνες
Με καρβονυλικές ενώσεις δίνει ιμίνες. Π.χ. με αλδεΰδες (RCHO):

Οξείδωση
Οξείδώνεται με υπεροξείδιο του υδρογόνου (H2O2) παράγοντας 1-νιτροπεντάνιο:

Προσθήκη
1. Προσθήκη σε διπλούς δεσμούς. Π.χ. με αιθένιο δίνει N-αιθυλο-1-πενταναμίνη:

2. Προσθήκη σε τριπλούς δεσμούς.. Π.χ. με αιθίνιο δίνει αρχικά N-πεντυλαιθεναμίνη, και στη συνέχεια την ταυτομερή της N-πεντυλαιθανιμίνη:

3. Προσθήκη σε συζυγείς διπλούς δεσμούς. Π.χ. με 1,3-βουταδιένιο δίνει N-πεντυλο-1-βουτεν-2-αμίνη:

4. Κυκλοπροσθήκη σε ενώσεις με τριμελείς ή τετραμελείς ισοκυκλικούς δακτυλίους. Π.χ. με κυκλοπροπάνιο δίνει Ν-προπυλο-1-πενταναμίνη:


5. Κυκλοπροσθήκη σε ενώσεις με τριμελείς ή τετραμελείς ετεροκυκλικούς δακτυλίους. Π.χ. με εποξυαιθάνιο δίνει 2-πεντυλαμιναιθανόλη[13]:


Παρεμβολή καρβενίων
- Τα καρβένια μπορούν παρεμβληθούν στους δεσμούς C-Η και N-H. Π.χ. με μεθυλένιο έχουμε[14]:

- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- 1. Παρεμβολή στους τρεις (3) δεσμούς CH2-H. Παράγεται 1-εξαναμίνη.
- 2. Παρεμβολή στους δυο (2) δεσμούς C#1H-H. Παράγεται 2-εξαναμίνη.
- 3. Παρεμβολή στους δυο (2) δεσμούς C#2H-H. Παράγεται 2-μεθυλο-1-πενταναμίνη.
- 4. Παρεμβολή στους δυο (2) δεσμούς C#3H-H. Παράγεται 3-μεθυλο-1-πενταναμίνη.
- 5. Παρεμβολή στους δυο (2) δεσμούς C#4H-H. Παράγεται 4-μεθυλο-1-πενταναμίνη.
- 6. Παρεμβολή στους δυο (2) δεσμούς ΝH-H: 2. Παράγεται N-μεθυλο-1-πενταναμίνη.
Προκύπτει επομένως μίγμα 1-εξαναμίνης ~23%, 2-εξαναμίνης ~15%, 2-μεθυλο-1-πενταναμίνης ~15, 3-μεθυλο-1-πενταναμίνης ~15%%, 4-μεθυλο-1-πενταναμίνης ~15% και Ν-μεθυλο-1-πενταναμίνης ~15%.
Σημειώσεις και αναφορές
- ↑ Flick, Ernest W. (1998). Industrial Solvents Handbook (5th ed. έκδοση). Park Ridge, NJ: William Andrew. σελ. 695. ISBN 0-8155-1413-1. CS1 maint: Extra text (link)
- ↑ "JECFA Evaluations-PENTYLAMINE. Summary of Evaluations Performed by the Joint FAO/WHO Expert Committee on Food Additives" (January 31, 2006). Retrieved on 2008-07-25
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34. Οι ηλεκτραρνητικότητες κατά Pauling, από τις οποίες υπολογίστηκε ο ιονισμός, προέρχονται από τους πίνακες δεδομένων των χημικών στοιχείων άνθρακας, υδρογόνο, οξυγόνο και άζωτο.
- ↑ 4,0 4,1 Marvel, C. S.; Jenkins, R. L. (1941), «Methylamine Hydrochloride», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv1p0347 ; Coll. Vol. 1: 347
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B2α και σελ. 247, §10.6.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B2γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B2δ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Γ3.
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 Ulrich Steinbrenner, Frank Funke, Ralf Böhling, Method and device for producing ethylamine and butylamine Αρχειοθετήθηκε 2012-09-12 at Archive.is, United States Patent 7161039.
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 16-17, εφαρμογή γενικής αντίδρασης για Nu = CH3CH2CH2CH2CH2NH.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
Πηγές
- SCHAUM'S OUTLINE SERIES, «ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ», Μτφ. Α. Βάρβογλη, 1999
- «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982
- Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991
- Καραγκιοζίδη Σ. Πολυχρόνη, «Ονοματολογία Οργανικών Ενώσεων στα Ελληνικά & Αγγλικά» Β΄ ΈκδοσηΘεσσαλονίκη 1991
- Νικολάου Ε. Αλεξάνδρου, «Γενική Οργανική Χημεία», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
- Δημητρίου Ν. Νικολαΐδη, «Ειδικά Μαθήματα Οργανικής Χημείας», ΑΠΘ, θεσσαλονίκη 1983
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Φαίδωνα Χατζημηχαλάκη, «Εργαστηριακός Οδηγός», Εκδόσεις Ζήτη, Θεσσαλονίκη 1986
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Δημητρίου Ν. Νικολαΐδη: «Χημεία Ετεροκυκλικών Ενώσεων», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
|
|---|
| Ανόργανες αμίνες | |
|---|
| Αλκαναμίνες | |
|---|
| Αλκεναμίνες | |
|---|
| Ισοκυκλικές κυκλοαλκαναμίνες | |
|---|
| Αλκανοτριαμίνες | |
|---|
| Αρωματικές αμίνες | |
|---|
| Ετεροκυκλικές αμίνες | |
|---|
| Ετεροαρωματικές αμίνες | |
|---|
| Οργανικές αλαμίνες | |
|---|
| Οργανικές υδροξυλαμίνες | |
|---|
| Κυαναμίδια | |
|---|



![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}OH+NH_{4}Cl{\xrightarrow[{-H_{2}O}]{FeCl_{3}}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{3}Cl{\xrightarrow {NaOH}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{2}+NaCl+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/42767160e1e7e42ead0b02669af61811aff7b529)
![{\displaystyle \mathrm {NH_{4}Cl+CH_{3}CH_{2}CH_{2}CH_{2}CHO{\xrightarrow {}}CH_{3}CH_{2}CH_{2}CH_{2}CH=NH_{2}Cl+H_{2}O{\xrightarrow[{-CH_{3}CH_{2}CH_{2}CH_{2}COOH}]{+CH_{3}CH_{2}CH_{2}CH_{2}CHO}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{3}Cl{\xrightarrow {+NaOH}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{2}+NaCl+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/296b3d4c6b6c16b4113489ed280e6e8cf7e36502)



![{\displaystyle \mathrm {+CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}X{\xrightarrow[{+2H_{2}O}]{H^{+}}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{2}+} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9da814096d3d9315b5552468e2034faeadeba3ab)








![{\displaystyle \mathrm {CH_{3}CH_{2}(CH_{2}CH_{2}CH(NH_{2})]+H_{2}{\xrightarrow {Pt}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/d7f275809ee720e236ebac09bbc6bb01e7776c38)
![{\displaystyle \mathrm {CH_{3}(CH_{2}CH_{2}CH_{2}CH(NH_{2})]+H_{2}{\xrightarrow {Pt}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}NH_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e9b82ba4d20cd233279f054d2b63313a5e92034)












