|
Stadio cineticamente determinanteIn cinetica chimica, lo stadio cineticamente determinante (o stadio cineticamente limitante o stadio cineticamente controllante o, in inglese, rate determining step)[1] corrisponde allo stadio del meccanismo di una reazione chimica che avviene più lentamente rispetto agli altri stadi, e determina la velocità della reazione stessa.[2][3] Analogia tra le reazioni multistadio e le catene di montaggioLe reazioni chimiche che coinvolgono più reazioni elementari possono essere paragonate a delle catene di montaggio (ad esempio una catena di montaggio per la realizzazione di un'automobile). Ogni reazione elementare, in cui è suddivisa la reazione globale, è analoga ad una singola fase della catena di montaggio. Analogamente, lo stadio cineticamente determinante può essere paragonato alla fase più lenta della catena di montaggio. La velocità con cui viene realizzato il prodotto in una catena di montaggio dipende dalla velocità della fase più lenta, la quale rallenta l'intera produzione. Allo stesso modo, la velocità della reazione globale dipende dalla velocità dello stadio cineticamente determinante. Individuazione dello stadio cineticamente determinante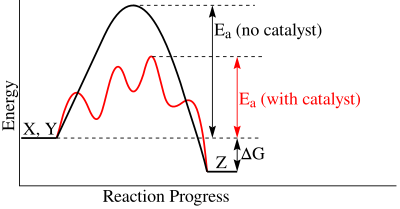 In un diagramma "coordinata di reazione-energia", lo stadio cineticamente determinante corrisponde allo stadio caratterizzato dalla maggiore energia di attivazione (il secondo per la reazione catalizzata in figura). Alcuni esempi di stadio cineticamente determinante sono:
Il concetto di "stadio cineticamente determinante" si utilizza anche in biochimica e in elettrochimica. Controllo di una reazione chimicaSi dice che una reazione chimica è sotto controllo termodinamico se le concentrazioni dei prodotti di una reazione corrispondono a quelle che si avrebbero in condizioni di equilibrio, mentre si dice che la reazione è sotto controllo cinetico se si hanno più reazioni competitive con velocità di reazione differenti per cui la concentrazione dei prodotti dipende dalla cinetica di tali reazioni.[4] Nel caso in cui si abbia controllo cinetico, la velocità di reazione dipende dallo stadio cineticamente determinante,[1] per cui si dice che lo stadio cineticamente determinante "controlla" la reazione chimica in questione. Quando un processo è controllato cineticamente da più stadi (per cui non c'è un singolo stadio cineticamente determinante), si dice che tale processo è sotto controllo misto. EsempioSi consideri la seguente reazione chimica: Il meccanismo di tale reazione coinvolge le seguenti reazioni elementari:
In questo caso lo stadio cineticamente determinante è il primo, in quanto avviene più lentamente. Controllo di un processo elettrochimicoI processi elettrochimici coinvolgono reazioni redox che avvengono all'interfaccia elettrodo-elettrolita; gli stadi coinvolti in un processo elettrochimico sono:[5][6]
A ciascuno di questi stadi è associata una sovratensione, cioè una variazione del potenziale di cella rispetto alle condizioni di equilibrio. In particolare si ha:
Allo stadio cineticamente determinante è associata la sovratensione più elevata. Note
Bibliografia
Voci correlateInformation related to Stadio cineticamente determinante |


