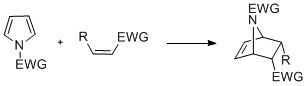ピロール(PyrroleまたはPyrrol)は、分子式 C4H5N、分子量 67.09
の五員環構造を持つ複素環式芳香族化合物のアミンの一種である。二重結合の位置が違う異性体に2H-ピロールと3H-ピロールがある。分子内にピロールを部分構造として含む化合物において、この構造をピロール環と呼ぶ。
歴史
ピロールは1834年にルンゲによってコールタールの成分として初めて検出され、1857年には骨の熱分解物から単離された[3]。その名前は塩酸で湿らせた木材にピロールをつけると赤色を呈することから、ギリシャ語のpyrrhos ( πυρρός 「赤みがかった、燃えるような」) に由来する[4]。
性質
果実様の特異臭を有する薄黄色透明の液体で、水に溶けにくく有機溶媒に溶ける。濃塩酸などとの反応により重合する。
ピロールの窒素原子はsp2混成軌道であり,窒素原子のもつ孤立電子対までもが環全体に非局在化されているため芳香族性を示す。その芳香族性は同じ6π電子系のフランより高くチオフェンと同程度であるが、ベンゼンよりは低いため塩基性はアミンやピリジンに比べてはるかに低い(pKb=13.6)。これは窒素原子上へのプロトンの付加が起こると芳香族性が崩れるためである。その代わり、アニオンの共鳴安定性により酸性度は高い(pKa=16.5)[5]。
合成法
工業的製法として、ピロールは二酸化ケイ素や酸化アルミニウムなどの固体酸触媒の存在下でフランをアンモニアで処理することによって製造される。
 Synthesis of pyrrole from furan
Synthesis of pyrrole from furan
実験室的製法
パール・クノールピロール合成
1,4-ジカルボニル化合物とアンモニアまたは第一級アミンと反応させることで置換ピロールを形成する[6]。
 The Paal–Knorr pyrrole synthesis
The Paal–Knorr pyrrole synthesis
この反応では片方のカルボニル基にアミンが縮合してイミンになった後,エナミンに互変異することでもう片方のカルボニル基と縮合して生成物を得る。また,アミンを添加しなかった場合,フランが生成する[5]。
クノールピロール合成
α-アミノケトンまたはα-アミノ-β-ケトエステルと活性メチレン化合物との反応である[7][8]。
 The Knorr pyrrole synthesis
The Knorr pyrrole synthesis
この方法は、α-アミノケトン(1)のカルボニル基と(2)のメチレン基、及び(1)のアミノ基と(2)のα位のカルボニル基がそれぞれ縮合することで生成物を得る。
ハンチピロール合成
β-ケトエステル(1)とアンモニア(または第一級アミン)およびα-ハロケトン(2)を反応させて置換ピロール(3)を得る方法[9]。
 The Hantzsch pyrrole synthesis
The Hantzsch pyrrole synthesis
野依によるピロール合成法
水酸化ナトリウムまたは遷移金属などを触媒として、2-アミノエタノールとカルボニル化合物を反応させることでピロールを得る、野依良治らによる方法[10]。
その他
上記の他にも、アルキンとイソニトリルとの反応[11]や、粘液酸アンモニウムの分解によっても生じる(図)[12]。
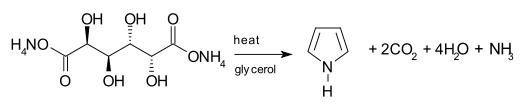 Synthesis of pyrrole from ammonium mucate
Synthesis of pyrrole from ammonium mucate
反応
ピロールは芳香族性を示すため、オレフィンとしての性質は示しにくい一方、求電子置換反応は起こりやすい。
求電子置換反応
ピロールは中間体の共鳴安定性(図)から2位または5位の炭素にて求電子置換反応が起こりやすい[5]。
 Pyrrole electrophilic substitution
Pyrrole electrophilic substitution
しかし、先述の通り、重合反応が起こる可能性もある。
ディールス・アルダー反応
N-アルキルピロールは電子供与基であるアミノ基を持つジエンであり、ディールス・アルダー反応でジエノフィルとしての役割を担う。しかし芳香族性の高さから当該反応はフランに比べ起こりにくい[5]。
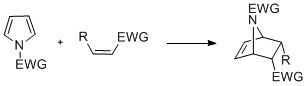 Pyrrole DA
Pyrrole DA
この反応を応用してインフルエンザの治療に使われるタミフルの製造にも用いられる[13]。
その他の反応
ピロールの酸性度の高さから水素化ナトリウムなどの強塩基によって脱プロトン化することができ、求核試薬として使用できる[5]。
クロロホルムの塩基処理によって得られたジクロロカルベンとの反応では、環拡大が起こり、3-クロロピリジン(英語版)が得られる[14]。
生体内での存在
ピロール自体は天然に見られないが、ピロールを含む化合物は多く見られる。ピロール環4個が炭素原子1個ずつをはさんで結合した環(テトラピロール環と総称する)には、ヘム(ヘモグロビンやシトクロムに含まれる)のポルフィリン環、クロロフィルのクロリン環、ビタミンB12のコリン環などがある(多くは内部に金属をキレートしている)。またビリルビンやフィコビリン(光合成色素であるフィコシアニン、フィコエリスリンなどの発色団)はピロール環が4個直列した構造(開環テトラピロール)を持っている。これらテトラピロール化合物は生体内物質に多く、また二重結合が多数共役しているため可視光を吸収し特有の色を示すものが多い。
生合成
ピロール環の生合成は、グリシンとスクシニルCoAから合成されるアミノレブリン酸(ALA)から開始される。ALA脱水酵素は、クノール型環合成を介して2つのALA分子の縮合を触媒し、ポルフォビリノーゲン(PBG)を形成する。複数のポルフォビリノーゲンが縮合することで大員環のヘムやクロロフィルなどを形成する[15]。
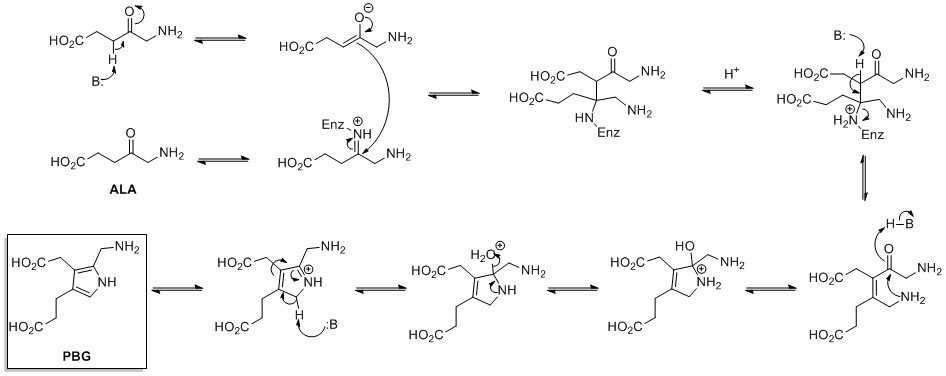 Mechanism of biosynthesis of porphobilinogen
Mechanism of biosynthesis of porphobilinogen
ポリピロール
多数のピロール環を結合した合成化合物ポリピロールは導電性を示し合成有機金属や有機半導体の材料ともなる[16]。
ポリピロールは直鎖アルキルベンゼンスルホン酸ナトリウムの一種であるドデシルベンゼンスルホン酸ナトリウム(中国語版)を添加したピロール水溶液のステンレス電極による電解重合によって陰極に得られる。この時、ドデジルベンゼンスルホン酸ナトリウムには電解液としての働きと、ポリピロールに電導性を付与するドーピング剤としての2つの役割がある(なお、この時ドーピングされるのはアニオンであるドデジルベンゼンスルホン酸イオンである)。ポリピロール自体は鉄塩などの酸化剤によるピロールの化学的酸化でも得られるが、自立したポリマーフィルムとして得るには、電気化学的酸化による不活性電極下による電解重合による方法しかない[要出典]。
出典
- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. pp. 141. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4
- ^ William M. Haynes (2016). CRC Handbook of Chemistry and Physics (97th ed.). Boca Raton: CRC Press. pp. 3–478. ISBN 978-1-4987-5429-3
- ^ Runge, F. F. (1834). “Ueber einige Produkte der Steinkohlendestillation [On some products of coal distillation]”. Annalen der Physik und Chemie 31 (5): 65–78. Bibcode: 1834AnP...107...65R. doi:10.1002/andp.18341070502. http://babel.hathitrust.org/cgi/pt?id=wu.89048351654;view=1up;seq=81.
 See especially pages 67–68, where Runge names the compound Pyrrol (fire oil) or Rothöl (red oil).
See especially pages 67–68, where Runge names the compound Pyrrol (fire oil) or Rothöl (red oil).
- ^ Harreus, Albrecht Ludwig (2005), "Pyrrole", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_453。
- ^ a b c d e K.P.C.Vollhardt、N.E.Schore 著、大嶌幸一郎 訳「25章-ヘテロ環化合物」『Organic Chemistry Structure and Function』(8版)化学同人、2020年。ISBN 978-4-7598-2030-0。
- ^ Paal, C. (1884), “Ueber die Derivate des Acetophenonacetessigesters und des Acetonylacetessigesters”, Berichte der Deutschen Chemischen Gesellschaft 17 (2): 2756–2767, doi:10.1002/cber.188401702228, https://babel.hathitrust.org/cgi/pt?id=uc1.b3481769;view=1up;seq=1188

- ^ Knorr, Ludwig (1884). “Synthese von Pyrrolderivaten [Synthesis of pyrrole derivatives]”. Berichte der Deutschen Chemischen Gesellschaft 17 (2): 1635–1642. doi:10.1002/cber.18840170220. https://babel.hathitrust.org/cgi/pt?id=uc1.b3481769;view=1up;seq=65.

- ^ Knorr, L. (1886). “Synthetische Versuche mit dem Acetessigester [Synthesis experiments with the [ethyl ester of acetoacetic acid]”]. Annalen der Chemie 236 (3): 290–332. doi:10.1002/jlac.18862360303. https://babel.hathitrust.org/cgi/pt?id=hvd.hx3kie;view=1up;seq=702.

- ^ Hantzsch, A. (1890). “Neue Bildungsweise von Pyrrolderivaten [New methods of forming pyrrole derivatives]”. Berichte der Deutschen Chemischen Gesellschaft 23: 1474–1476. doi:10.1002/cber.189002301243. https://babel.hathitrust.org/cgi/pt?id=uc1.b3481786;view=1up;seq=1484.

- ^ 野依良治、斎藤進 公開特許公報 特開-2011184338A
[1]
- ^ “新しい多置換ピロールの簡単合成法を開発: 医薬品などの短段階で高収率な合成に貢献”. 国立大学法人 東京農工大学. 2025年1月5日閲覧。
- ^ Vogel (1956). Practical Organic Chemistry. p. 837. http://www.sciencemadness.org/library/books/vogel_practical_ochem_3.pdf
- ^ “ピロールへのDiels-Alder反応を用いたタミフルの新規合成法”. 2025年1月4日閲覧。
- ^ Ciamician, G. L.; Dennstedt, M. (1881). “Ueber die Einwirkung des Chloroforms auf die Kaliumverbindung Pyrrols [On the reaction of chloroform with the potassium compound of pyrrole]”. Berichte der Deutschen Chemischen Gesellschaft 14: 1153–1162. doi:10.1002/cber.188101401240. https://babel.hathitrust.org/cgi/pt?id=hvd.cl1hza;view=1up;seq=1223.
- ^ Walsh, Christopher T.; Garneau-Tsodikova, Sylvie; Howard-Jones, Annaleise R. (2006). “Biological formation of pyrroles: Nature's logic and enzymatic machinery”. Natural Product Reports 23 (4): 517–531. doi:10.1039/b605245m. PMID 16874387.
- ^ Vernitskaya, Tat'Yana V.; Efimov, Oleg N. (1997). “Polypyrrole: a conducting polymer; its synthesis, properties and applications”. Russ. Chem. Rev. 66 (5): 443–457. Bibcode: 1997RuCRv..66..443V. doi:10.1070/rc1997v066n05abeh000261.
関連項目
|
|---|
| 単環 |
|
|---|
| 二環 |
| 五員環+五員環 | |
|---|
| 五員環+六員環 | |
|---|
| 六員環+六員環 | |
|---|
| 五員環+七員環 | |
|---|
|
|---|