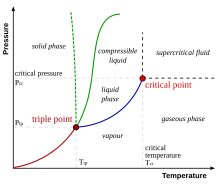
 แผนภาพเฟสทั่วไปเส้นสีเขียวทึบใช้กับสารส่วนใหญ่ ส่วนเส้นประสีเขียวแสดงถึงพฤติกรรมผิดปกติของน้ำ
แผนภาพเฟสทั่วไปเส้นสีเขียวทึบใช้กับสารส่วนใหญ่ ส่วนเส้นประสีเขียวแสดงถึงพฤติกรรมผิดปกติของน้ำ
จุดร่วมสาม (Triple point) ในอุณหพลศาสตร์ คืออุณหภูมิและความดันที่พอดีที่ทำให้สารสามารถอยู่ในสถานะทั้งของแข็ง ของเหลว และแก๊ส พร้อมกันได้อย่างสมดุล[1]คืออุณหภูมิและความดันที่เส้นโค้งการระเหิด, การหลอมเหลว, และการกลายเป็นไอมาบรรจบกัน ยกตัวอย่างเช่น จุดร่วมสามของปรอทเกิดขึ้นที่อุณหภูมิ −38.8 องศาเซลเซียส (หรือ −37.8 องศาฟาเรนไฮต์) และความดัน 0.165 มิลลิปาสกาล
นอกจากจุดร่วมสามที่สารสามารถอยู่ในสถานะของแข็ง ของเหลว และแก๊สพร้อมกันแล้ว สารบางชนิดที่มีรูปผลึกหลายแบบ (พอลิมอร์ฟ) ยังสามารถมีจุดร่วมสามที่เกี่ยวข้องกับสถานะของแข็งมากกว่าหนึ่งสถานะได้อีกด้วย เช่น ฮีเลียม-4 ที่เป็นกรณีที่ไม่มีเส้นกราฟการระเหิด/การตกผลึก และดังนั้นจึงไม่มีจุดร่วมสามที่สถานะของแข็งตัดกับสถานะแก๊ส แต่จะมีจุดร่วมสามที่เป็นจุดที่เส้นกราฟของของเหลว-ซูเปอร์ฟลูอิด สถานะของแข็ง-ของเหลว-ซูเปอร์ฟลูอิด และจุดที่เส้นกราฟของสถานะของแข็ง-ของแข็ง-ของเหลวตัดกัน ทั้งนี้ต้องไม่สับสนกับ จุดแลมบ์ดา ซึ่งไม่ใช่จุดร่วมสามในทางใดทางหนึ่ง
คำว่า "จุดร่วมสาม" ถูกบัญญัติขึ้นในปี ค.ศ. 1873 โดย เจมส์ ทอมสัน พี่ชายของ วิลเลียม ทอมสัน บารอนเคลวินที่ 1[2] จุดร่วมสามของสารหลายชนิดถูกใช้เพื่อกำหนดจุดต่าง ๆ ใน ITS-90 สเกลอุณหภูมิสากล, ซึ่งมีตั้งแต่จุดร่วมสามของไฮโดรเจน (13.8033 K) จนถึงจุดร่วมสามของน้ำ (273.16 K, 0.01 °C, หรือ 32.018 °F).
ก่อนปี ค.ศ. 2019 จุดร่วมสามของ น้ำ ถูกใช้เพื่อกำหนดนิยามของ เคลวิน หน่วยฐานของ ระบบหน่วยวัดระหว่างประเทศ (SI) ที่ใช้อุณหพลศาสตร์[3] เคลวินถูกกำหนดให้นิยามในลักษณะที่ทำให้จุดร่วมสามของน้ำมีค่าเท่ากับ 273.16 K แต่สิ่งนี้เปลี่ยนแปลงไปตาม การปรับนิยามหน่วยฐาน SI ปี 2019 ซึ่งเคลวินถูกกำหนดให้นิยามใหม่เพื่อให้ ค่าคงตัวบ็อลทซ์มัน มีค่าเท่ากับ 1.380649×10−23 J⋅K−1 และจุดร่วมสามของน้ำกลายเป็นค่าคงที่ที่ต้องวัดผ่านการทดลอง
จุดร่วมสามของน้ำ
 น้ำเดือดที่ 0°C โดยใช้ปั๊มสุญญากาศ
น้ำเดือดที่ 0°C โดยใช้ปั๊มสุญญากาศ
จากการกำหนดนิยามหน่วยฐาน SI ใหม่ในปี 2019 ค่าอุณหภูมิของจุดสามสถานะของน้ำไม่ได้ถูกใช้เป็นจุดอ้างอิงอีกต่อไป แต่ค่ายังมีความสำคัญในทางปฏิบัติ: การผสมผสานที่ไม่ซ้ำกันของความดันและอุณหภูมิที่ น้ำ ของเหลว น้ำแข็ง แข็ง และ ไอน้ำ อยู่ร่วมกันในภาวะสมดุลคงที่อยู่ที่ประมาณ 273.16±0.0001 K [4] และความดันไอ 611.657 ปาสกาล (6.11657 มิลลิบาร์; 0.00603659 บรรยากาศมาตรฐาน) [5] [6]
น้ำเหลวสามารถมีอยู่ได้ภายใต้ความดันที่เท่ากับหรือมากกว่าจุดสามเท่าเท่านั้น ด้านล่างนี้ ในสุญญากาศของ อวกาศ น้ำแข็งแข็ง จะระเหิด กลายเป็นไอน้ำโดยตรงเมื่อได้รับความร้อนที่ความดันคงที่ ในทางกลับกัน เหนือจุดสามประการ น้ำแข็งแข็งจะละลายเป็นน้ำของเหลวก่อนเมื่อได้รับความร้อนที่ความดันคงที่ จากนั้นระเหยหรือเดือดกลายเป็นไอที่อุณหภูมิสูงกว่า
สำหรับสารส่วนใหญ่ จุดสามสถานะคืออุณหภูมิต่ำสุดที่ของเหลวสามารถดำรงอยู่ได้ สำหรับน้ำนี่ไม่ใช่กรณี จุดหลอมเหลวของน้ำแข็งธรรมดาจะลดลงตามความดัน ดังที่แสดงด้วยเส้นประสีเขียวใน แผนภาพ เฟส ตรงด้านล่างจุดร่วมสาม การบีบอัดที่อุณหภูมิคงที่จะเปลี่ยนไอน้ำเป็นของ แข็ง ก่อน จากนั้นจึงเป็นของ เหลว
ในอดีต ในระหว่างภารกิจ มาริเนอร์ 9 ไปยัง ดาวอังคาร แรงดันน้ำสามจุดถูกนำมาใช้เพื่อกำหนด "ระดับน้ำทะเล" ปัจจุบัน การวัด ระยะสูงด้วยเลเซอร์ และแรงโน้มถ่วงเป็นที่นิยมในการกำหนดระดับความสูงของดาวอังคาร [7]
เฟสแรงดันสูง
ที่ความดันสูง น้ำจะมี แผนภาพเฟสที่ ซับซ้อนซึ่งประกอบด้วย เฟสของน้ำแข็ง ที่รู้จัก 15 เฟส และจุดสามสถานะหลายจุด รวมทั้ง 10 เฟสที่มีพิกัดแสดงไว้ในแผนภาพ เช่น จุดร่วมสามที่ 251 เค (−22 °C) และ 210 เมกะปาสกาล (2070 atm) สอดคล้องกับเงื่อนไขการอยู่ร่วมกันของ น้ำแข็ง Ih (น้ำแข็งธรรมดา) น้ำแข็ง III และน้ำของเหลว ทั้งหมดอยู่ในภาวะสมดุล ยังมีจุดร่วมสามสำหรับการอยู่ร่วมกันของเฟสของแข็งทั้งสาม เช่น น้ำแข็ง II น้ำแข็ง V และน้ำแข็ง VI ที่ 218 เค (−55 °C) และ 620 เมกะปาสกาล (6120 ATM).
สำหรับน้ำแข็งที่มีแรงดันสูงซึ่งสามารถคงอยู่ในภาวะสมดุลกับของเหลวได้ แผนภาพแสดงให้เห็นว่าจุดหลอมเหลวจะเพิ่มขึ้นตามความดัน ที่อุณหภูมิสูงกว่า 273 เค (0 °C) ทำให้แรงดันไอน้ำเพิ่มขึ้น จนทำให้เกิดน้ำเหลวก่อน จากนั้นจึงเป็นน้ำแข็งที่มีแรงดันสูงในที่สุด ในช่วง 251–273 K น้ำแข็ง I จะก่อตัวก่อน ตามด้วยน้ำของเหลว แล้วจึงตามด้วยน้ำแข็ง III หรือน้ำแข็ง V และตามด้วยรูปแบบอื่น ๆ ที่มีแรงดันสูงและหนาแน่นกว่า
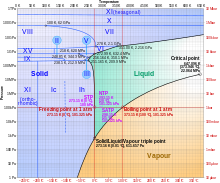 ไดอะแกรมเฟสของน้ำที่รวมรูปแบบแรงดันสูง เช่น น้ำแข็ง II น้ำแข็ง III เป็นต้น แกนความดันเป็นลอการิทึม สำหรับคำอธิบายโดยละเอียดของเฟสเหล่านี้ โปรดดูที่ น้ำแข็ง
ไดอะแกรมเฟสของน้ำที่รวมรูปแบบแรงดันสูง เช่น น้ำแข็ง II น้ำแข็ง III เป็นต้น แกนความดันเป็นลอการิทึม สำหรับคำอธิบายโดยละเอียดของเฟสเหล่านี้ โปรดดูที่ น้ำแข็ง
จุดสามประการของน้ำ
| เฟสที่อยู่ในภาวะสมดุลคงที่
|
ความดัน
|
อุณหภูมิ
|
| น้ำเหลว, น้ำเข็ง Ih, และไอน้ำ
|
611.657 ปาสกาล [8]
|
273.16 กิโล (0.01 องศาเซลเซียส)
|
| น้ำเหลว น้ำแข็ง I และ น้ำแข็ง III
|
209.9 เมกะปาสกาล
|
251 กิโล (−22 องศาเซลเซียส)
|
| น้ำเหลว น้ำแข็ง III และ น้ำแข็ง V
|
350.1 เมกะปาสกาล
|
-17.0 องศาเซลเซียส
|
| น้ำเหลว น้ำแข็ง V และ น้ำแข็ง VI
|
632.4 เมกะปาสกาล
|
0.16 องศาเซลเซียส
|
| ไอซ์ 1, ไอซ์ 2 และ ไอซ์ 3
|
213 เมกะปาสกาล
|
-35 น. องศาเซลเซียส
|
| ไอซ์ II, ไอซ์ III, และไอซ์ V
|
344 เมกะปาสกาล
|
-24 องศาเซลเซียส
|
| น้ำแข็ง II, น้ำแข็ง V และน้ำแข็ง VI
|
626 เมกะปาสกาล
|
-70 องศาเซลเซียส
|
เซลล์สามจุดใช้ใน การสอบเทียบ เทอร์โมมิเตอร์ สำหรับงานที่ต้องการความแม่นยำสูง เซลล์สามจุดมักจะเต็มไปด้วยสารเคมีที่มีความบริสุทธิ์สูง เช่น ไฮโดรเจน อาร์กอน ปรอท หรือน้ำ (ขึ้นอยู่กับอุณหภูมิที่ต้องการ) ความบริสุทธิ์ของสารเหล่านี้อาจมีได้เพียงหนึ่งส่วนจากล้านส่วนเท่านั้นที่เป็นสารปนเปื้อน เรียกว่า "หกเก้า" เพราะว่ามีความบริสุทธิ์ 99.9999% ใช้องค์ประกอบ ไอโซโทป ที่เฉพาะเจาะจง (สำหรับน้ำ VSMOW) เนื่องจากการเปลี่ยนแปลงในองค์ประกอบไอโซโทปทำให้จุดสามตัวมีการเปลี่ยนแปลงเล็กน้อย เซลล์สามจุดมีประสิทธิภาพในการบรรลุอุณหภูมิที่แม่นยำสูงและทำซ้ำได้ จนกระทั่งมาตรฐานการสอบเทียบสากลสำหรับเทอร์โมมิเตอร์ที่เรียกว่า ITS–90 ต้องใช้เซลล์สามจุดของ ไฮโดรเจน นีออน ออกซิเจน อาร์กอน ปรอท และ น้ำ ในการกำหนดจุดอุณหภูมิที่กำหนดไว้ 6 จุด
ตารางจุดสามสถานะ
ตารางนี้แสดงจุดสามสถานะของก๊าซ-ของเหลว-ของแข็งของสารหลายชนิด เว้นแต่จะระบุไว้เป็นอย่างอื่น ข้อมูลจะมาจาก สำนักงานมาตรฐานแห่งชาติ ของสหรัฐอเมริกา (ปัจจุบันคือ NIST หรือ สถาบันมาตรฐานและเทคโนโลยีแห่งชาติ) [9]
| สาร
|
T [K] (°C)
|
p [kPa]* (atm)
|
| Acetylene
|
192.4 เคลวิน (−80.7 องศาเซลเซียส)
|
120 kPa (1.2 atm)
|
| Ammonia
|
195.40 เคลวิน (−77.75 องศาเซลเซียส)
|
6.060 kPa (0.05981 atm)
|
| Argon
|
83.8058 เคลวิน (−189.3442 องศาเซลเซียส)
|
68.9 kPa (0.680 atm)
|
| Arsenic
|
1,090 เคลวิน (820 องศาเซลเซียส)
|
3,628 kPa (35.81 atm)
|
| Butane
|
134.6 เคลวิน (−138.6 องศาเซลเซียส)
|
7×10−4 kPa (6.9×10−6 atm)
|
| Carbon (graphite)
|
4,765 เคลวิน (4,492 องศาเซลเซียส)
|
10,132 kPa (100.00 atm)
|
| Carbon dioxide
|
216.55 เคลวิน (−56.60 องศาเซลเซียส)
|
517 kPa (5.10 atm)
|
| Carbon monoxide
|
68.10 เคลวิน (−205.05 องศาเซลเซียส)
|
15.37 kPa (0.1517 atm)
|
| Chloroform[10]
|
209.61 เคลวิน (−63.54 องศาเซลเซียส)
|
?
|
| Deuterium
|
18.63 เคลวิน (−254.52 องศาเซลเซียส)
|
17.1 kPa (0.169 atm)
|
| Ethane
|
89.89 เคลวิน (−183.26 องศาเซลเซียส)
|
1.1×10−3 kPa (1.1×10−5 atm)
|
| Ethanol
|
150 เคลวิน (−123 องศาเซลเซียส)
|
4.3×10−7 kPa (4.2×10−9 atm)
|
| Ethylene
|
104.0 เคลวิน (−169.2 องศาเซลเซียส)
|
0.12 kPa (0.0012 atm)
|
| Formic acid
|
281.40 เคลวิน (8.25 องศาเซลเซียส)
|
2.2 kPa (0.022 atm)
|
| Helium-4 (vapor−He-I−He-II) [11]
|
2.1768 เคลวิน (−270.9732 องศาเซลเซียส)
|
5.048 kPa (0.04982 atm)
|
| Helium-4 (hcp−bcc−He-II) [12]
|
1.463 เคลวิน (−271.687 องศาเซลเซียส)
|
26.036 kPa (0.25696 atm)
|
| Helium-4 (bcc−He-I−He-II) [12]
|
1.762 เคลวิน (−271.388 องศาเซลเซียส)
|
29.725 kPa (0.29336 atm)
|
| Helium-4 (hcp−bcc−He-I) [12]
|
1.772 เคลวิน (−271.378 องศาเซลเซียส)
|
30.016 kPa (0.29623 atm)
|
| Hexafluoroethane
|
173.08 เคลวิน (−100.07 องศาเซลเซียส)
|
26.60 kPa (0.2625 atm)
|
| Hydrogen
|
13.8033 เคลวิน (−259.3467 องศาเซลเซียส)
|
7.04 kPa (0.0695 atm)
|
| Hydrogen-1 (Protium) [13]
|
13.96 เคลวิน (−259.19 องศาเซลเซียส)
|
7.18 kPa (0.0709 atm)
|
| Hydrogen chloride
|
158.96 เคลวิน (−114.19 องศาเซลเซียส)
|
13.9 kPa (0.137 atm)
|
| Iodine[14]
|
386.65 เคลวิน (113.50 องศาเซลเซียส)
|
12.07 kPa (0.1191 atm)
|
| Isobutane
|
113.55 เคลวิน (−159.60 องศาเซลเซียส)
|
1.9481×10−5 kPa (1.9226×10−7 atm)
|
| Krypton
|
115.76 เคลวิน (−157.39 องศาเซลเซียส)
|
74.12 kPa (0.7315 atm)
|
| Mercury
|
234.3156 เคลวิน (−38.8344 องศาเซลเซียส)
|
1.65×10−7 kPa (1.63×10−9 atm)
|
| Methane
|
90.68 เคลวิน (−182.47 องศาเซลเซียส)
|
11.7 kPa (0.115 atm)
|
| Neon
|
24.5561 เคลวิน (−248.5939 องศาเซลเซียส)
|
43.332 kPa (0.42765 atm)
|
| Nitric oxide
|
109.50 เคลวิน (−163.65 องศาเซลเซียส)
|
21.92 kPa (0.2163 atm)
|
| Nitrogen
|
63.18 เคลวิน (−209.97 องศาเซลเซียส)
|
12.6 kPa (0.124 atm)
|
| Nitrous oxide
|
182.34 เคลวิน (−90.81 องศาเซลเซียส)
|
87.85 kPa (0.8670 atm)
|
| Oxygen
|
54.3584 เคลวิน (−218.7916 องศาเซลเซียส)
|
0.14625 kPa (0.0014434 atm)
|
| Palladium
|
1,825 เคลวิน (1,552 องศาเซลเซียส)
|
3.5×10−3 kPa (3.5×10−5 atm)
|
| Platinum
|
2,045 เคลวิน (1,772 องศาเซลเซียส)
|
2×10−4 kPa (2.0×10−6 atm)
|
| Radon
|
202 เคลวิน (−71 องศาเซลเซียส)
|
70 kPa (0.69 atm)
|
| (mono) Silane[15]
|
88.48 เคลวิน (−184.67 องศาเซลเซียส)
|
0.019644 kPa (0.00019387 atm)
|
| Sulfur dioxide
|
197.69 เคลวิน (−75.46 องศาเซลเซียส)
|
1.67 kPa (0.0165 atm)
|
| Titanium
|
1,941 เคลวิน (1,668 องศาเซลเซียส)
|
5.3×10−3 kPa (5.2×10−5 atm)
|
| Uranium hexafluoride
|
337.17 เคลวิน (64.02 องศาเซลเซียส)
|
151.7 kPa (1.497 atm)
|
| Water[6]
|
273.16 เคลวิน (0.01 องศาเซลเซียส)
|
0.611657 kPa (0.00603659 atm)
|
| Xenon
|
161.3 เคลวิน (−111.8 องศาเซลเซียส)
|
81.5 kPa (0.804 atm)
|
| Zinc
|
692.65 เคลวิน (419.50 องศาเซลเซียส)
|
0.065 kPa (0.00064 atm)
|
หมายเหตุ:
- เพื่อการเปรียบเทียบ ความดันบรรยากาศทั่วไปคือ 101.325 kPa (1 atm)
- ก่อนจะมีการกำหนดหน่วย SI ใหม่ จุดร่วมสามของน้ำ คือ 273.16 K ถือเป็นตัวเลขที่แน่นอน
อ้างอิง
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (1994) "Triple point"..
- ↑ James Thomson (1873) "A quantitative investigation of certain relations between the gaseous, the liquid, and the solid states of water-substance", Proceedings of the Royal Society, 22 : 27–36. จากเชิงอรรถในหน้า 28: " … the three curves would meet or cross each other in one point, which I have called the triple point".
- ↑ Definition of the kelvin at BIPM.
- ↑ "SI Brochure: The International System of Units (SI) – 9th edition". BIPM. สืบค้นเมื่อ 21 February 2022.
- ↑ International Equations for the Pressure along the Melting and along the Sublimation Curve of Ordinary Water Substance.
- ↑ 6.0 6.1 Murphy, D. M. (2005). "Review of the vapour pressures of ice and supercooled water for atmospheric applications". Quarterly Journal of the Royal Meteorological Society. 131 (608): 1539–1565. Bibcode:2005QJRMS.131.1539M. doi:10.1256/qj.04.94.
- ↑ Carr, Michael H. (2007). The Surface of Mars. Cambridge University Press. p. 5. ISBN 978-0-521-87201-0.
- ↑ Murphy, D. M. (2005). "Review of the vapour pressures of ice and supercooled water for atmospheric applications". Quarterly Journal of the Royal Meteorological Society. 131 (608): 1539–1565. Bibcode:2005QJRMS.131.1539M. doi:10.1256/qj.04.94.
- ↑ Cengel, Yunus A.; Turner, Robert H. (2004). Fundamentals of thermal-fluid sciences. Boston: McGraw-Hill. p. 78. ISBN 0-07-297675-6.
- ↑ "Trichloromethane". NIST Chemistry WebBook, SRD 69. NIST (National Institute of Science and Technology). สืบค้นเมื่อ 11 May 2024.
- ↑ Donnelly, Russell J.; Barenghi, Carlo F. (1998). "The Observed Properties of Liquid Helium at the Saturated Vapor Pressure". Journal of Physical and Chemical Reference Data. 27 (6): 1217–1274. Bibcode:1998JPCRD..27.1217D. doi:10.1063/1.556028.
- ↑ 12.0 12.1 12.2 Hoffer, J. K.; Gardner, W. R.; Waterfield, C. G.; Phillips, N. E. (April 1976). "Thermodynamic properties of 4He. II. The bcc phase and the P-T and VT phase diagrams below 2 K". Journal of Low Temperature Physics. 23 (1): 63–102. Bibcode:1976JLTP...23...63H. doi:10.1007/BF00117245.
- ↑ "Protium | isotope | Britannica". 27 January 2024.
- ↑ Walas, S. M. (1990). Chemical Process Equipment – Selection and Design. Amsterdam: Elsevier. p. 639. ISBN 0-7506-7510-1.
- ↑ "Silane-Gas Encyclopedia". Gas[ลิงก์เสีย] Encyclopedia. Air Liquide.
แหล่งข้อมูลอื่น


