|
Strok
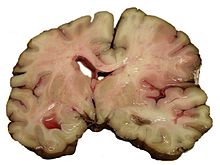 Strok (bentuk tidak baku: stroke)[a] atau angin ahmar adalah kondisi medis akibat buruknya aliran darah ke otak sehingga terjadi kematian sel.[2] Hal ini dapat terjadi karena iskemia (berkurangnya aliran darah) akibat penyumbatan (trombosis, embolisme arteri), atau adanya pendarahan.[3] Strok iskemik yang biasanya disebabkan oleh diabetes menjadi mayoritas pada penderita strok dan bisa mencapai 85 persen, sedangkan strok pendarahan hanya 15 persen, tetapi strok pendarahan dapat menyebabkan kematian pada 40 persen pasiennya. Yang perlu diperhatikan juga adalah strok iskemik ringan yang gejalanya mirip strok, tetapi akan hilang dengan sendirinya dalam 24 jam (transient ischemic attacks (TIA)). Hal ini terjadi karena penyumbatan pembuluh darah hanya terjadi sementara. Tetapi bagaimanapun, jika hal ini terjadi, maka kemungkinan terjadinya strok berikutnya yang lebih berat dapat terjadi. Di Indonesia, strok terjadi pada 12 dari 1.000 orang dan satu dari 7 pasien yang mengalami strok akan meninggal.[4] Karenanya, daerah yang terkena strok tidak dapat berfungsi seperti seharusnya. Gejala-gejalanya termasuk: hemiplegia (ketidakmampuan untuk menggerakkan satu atau lebih anggota badan dari salah satu sisi badan), aphasia (ketidakmampuan untuk mengerti atau berbicara), atau tidak mampu untuk melihat salah satu sisi dari luas pandang.[5] Strok memerlukan tindakan darurat medis pada masa emasnya (golden period) yang maksimum hanya berlangsung beberapa jam saja setelah terjadinya strok. Hal ini diperlukan untuk mencegah terjadinya kerusakan tetap atau kerusakan yang lebih parah. Dan jika tidak ditangani, bahkan bisa mengakibatkan kematian. Strok adalah penyebab ketiga terbesar kematian dan yang pertama dalam menyebabkan kecacatan pada dewasa di Amerika Serikat dan Eropa. Faktor-faktor yang meningkatkan risiko terjadinya strok adalah: usia, tekanan darah tinggi, strok sebelumnya, diabetes, kolesterol tinggi, merokok, fibrilasi atrium, migrain, dan trombofilia (kekurangan trombosis). Dari semua faktor-faktor tersebut yang paling mudah dikendalikan adalah tekanan darah tinggi dan merokok. 80 persen strok dapat dihindari dengan pengelolaan faktor-faktor risiko.[4] KlasifikasiStrok dibagi menjadi dua jenis yaitu strok iskemik maupun strok hemoragik. Sebuah prognosis hasil sebuah penelitian di Korea menyatakan bahwa,[6] 75,2% strok iskemik diderita oleh kaum pria dengan prevalensi berupa hipertensi, kebiasaan merokok dan konsumsi alkohol. Berdasarkan sistem TOAST, komposisi terbagi menjadi 20,8% LAAS, 17,4% LAC, 18,1% CEI, 16,8% UDE dan 26,8% ODE. Deteksi secepatnya dalam masa 'Golden Period' beberapa jam setelah serangan strok sangat berarti bagi kesehatan pasien pascastrok. Strok iskemik, karena penyumbatan harus diberikan obat pengencer darah untuk melancarkan sumbatan dalam waktu tidak lebih dari 3 jam setelah serangan strok, sedangkan strok hemoragik dimana terjadi pendarahan harus segera dilakukan pembedahan untuk membersihkan darah dari otak. Jika terlambat penangannya, maka pasien akan menderita pascastrok yang lebih berat.[7] Strok hemoragikDalam strok hemoragik, pembuluh darah pecah sehingga menghambat aliran darah yang normal dan darah merembes ke dalam suatu daerah di otak dan merusaknya. Pendarahan dapat terjadi di seluruh bagian otak seperti caudate putamen; talamus; hipokampus; frontal, parietal, dan occipital cortex; hipotalamus; area suprakiasmatik; cerebellum; pons; dan midbrain.[8] Hampir 70 persen kasus strok hemorhagik menyerang penderita hipertensi.[9] Strok hemoragik terbagi menjadi subtipe intracerebral hemorrhage (ICH), subarachnoid hemorrhage (SAH),[10] cerebral venous thrombosis, dan spinal cord stroke.[11] ICH lebih lanjut terbagi menjadi parenchymal hemorrhage, hemorrhagic infarction, dan punctate hemorrhage.[8] Strok iskemikDalam strok iskemik, penyumbatan bisa terjadi di sepanjang jalur pembuluh darah arteri yang menuju ke otak. Darah ke otak disuplai oleh dua arteria karotis interna dan dua arteri vertebralis. Arteri carotis interna merupakan cabang dari arteri carotis communis sedangkan arteri vertebralis merupakan cabang dari arteri subclavia. Sistem klasifikasi etiologisBeberapa sistem klasifikasi yang didasarkan pada pertimbangan etiologi telah diterapkan kepada strok iskemik.[12] Beberapa sistem tersebut gagal mengikuti perkembangan zaman dan tidak lagi dipergunakan, beberapa sistem yang lain masih dapat diterima oleh sebagian masyarakat dan dipergunakan dalam lingkup yang terbatas. Berikut adalah sistem klasifikasi yang paling mutakhir dan paling banyak digunakan. Sistem TOASTSistem TOAST (bahasa Inggris: Trial of ORG 10172 in Acute Stroke Treatment) pertama kali dikembangkan kepada terapi strok iskemik akut pada awal tahun 1990. Sistem ini didasarkan pada sebagian besar fitur klinis namun tetap mempertimbangkan informasi diagnostik dari CT, MRI, transthoracic echocardiography, extracranial carotid ultrasonography, dan jika memungkinkan, cerebral angiography. Sistem TOAST membagi strok menjadi 5 subtipe yaitu,[13][14] large artery atherosclerosis (LAAS), cardiaoembolic infarct (CEI), small artery occlusion/lacunar infarct (LAC), stroke of another determined cause/origin (ODE), dan stroke of an undetermined cause/origin (UDE). Sistem CCSKlasifikasi sistem CCS (bahasa Inggris: Causative Classification of Stroke System) mirip dengan sistem TOAST dengan perbedaan dalam subtipe large artery atherosclerosis dibedakan menjadi occlusive dan stenotic. Sebagai contoh, penurunan diameter ≥ 50%, atau penurunan diameter <50% disertai plaque ulceration atau trombosis. Dan subtipe undetermined cause dibedakan lebih lanjut menjadi unknown, incomplete evaluation, unclassified stroke (more than one etiology), dan cryptogenic embolism. Sistem ASCOASCO merupakan akronim dari atherothrombosis, small vessel disease, cardiac causes, and other uncommon causes. Sistem ASCO merupakan klasifikasi berdasarkan sistem fenotipe. Tiap fenotipe masih terbagi menjadi jenjang 0, 1, 2, 3 atau 9. Jenjang 0 berarti disease is completely absent, 1 berarti definitely a potential cause of the index stroke, 2 untuk causality uncertain dan 3 untuk unlikely a direct cause of the index stroke (but disease is present), 9 bagi grading is not possible due to insufficient work-up.[15] Dalam sistem ini, penderita dapat dikategorikan menjadi lebih dari satu subtipe etiologis, misalnya, penderita dengan ateroma karotid yang menyebabkan stenosis 50% dan fibrilasi atrial dengan aterosklerosis dan emboli kardiak, atau dijabarkan menjadi seperti A1-S9-C0-O3. Sistem UCSD Stroke DataBankSistem UCSD mengklasifikan strok iskemik menjadi large-vessel stenotic, large-vessel occlusive, Small-vessel stenotic, small-vessel occlusive, embolic dan unknown cause. Sedangkan klasifikasi strok hemoragik terbagi menjadi subtipe yang sama yaitu tipe intracerebral dan subarachnoid. Sistem HCSRSistem HCSR (bahasa Inggris: Harvard Cooperative Stroke Registry) membuat klasifikasi menjadi subtipe strok yang disertai trombosis di arteri atau dengan infark lakunar, cerebral embolism, intracerebral hematoma, subarachnoid hemorrhage dari malformasi aneurysm atau arteriovenous.[16] Sistem NINCDS Stroke Data BankDalam Stroke Data Bank of the National Institute of Neurological and Communicative Disorders and Stroke mengklasifikasi menjadi subtipe diagnostik berdasarkan riwayat klinis penderita, pemeriksaan, test laborat meliputi tomografi, noninvasive vascular imaging, dan saat memungkinkan dan relevan, angiografi. Dari diagnosa tersebut subtipe infarcts of undetermined cause (IUC) dapat diklasifikasi ulang menjadi subtipe embolisme idiopatik, stenosis atau trombosis di pembuluh nadi, infark lakunar, infarksi superfisial dan sindrom nonlakunar.[17] Sistem lainBeberapa ahli lain mempertimbangan klasifikasi berdasarkan fenotipe seperti keberadaan internal carotid artery plaque, intima-media thickness, leukoaraiosis, cerebral microbleeds (CMB), atau multiple lacunae.[11] CMB adalah deposit hemosiderin intraserebral yang terdapat di ruang pervaskular.[18] Ekspresi CMB sangat tinggi di infark lakunar dan infark aterotrombotik, dan berekspresi rendah di infarksi kardioembolik. CMB dan leukoaraiosis sangat berkaitan erat. Hasil prognosis menunjukkan bahwa CMB ditemukan dalam 47-80% kasus primary intracerebral haemorrhage dan 0-78% dalam kasus ischaemic cerebrovascular disease.[19] PatofisiologiHingga saat ini patofisiologi strok didasarkan pada serangkaian penelitian,[20] terhadap berbagai proses yang saling terkait, meliputi kegagalan energi, hilangnya homeostasis ion sel, asidosis, peningkatan kadar kalsium|Ca2+ sitosolik, eksitotoksisitas, toksisitas dengan radikal bebas, produksi asam arakidonat, sitotoksisitas dengan sitokin, aktivasi sistem komplemen, disrupsi sawar darah otak, aktivasi sel glial dan infiltrasi leukosit.[21] Pusat area otak besar yang terpapar iskemia akan mengalami penurunan aliran darah yang dramatis, menjadi cedera dan memicu jenjang reaksi seperti lintasan eksitotoksisitas yang berujung kepada nekrosis yang menjadi pusat area infark dikelilingi oleh penumbra/zona peri-infarksi. Menurut morfologi, nekrosis merupakan bengkak seluler akibat disrupsi inti sel, organel, membran plasma, dan disintegrasi struktur inti dan sitoskeleton. Di area penumbra, apoptosis neural akan berusaha dihambat oleh kedua mekanisme eksitotoksik dan peradangan,[22] oleh karena sel otak yang masih normal akan menginduksi sistem kekebalan turunan untuk meningkatkan toleransi jaringan otak terhadap kondisi iskemia, agar tetap dapat melakukan aktivitas metabolisme. Protein khas CNS seperti pancortin-2 akan berinteraksi dengan protein modulator aktin, Wiskott-Aldrich syndrome protein verprolin homologous-1 (WAVE-1) dan Bcl-xL akan membentuk kompleks protein mitokondrial untuk proses penghambatan tersebut. Riset terkini menunjukkan bahwa banyak neuron di area penumbra dapat mengalami apoptosis setelah beberapa jam/hari sebagai bagian dari proses pemulihan jaringan pascastrok dengan dua lintasan, yaitu lintasan ekstrinsik dan lintasan intrinsik. Iskemia tidak hanya mempengaruhi jaringan parenkima otak, namun berdampak pula kepada sistem ekstrakranial. Oleh karena itu, strok akan menginduksi imunosupresi yang dramatis melalui aktivasi berlebih sistem saraf simpatetik, sehingga memungkinkan terjadinya infeksi bakterial seperti pneumonia. Eksitotoksisitas asam glutamatAsam glutamat merupakan neurotransmiter asam amino eksitatorial utama di otak, akan menumpuk di ruang ekstraselular dan mengaktivasi reseptornya.[21] Aktivasi pencerap glutamat akan memengaruhi konsentrasi ion intraselular, terutama ion natrium|Na+ dan kalsium|Ca2+. Peningkatan influx ion Na+ dapat membuat sel menjadi cedera pada awal mula terjadinya iskemia, namun riset menunjukkan bahwa sebagian besar kerusakan sel yang ditimbulkan oleh toksisitas asam glutamat saat terjadi iskemia lebih disebabkan oleh peningkatan berlebih influx ion kalsium intraselular yang kemudian menimbulkan efek toksik. Stres oksidatifSepanjang proses strok, terjadi peningkatan radikal bebas seperti anion superoksida, radikal hidroksil dan NO. Sumber utama senyawa radikal bebas turunan oksigen yang biasa disebut spesi oksigen reaktif dalam proses iskemia adalah mitokondria. Sedangkan produksi senyawa superoksida saat pasca iskemia adalah metabolisme asam arakidonat melalui lintasan siklo-oksigenase dan lipo-oksigenase. Radikal bebas juga dapat diproduksi oleh sel mikroglia yang teraktivasi dan leukosit melalui sistem NADPH oksidase segera setelah terjadi reperfusi di jaringan iskemik. Oksidasi tersebut akan menyebabkan kerusakan lebih lanjut di jaringan dan merupakan molekul yang penting untuk memicu apoptosis setelah strok iskemik. NO umumnya dihasilkan dari L-arginina dengan salah satu isoform NO sintase, dan merupakan kluster diferensiasi neuron di seluruh bagian otak dengan sebutan nNOS. Aktivasi nNOS memerlukan kalsium/kalmodulin. Di sisi lain, ekspresi iNOS (bahasa Inggris: inducible NOS) terdapat di sel radang seperti sel mikroglia dan monosit. Kedua isoform nNOS dan iNOS memiliki peran yang merusak otak pada rentang waktu iskemia. Namun isoform yang ketiga eNOS (bahasa Inggris: endothelial NOS) memiliki efek vasodilasi dan tidak bersifat merusak. Aktivasi pencerap NMDA saat iskemia akan menstimulasi produksi NO oleh nNOS. NO yang terbentuk akan masuk ke dalam sitoplasma dan bereaksi dengan superoksida dan menghasilkan sejenis spesi oksigen yang sangat reaktif yaitu peroksinitrita (ONOO-). Pasca iskemia, kedua jenis spesi oksigen reaktif dan spesi nitrogen reaktif kemudian berperan untuk mengaktivasi beberapa lintasan metabolisme seperti radang, apoptosis, dan penurunan pasokan oksigen yang berdampak kepada peningkatan asam laktat melalui glikolisis anaerobik atau asidosis. Selain itu, akan tampak ekspresi gen iNOS di sel vaskular maupun sel yang mengalami peradangan dan ekspresi gen COX-2 di sel saraf di area antara infark dan penumbra. Kedua gen radang ini akan meningkatkan kerusakan iskemik.[23] Peroksidasi lipid
Selain menghasilkan berbagai senyawa ROS, lintasan asidosis juga turut serta dalam proses sintesis protein intraselular. Peroksidasi lipid di membran sel yang menginduksi apoptosis terhadap neuron, akan menghasilkan senyawa aldehida yang disebut 4-hidroksinonenal (4-HNE) yang akan bereaksi dengan transporter membran seperti Na+/K+ ATPase, transporter glutamat dan transporter glukosa. Kerusakan di transporter membran, yang menyebabkan influx berlebih ion Ca2+ dan radikal bebas, lebih lanjut akan mengaktivasi faktor transkripsi neuroprotektif seperti NF-κB, HIF-1 dan IRF-1. Aktivasi faktor transkripsi ini akan menginduksi produksi sitokina radang seperti IL-1, IL-6, TNF-α, kemokina seperti IL-8, MCP-1, molekul adhesi sel seperti selektin, ICAM-1, VCAM-1 dan gen pro-radang lainnya seperti IIP-10. Disfungsi sawar darah otakSawar darah otak yang merupakan jaringan endotelium di otak akan merespons kondisi cedera akibat strok dengan meningkatkan permeabilitas dan menurunkan fungsi sawarnya, bersamaan dengan degradasi lamina basal di dinding pembuluhnya. Oleh sebab itu, pada kondisi akut, strok akan meningkatkan interaksi antara sel endotelial otak dengan sel ekstravaskular seperti astrosit, mikroglia, neuron, dengan sel intravaskular seperti keping darah, leukosit; dan memberikan kontribusi lebih lanjut pada proses peradangan, disamping perubahan sirkulasi kadar ICAM-1, trombomodulin, faktor jaringan dan tissue factor pathway inhibitor.[24] Disfungsi endotelial yang menyebabkan defisiensi sawar darah otak, impaired cerebral autoregulation dan perubahan protrombotik dipercaya merupakan penyebab cerebral small vessel disease (SVD). Penderita (SVD) dapat mengalami infark lakunar, atau dengan disertai leukoaraiosis. Dari 594 penderita strok, leukoaraiosis ditemukan dalam 55,4% cerebral large vessel disease (LVD) atau ateroskeloris, 30,3% dalam SVD dan 14,3% dalam cardioembolic disease. Dalam pronosis LVD, leukoaraiosis memiliki kecenderungan ke arah grup stenosis intrakranial dengan 40,3% untuk grup intrakranial, 26,9% untuk grup ekstrakranial dan 45,5% untuk grup kombinasi keduanya. Tidak ditemukan korelasi antara leukoaraiosis dengan diabetes mellitus, hiperlipidemia, merokok, hipertensi dan penyakit jantung.[25] Infiltrasi leukositDi jaringan otak terdapat beberapa populasi sel dengan kapasitas untuk mensekresi sitokina setelah terjadi stimulasi iskemia, yaitu sel endotelial, astrosit, sel mikroglia dan neuron. Peran respons peradangan pasca iskemia dilakukan oleh sel mikroglia, terutama di area penumbra dengan sekresi sitokina pro-radang, metabolit dan enzim toksik. Selain itu, sel mikroglia dan astrosit juga mensekresi faktor neuroprotektif seperti eritropoietin, TGFβ1, dan metalotionein-2. Terdapat banyak bukti yang menunjukkan peran leukosit terhadap patogenesis cedera akibat strok seperti cedera di jaringan akibat reperfusi dan disfungsi mikrovaskular. Bukti-bukti tersebut dapat diklasifikasikan menjadi 3 bagian pokok yaitu,
Akumulasi sel T terjadi pasca iskemia,[26] dan diperkirakan merupakan penyebab terjadinya reperfusi. Sel T CD8 dapat menginduksi cedera otak dengan molekul dari granula sitotoksik. Sel TH1 CD4+ dengan sekresi sitokina pro-radang termasuk IL-2, IL-12, IFN-γ dan TNF-α dapat memperburuk efek yang ditimbulkan strok, sedangkan Sel TH2 CD4+ dengan sitokina anti-radang seperti IL-4, IL-5, IL-10 dan IL-13 lebih mempunyai peran protektif. PendarahanPada percobaan terhadap hewan kelinci, setidaknya sitokina TNF-α atau antibodinya berperan atas terjadinya pendarahan setelah terjadi strok iskemik yang diinduksi oleh klot.[27] Dalam hal ini terjadi peningkatan prognosis terjadinya pendarahan dari 18,5% menjadi 53,3% dan peningkatan volume pendarahan hingga 87%. Disamping itu, penggunaan tissue plasminogen activator (tPA) dengan dosis standar 3,3 mg/kg akan meningkatkan kemungkinan pendarahan dari 18,5% menjadi 76,5%, efek tPA ini dapat diredam dengan penggunaan antibodi anti-TNFα. Pemberian EPO setelah 6 jam serangan strok akan memperburuk pendarahan yang diinduksi tPA dengan mediasi MMP-9, NF-κB dan interleukin-1 receptor-associated kinase-1 (IRAK-1).[28] Pada hewan tikus, TNF-α akan menginduksi ekspresi MMP-9 yang menurunkan kadar protein dalam sawar darah otak seperti okludin,[29] dan meningkatkan permeabilitas pada pembuluh kapiler otak.[30] MMP-9 kemudian memodulasi,[31] Gelatinase A untuk membuka sawar darah otak. Pendarahan yang terjadi kemudian direspons tubuh dengan memproduksi urokinase-type plasminogen activator (uPA). Ekspresi MMP-9 juga dapat diinduksi oleh lipopolisakarida.[31] Faktor risikoHipertensiHipertensi akan merangsang pembentukan plak aterosklerotik di pembuluh arteri dan arteriol dalam otak, serta menginduksi lintasan lipohialinosis di pembuluh ganglia basal, hingga menyebabkankan infark lakunar atau pendarahan otak.[33] Fibrilasi atrialFibrilasi atrial merupakan indikasi terjadinya kardioembolisme, sedangkan kardioembolisme merupakan 20% penyebab stok iskemik.[34] Kardioembolisme terjadi akibat kurangnya kontraksi otot jantung di bilik kiri, disebut stasis, yang terjadi oleh penumpukan konsentrasi fibrinogen, D-dimer dan faktor von Willebrand.[35] Hal ini merupakan indikasi status protrombotik dengan infark miokardial, yang pada gilirannya, akan melepaskan trombus yang terbentuk, dengan konsekuensi peningkatan risiko embolisasi di otak. Sekitar 2,5% penderita infark miokardial akut akan mengalami strok dalam kurun waktu 2 hingga 4 minggu, 8% pria dan 11% wanita akan mengalami strok iskemik dalam waktu 6 tahun, oleh karena disfungsi dan aneurysm bilik kiri jantung. AterosklerosisPenelitian mengenai lintasan aterogenesis yang memicu aterosklerosis selama ini terfokus kepada pembuluh nadi koroner, namun proses serupa juga terjadi di otak dan menyebabkan strok iskemik.[36] Aterosklerosis dapat menyerang pembuluh nadi otak seperti pembuluh karotid, pembuluh nadi di otak tengah, dan pembuluh basilar, atau kepada pembuluh arteriol otak seperti pembuluh lenticulostriate, basilar penetrating, dan medullary. Beberapa riset menunjukkan bahwa mekanisme aterosklerosis yang menyerang pembuluh nadi dapat sedikit berbeda dengan mekanisme kepada pembuluh arteriol. Aterosklerosis intrakranial dianggap sebagai kondisi yang sangat jarang terjadi. Hasil otopsi infark otak dari 339 penderita strok yang meninggal akibat aterosklerosis intrakranial, ditemukan 62,2% plak intrakranial dan 43,2% stenosis intrakranial.[37] Hasil otopsi oleh National Cardiovascular Center, Osaka, Jepang terhadap 142 penderita strok yang meninggal dalam waktu 30 hari sejak terhitung sejak terjadi serangan iskemia, menunjukkan bahwa kedua jenis trombus yang kaya akan keping darah dan yang kaya akan fibrin berkembang di culprit plaque di dalam pembuluh nadi otak merupakan faktor utama penyebab strok aterotrombotik.[38] 70% kasus strok kardioembolik menunjukkan keberadaan trombus sebagai sumber potensial terbentuknya emboli di jantung atau pembuluh balik terhadap penderita patent foramen ovale dan tetralogy of Fallot. Umumnya trombus yang kaya akan keping darah yang mengendap di pembuluh balik jantung, akan terlepas dan membentuk emboli di pembuluh nadi otak. Diabetes mellitusBerdasarkan studi hasil otopsi, penderita diabetes mellitus rentan terhadap infark lakunar dan cerebral small vessel disease. Studi epidemiologi menunjukkan bahwa diabetes merupakan faktor risiko bagi strok iskemik. Patogenesis strok yang dipicu tampaknya dimulai dari reasi berlebih glikasi dan oksidasi, disfungsi endotelial, peningkatan agregasi keping darah, defisiensi fibrinolisis dan resistansi insulin.[39] Dalam hewan tikus, strok iskemik yang terjadi dalam diabetes mellitus akan memicu strok hemoragik yang disertai dengan peningkatan enzim MMP-9 di otak yang memperburuk kondisi leukoaraiosis.[40] Transient Ischemic Attack (TIA)Transient ischemic attack (TIA), disebut juga acute cerebrovascular syndrome (ACVS),[41] adalah salah satu faktor risiko dari strok iskemik.[42] TIA dapat dijabarkan sebagai episode singkat disfungsi neurologis yang biasanya terjadi akibat gangguan vaskular,[43] berupa simtoma iskemia di otak atau retina yang berlangsung kurang dari 24 jam, atau kurang dari 1 jam,[44] tanpa meninggalkan bekas berupa infark serebral[45] akut.[46] Dari sudut pandang lain, oleh karena strok merupakan defisiensi neurologis akibat perubahan aliran darah di jaringan otak, maka TIA dapat dikatakan sebagai indikasi atau simtoma yang ditimbulkan dari perubahan aliran darah otak yang tidak dapat dideteksi secara klinis dalam waktu 24 jam.[47] TIA tidak selalu menjadi indikasi akan terjadinya strok di kemudian hari, dan jarang sekali dikaitkan dengan strok hemoragik primer. Dalam populasi manusia yang telah beranjak tua, TIA diinduksi oleh terhalangnya aliran darah di pembuluh darah besar terutama akibat aterotrombosis, namun dalam penderita yang berusia di bawah 45 tahun TIA umumnya disebabkan oleh robeknya pembuluh darah (bahasa Inggris: arterial dissection), migrain dan obat-obatan sympathomimetic. TIA juga dapat disebabkan oleh:
Namun beberapa kondisi lain dapat menimbulkan gejala yang sangat serupa dengan TIA, seperti focal seizure activity, migraine (?"spreading depression"), compressive mononeuropathies (carpal tunnel syndrome. ulnar elbow compression and so forth), sindrom Adams-Stokes, tumor otak dengan gejala neurologik transien, hematoma subdural, Demyelinating disease, hipoglisemia, hiperglisemia, primary ocular disease-glaucoma, vitreal hemorrhage. floaters and the like, functional disorders-conversion hysteria, malingering, hiperventilasi. Cardiac papillary fibroelastoma (CPF)Dari 725 kasus CPF, 55% merupakan penderita pria dengan lokasi tumor, umumnya, ditemukan di permukaan valvular, terutama di katup trikuspidalis aortik, selain katup mitralis. Tumor juga ditemukan di permukaan non-valvular, seperti di bilik kiri. Ukuran tumor bervariasi dari 2 mm hingga 70 mm.[48] Manifestasi klinis CPF meliputi strok, infark miokardial, emboli paru, gagal jantung congestive dan serangan jantung mendadak.[49] Meskipun demikian, tidak semua penderita menunjukkan simtoma demikian. Cryptogenic cerebral infarction (CCI)CCI paling banyak ditemukan dalam penderita patent foramen ovale baik yang disertai maupun tidak disertai septal aneurysm.[50][51] Sejak tahun 1989, CCI merupakan penyebab 40% kasus strok iskemik. 4,9% pria dan 2,4% wanita mengalami mutasi genetik galaktosidase-alfa yang merupakan indikasi penyakit Fabry, sedangkan studi lain menunjukkan keterkaitan dengan trombofilia.[52] Lintasan patogenesis CCI diperkirakan meliputi aterosklerosis di pembuluh nadi otak, baik yang bersifat intrakranial seperti moderate middle cerebral artery stenosis, ekstrakranial seperti vertebral artery origin stenosis atau proksimal seperti thick plaques in the aortic arch yang selama ini dianggap tidak berkaitan dengan patogenesis strok.[53] Patent foramen ovale (PFO)Sindrom platipnea-ortodeoksia merupakan kondisi yang jarang terjadi dengan simtoma berupa dispnea dan desaturasi arterial. PFO merupakan salah satu bentuk sindrom platipnea-ortodeoksia dengan peningkatan ortostatik di area defisiensi atrial septal.[54] Hasil diagnosa PFO yang sering ditemukan pada CCI dan migrain, juga diperkirakan sebagai penyebab emboli pada penderita tromboembolisme arterial. Deteksi diniDeteksi dini kemungkinan terjadinya strok, bukanlah diagnosis, tetapi merupakan cara untuk mengetahui kemungkinan terjadinya strok yang harus ditindak lanjuti dengan pemeriksaan lanjutan. Jika seseorang tidak dapat berdiri dengan satu kaki selama 20 detik, maka ada kemungkinan (akan) terjadinya strok atau kemunduran kognitif, karena untuk melakukan tugas itu diperlukan keseimbangan yang memerlukan peredaran darah yang prima ke otak. Hal ini telah diungkapkan pada jurnal Stroke American Heart Association. Semakin sulit berdiri dengan hanya satu kaki, semakin tinggi (akan) kemungkinan terjadinya strok.[55] DiagnosisDiagnosis strok adalah secara klinis beserta pemeriksaan penunjang. Pemeriksaan penunjang yang dapat dilakukan antara lain CT scan kepala, MRI. Untuk menilai kesadaran penderita strok dapat digunakan Skala Koma Glasgow. Untuk membedakan jenis strok dapat digunakan berbagai sistem skor, seperti Skor Strok Siriraj, Algoritme Strok Gajah Mada, atau Algoritme Junaedi. Simtoma klinisFitur strok iskemik yang sangat umum, menurut Uniformed Services University of the Health Sciences, masih berdasar kepada banyaknya hasil diagnosis pemeriksaan fisik terhadap penderita yang dirangkum dalam satu kurun waktu. USUHS merangkumnya menjadi tabel berikut agar dapat digunakan masyarakat awam untuk mengenali gejala klinis strok sedini mungkin. Dan bagi tenaga medis profesional, The National Institute of Health telah membuat tabel skala strok Diarsipkan 2011-09-11 di Wayback Machine. sebagai panduan guna melakukan diagnosis dalam waktu kurang dari sekitar 5 hingga 10 menit. Simtoma paraklinisBeberapa senyawa biokimiawi di dalam serum darah yang dapat dijadikan dasar diagnosis dan prognosis terjadinya nekrosis otak antara lain:[56] S100-β
S100-β adalah peptida yang disekresi astrosit pada saat terjadi cedera otak, proses neurodegenerasi dan kelainan psikiatrik. S100-β merupakan senyawa pengikat kalsium, secara in vitro, pada kadar rendah, interaksi dengan sistem kekebalan di otak akan meningkatkan kelangsungan hidup bagi neuron yang sedang berkembang, namun, pada kadar yang lebih tinggi, S100-β akan menstimulasi produksi sitokina pro-peradangan dan apoptosis. Studi terhadap hewan menunjukkan efek neuroprotektif S100-β dengan teraktivasinya proses seluler di neuron yang menahan eksitotoksisitas yang diinduksi NMDA. Peningkatan serum S100-β selalu terjadi pada strok iskemik, dan terjadi pula pada kondisi yang lain seperti traumatic brain injury (TBI), Alzheimer dan schizophrenia. Saat terjadi strok iskemik, konsentrasi serum S100-β mencapai titik maksimum pada hari ke-2 hingga 4. Nilai konsentrasi maksimum S100-β berkaitan dengan skala strok NIH, ukuran dan patofisiologi infark, sehingga semakin tinggi nilai maksimum S100-β, semakin tinggi pula risiko terjadinya transformasi hemoragik. Peningkatan S100-β juga ditemukan dalam strok hemoragik primer, yang menunjukkan volume hematoma awal. Peningkatan kadar S100-β tidak harus terjadi dengan cepat, dan masih banyak sel selain astrosit dan sel Schwann yang menhasilkan S100-β, sehingga penggunaan nilai serum S100-β sebagai salah satu dasar diagnosis strok masih cukup rentan. Namun beberapa studi telah menunjukkan bahwa serum S100-β lebih terkait dengan kondisi integritas sawar darah otak. Glial fibrillary-associated protein (GFAP)
GFAP merupakan monomeric intermediate filament protein yang terdapat di astrosit dan sel ependimal otak yang berfungsi sebagai bagian sitoskeleton. Kadar serum S100-β dan GFAP akan meningkat tajam pada hari 1-2 sesuai dengan ukuran infark, dan kembali normal sekitar 3 minggu kemudian. Serum GFAP merupakan indikator yang lebih peka daripada S100-β pada strok minor maupun guratan kecil, namun waktu tunda peningkatan serum ini membuat aplikasi diagnostiknya menjadi terbatas. Myelin basic protein (MBP)
MBP adalah protein hidrofilik penting bagi struktur selubung mielin. Kadar MBP dalam CSF sering digunakan sebagai indikasi aktivitas patogen dalam sklerosis multipel. Strok juga disertai dengan peningkatan kadar MBP dalam CSF sekitar 1 minggu setelah terjadinya serangan, dan kembali normal setelah minggu ketiga. Fatty acid-binding proteins (FABPs)
FABP adalah kelompok molekul intraselular yang berperan dalam menyangga dan sebagai transportasi asam lemak berantai panjang, yang akan segera disekresi ke dalam sirkulasi darah sesaat setelah terjadi kerusakan sel. Di tubuh manusia terdapat 9 jenis FABP yang tersebar dalam masing-masing jenis jaringan yang berbeda. Empat jenis FABP terdapat di sistem saraf, dua diantaranya hanya ditemukan di sistem saraf pusat orang dewasa, yaitu brain-type (B-FABP) di glia dan heart-type (H-FABP) di neuron. Ditemukannya H-FABP dalam berbagai jenis jaringan merupakan tanda-tanda infak miokardial akut. B-FABP berada dalam jaringan di dalam sistem saraf pusat dan tidak dapat dideteksi dalam serum darah manusia sehat. Serum H-FABP dan B-FABP akan tajam dalam 2-3 jam sejak terjadi serangan strok. B-FABP merupakan indikasi yang sangat peka terhadap infark lakunar dan infark subkortikal, namun tidak menunjukkan tingkat kerusakan yang terjadi di neuron, dan bukan merupakan indikasi spesifik terjadinya strok. Sebaliknya peningkatan H-FABP berbanding lurus dengan ukuran infark dan tingkat kerusakan saraf. Neuron-specific enolase (NSE)
NSE merupakan salah satu dari tiga bentuk enolase, sebuah enzim yang terdapat di lintasan glikolisis. Walaupun cukup spesifik di neuron, NSE juga dapat ditemukan di kultur sel neuroendokrin dan bentuk sel kanker terkait. Konsentrasi NSE di dalam CSF akan meningkat seiring terjadinya strok iskemik dan sejumlah cedera otak lain seperti subarachnoid hemorrhage, ICH, dan lain-lain, hingga mulai dapat dideteksi setelah 4-8 jam setelah terjadinya serangan. Konsentrasi tertinggi setelah terjadi strok iskemik memiliki korelasi dengan nilai pada skala strok NIH. Protein tau (TP)
Otak memiliki 6 isomer TP yang memungkinkan terbentuknya mikrotubula dengan interaksi tubulin. Peningkatan kadar TP terjadi dengan sangat lambat dan hanya 27% total konsentrasi yang mengalami peningkatan di luar batas atas ambang normal dalam waktu 24 jam setelah serangan strok iskemik, namun nilai konsentrasi ini menunjukkan ukuran infark dan strata serangan strok. Peningkatan kadar TP dalam CSF pascastrok juga merupakan indikasi ukuran infark. Akan tetapi strok tidak mempengaruhi kadar β-amyloid, ApoE dan klusterin dalam CSF. PenangananPenderita strok akut biasanya diberikan SM-20302,[57] atau microplasmin,[58] oksigen, dipasang infus untuk memasukkan cairan dan zat makanan, kemudian diberikan manitol atau kortikosteroid untuk mengurangi pembengkakan dan tekanan di dalam otak,[59] akibat infiltrasi sel darah putih. Penelitian terakhir menunjukkan bahwa kelumpuhan dan gejala lainnya bisa dicegah atau dipulihkan jika recombinan tissue plasminogen activator (rtPA) atau streptokinase yang berfungsi menghancurkan emboli diberikan dalam waktu 3 jam,[60] setelah timbulnya strok. Trombolisis dengan rtPA terbukti bermanfaat pada manajemen strok akut, walaupun dapat meningkatkan risiko pendarahan otak,[61] terutama pada area sawar darah otak yang terbuka.[62] Beberapa senyawa yang diberikan bersamaan dengan rtPA untuk mengurangi risiko tersebut antara lain batimastat (BB-94) dan marimastat (BB-2516),[63] yang menghambat enzim MMP, senyawa spin trap agent seperti alpha-phenyl-N-t-butylnitrone (PBN) dan disodium- [tert-butylimino)methyl]benzene-1,3-disulfonate N-oxide (NXY-059),[64] dan senyawa anti-ICAM-1.[65] Metode perawatan hemodilusi dengan menggunakan albumin masih kontroversial,[66] namun penelitian oleh The Amsterdam Stroke Study memberikan prognosis berupa penurunan angka kematian dari 27% menjadi 16%, peningkatan kemandirian aktivitas dari 35% menjadi 48%, saat 3 bulan sejak terjadi serangan strok akut. PemulihanSerangan strok terkait dengan keterbatasan pulihnya fungsi otak, meskipun area peri-infark menjadi lebih bersifat neuroplastik sehingga memungkinkan perbaikan fungsi sensorimotorik melakukan pemetaan ulang di area otak yang mengalami kerusakan. Di tingkat seluler, terjadi dua proses regenerasi dalam korteks peri-infark, akson akan mengalami perubahan fenotipe dari neurotransmiter ke dalam status regeneratif,[67] dan menjulurkan tangkainya untuk membuat koneksi baru di bawah pengaruh trombospondin,[68] laminin, dan NGF hasil sekresi sel Schwann,[69] dan terjadi migrasi sel progenitor neuron ke dalam korteks peri-infark.[70] Hampir sepanjang 1 bulan sejak terjadi serangan strok, daerah peri-infark akan mengalami penurunan molekul penghambat pertumbuhan. Pada rentang waktu ini, neuron akan mengaktivasi gen yang menstimulasi pertumbuhan, dalam ritme yang bergelombang. Neurogenesis saling terkait dengan angiogenesis juga terjadi bergelombang yang diawali dengan migrasi neuroblas dengan ekspresi GFAP,[71] yang berada dalam zona subventrikular ke dalam korteks peri-infark. Migrasi ini dimediasi oleh beberapa senyawa antara lain eritropoietin,[72] stromal-derived factor 1 (SDF-1) dan angiopoietin-1, hingga menghasilkan neuroblas dengan jarak tempuh migrasi yang lebih panjang dan rentang waktu sitokinesis yang lebih pendek.[73] Terhambatnya fungsi pencerap GABA ekstrasinaptik di area peri-infark yang terjadi akibat oleh disfungsi transporter GABA GAT-3/GAT-4, dalam hewan tikus, dapat dipulihkan dengan pemberian benzodiazepina.[74] PencegahanDalam manusia tanpa faktor risiko strok dengan umur di bawah 65 tahun, risiko terjadinya serangan strok dalam 1 tahun berkisar pada angka 1%.[75] Setelah terjadinya serangan strok ringan atau TIA, penggunaan senyawa anti-koagulan seperti warfarin, salah satu obat yang digunakan untuk penderita fibrilasi atrial,[76] akan menurunkan risiko serangan strok dari 12% menjadi 4% dalam satu tahun. Sedangkan penggunaan senyawa anti-keping darah seperti aspirin, umumnya pada dosis harian sekitar 30 mg atau lebih, hanya akan memberikan perlindungan dengan penurunan risiko menjadi 10,4%.[77] Kombinasi aspirin dengan dipyridamole memberikan perlindungan lebih jauh dengan penurunan risiko tahunan menjadi 9,3%. Cara yang terbaik untuk mencegah terjadinya strok adalah dengan mengidentifikasi orang-orang yang berisiko tinggi dan mengendalikan faktor risiko strok sebanyak mungkin, seperti kebiasaan merokok, hipertensi, dan stenosis di pembuluh karotid,[78] mengatur pola makan yang sehat dan menghindari makanan yang mengandung kolesterol jahat (LDL), serta olaraga secara teratur. Stenosis merupakan efek vasodilasi endotelium yang umumnya disebabkan oleh turunnya sekresi NO oleh sel endotelial, dapat diredam asam askorbat yang meningkatkan sekresi NO oleh sel endotelial melalui lintasan NO sintase atau siklase guanilat, mereduksi nitrita menjadi NO dan menghambat oksidasi LDL[79] di lintasan aterosklerosis. Beberapa institusi kesehatan seperti American Heart Association atau American Stroke Association Council, Council on Cardiovascular Radiology and Intervention memberikan panduan pencegahan yang dimulai dengan penanganan saksama berbagai penyakit yang dapat ditimbulkan oleh aterosklerosis, penggunaan senyawa anti-trombotik untuk kardioembolisme dan senyawa anti-keping darah bagi kasus non-kardioembolisme,[80] diikuti dengan pengendalian faktor risiko seperti arterial dissection, patent foramen ovale, hiperhomosisteinemia, hypercoagulable states, sickle cell disease; cerebral venous sinus thrombosis; strok saat kehamilan, strok akibat penggunaan hormon pasca menopause, penggunaan senyawa anti-koagulan setelah terjadinya cerebral hemorrhage; hipertensi,[81] hipertensi, kebiasaan merokok, diabetes, fibrilasi atrial, dislipidemia, stenosis karotid, obesitas, sindrom metabolisme, konsumsi alkohol berlebihan, konsumsi obat-obatan berlebihan, konsumsi obat kontrasepsi, mendengkur, migrain, peningkatan lipoprotein dan fosfolipase. Biasanya di Indonesia CT Scan dan MRI baru dilakukan, setelah terjadinya strok. Jarang angiography menggunakan kedua alat itu untuk mendeteksi kemungkinan terjadinya strok dilakukan. Sekarang ini sudah mulai banyak laboratorium klinik, klinik strok, pembuluh darah dan penyakit kardiovaskular yang memiliki Transcranial Doppler,[82] karena alatnya kecil/portabel dan relatif murah dengan biaya pemeriksaan menggunakan alat itu hanya sekitar Rp 500.000 atau seperempat sampai seperdelapan biaya penggunaan CT Scan atau MRI. Transcranial doppler tidak seakurat kedua alat yang mahal tersebut, tetapi salah satu keuntungannya, yaitu tidak mengandung radiasi, sehingga dapat dilakukan secara berulang, misalnya untuk pamantauan selama dan sesudah/pascastrok dan juga dapat dilakukan pada pasien yang kritis, tidak sadar, di ruang ICU.[83] Mengingat biayanya yang relatif murah, maka pemantauan kemungkinan terjadinya strok juga sudah banyak dilakukan menggunakan Transcranial doppler, terutama di Amerika Serikat. PenelitianAngioplasty dan stentingAngioplasty dan stenting telah mulai dilirik sebagai kemungkinan pencegahan yang menjanjikan dalam penanganan strok iskemik akut. Intra-cranial stenting yang diterapkan pada gejala penyumbatan stenosis arteri intrakranial, boleh dikatakan sukses mengurangi penyumbatan <50% dengan tingkat keberhasilan 90–98%, dan tingkat komplikasi utama pada peri-procedural berkisar antara 4–10%. Tingkat penyumbatan kembali dan/atau strok yang mengikutinya juga boleh dikatakan minim. Data ini menganjurkan untuk melakukan randomized controlled trial untuk evaluasi lebih lengkap kemungkinan keuntungan perawatan dari usaha pencegahan ini.[84] Thrombectomy mekanis Menghilangkan gumpalan penyumbatan (clot) dapat dicoba, jika ini terjadi pada pembuluh darah besar dan merupakan suatu pilihan bagi mereka yang tidak mempan atau tidak ada perbaikan dengan intravenous thrombolytics.[85] Komplikasi-komplikasi yang mencolok timbul sekitar 7%.[86] Hingga Oktober 2013[update], percobaan-percobaan ini tidak menunjukkan hasil-hasil yang positif.[87] NeuroprotectionObat-obatan yang memakan reactive oxygen species, menolak apoptosis, atau menolak inhibit excitatory neurotransmitters telah memperlihatkan secara eksperimentatif pengurangan kerusakan jaringan yang disebabkan oleh iskemia. Zat-zat yang bekerja dengan cara ini disebut neuroprotective. Hingga akhir-akhit ini, percobaan pada manusia dengan zat neuroprotective telah gagal, dengan kemungkinan perkecualian barbiturate coma yang mendalam. Bagaimanapun, yang terkini NXY-059, derivatif dari disulfonyl yang merupakan the radical-scavengin phenylbutylnitrone, dilaporkan bersifat neuroprotective pada strok.[88] Zat ini tampaknya bekerja pada pelapis pembuluh darah atau endothelium. Sayangnya, setelah percobaan yang pertama berhasil, yang kedua tidak berhasil.[89] Sehingga manfaat NXY-059 masih dipertanyakan.[90] Hyperbaric oxygen therapy telah dipelajari sebagai kemungkinan perlindungan, tetapi akhir-akhir ini dipikirkan bahwa terapi ini tidak memberikan manfaat yang cukup.[91] Catatan
Referensi
Pranala luar
|
||||||||||||||||||||||||||||
