|
Isobutene
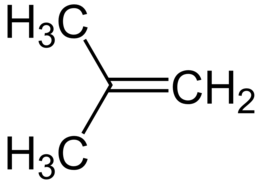
L'isobutene (o isobutilene, nome sistematico 2-metilpropene) è un idrocarburo alifatico, in particolare un alchene ramificato, isomero dell'alchene lineare 1-butene; la sua formula molecolare è (CH3)2C=CH2, a volte scritta anche Me2C=CH2.[2] L'isobutene è una sostanza di notevole interesse industriale.[3] Proprietà e struttura molecolareL'isobutene è un composto leggermente esotermico, ΔHƒ° = -17,9 kJ/mol.[4] A temperatura ambiente è in forma gassosa, anche se tecnicamente è un vapore (Teb = -7,1 °C; Tcr = 144,7 °C), più denso dell'aria (~2 volte). È incolore e ha lieve odore di benzina, è molto infiammabile e con l'aria forma miscele esplosive.[5] È quasi insolubile in acqua (263 mg/L a 25 °C), ma è solubile in alcool e etere, in benzene e in acido solforico.[6] Sotto pressione polimerizza facilmente.[6] Lo scheletro di atomi di carbonio della molecola è planare con simmetria molecolare C2v; i carboni dei gruppi metilici (CH3, o Me) sono ibridati sp3, gli altri due, sp2. Questa molecola idrocarburica è lievemente polare: il suo momento di dipolo è pari a 0,50 D.[7] Da indagini di diffrazione elettronica in fase gassosa sono stati ricavati i dati salienti della struttura molecolare. Dall'analisi dei dati è stato possibile ricavare angoli e lunghezze di legame; alcuni di questi parametri sono i seguenti:[8] r(C–C) = 150,8 pm r(C=C) = 134,2 pm; ∠(CH3–C2–CH3) = 116,0°; ∠(CH3–C2=CH2) = 122,0°; ∠(H–C1–H) = 117,2°. Mentre il legame C=C ha lunghezza quasi normale (134 pm[9]), il legame C–C è significativamente più corto dello standard (154 pm[9]). Questo accorciamento è previsto in base al fenomeno dell'iperconiugazione degli H dei metili con il doppio legame (in una forma limite questo legame è doppio).[10][11] L'angolo tra i metili sul C2 e quello tra gli idrogeni sul C1 (metilene) sono un po' più stretti rispetto al valore ottimale di 120° per un C ibridato sp2. Entrambi questi restringimenti di angoli sono in accordo con le indicazioni VSEPR in base alle quali un doppio legame richiede più spazio angolare di un legame semplice e infatti l'angolo sul C2 tra metile e metilene è invece un po' maggiore dei 120°.[12] SintesiViene prodotto industrialmente per cracking catalitico o termico di frazioni altobollenti del petrolio o di miscele di idrocarburi saturi. Viene isolato e purificato o per assorbimento su acido solforico al 50% e successiva rigenerazione per distillazione in corrente di vapore o per rimozione degli altri buteni isomeri per assorbimento su setacci molecolari. Altri processi di produzione dell'isobutene sono la disidratazione dell'alcol t-butilico e la deidrogenazione catalitica dell'isobutano,[13] che avviene secondo la reazione:  Si stima che nel 2002 la produzione mondiale abbia superato i 10 milioni di tonnellate, concentrata per l'80% negli Stati Uniti, seguiti da Europa e Giappone. Complessi metallo-olefinaDiversi sali metallici, posti in atmosfera di olefine, le assorbono formando complessi π in cui l'olefina si dispone con il legame >C=C< perpendicolare all'asse di legame con il centro metallico.[14] L'argento tetrafluoroborato AgBF4 forma complessi di questo tipo con etilene, propilene e i vari buteni. In particolare, con l'isobutene si ottiene la coordinazione allo ione Ag+ (configurazione elettronica d10) di due molecole:[15] AgBF4 + 2 i-C4H8 → AgBF4 • (i-C4H8)2 Il complesso è piuttosto stabile: a 25 °C la pressione di vapore dell'isobutene dal complesso è di soli 8,83 mm Hg.[15] ApplicazioniL'isobutene non ha applicazioni dirette; trova uso solo come intermedio nella sintesi di altri materiali. Il suo utilizzo principale è come monomero nella produzione del corrispondente polimero; i polimeri e co-polimeri dell'isobutene sono gomme e materie plastiche. Circa il 72% dell'isobutene prodotto viene convertito in gomma butilica; una frazione minore è usata per la produzione di antiossidanti per alimenti, imballi e materie plastiche. Altri impieghi sono nella sintesi di additivi per oli lubrificanti. Combinato con formaldeide dà Isoprenolo, la cui produzione mondiale è stimata sulle 6-13.000 tonnellate.[16] L’isobutene è anche un reagente fondamentale per la protezione del gruppo carbossilico, procedura importante nella sintesi di peptidi e proteine. Note
Altri progetti
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||