外見
不明
一般特性
名称 , 記号 , 番号
オガネソン, Og, 118
分類
貴ガス
族 , 周期 , ブロック
18 , 7 , p
原子量
[294]
電子配置
[Rn ] 5f14 6d10 7s2 7p6 (推定)[ 1]
電子殻
2, 8, 18, 32, 32, 18, 8(推定)[ 1] 画像 )
物理特性
密度 (室温 付近)
(推定)13.65[ 2] 3
沸点
(推定)350 ± 30[ 1] K , (推定)80 ± 30 °C , (推定)170 ± 50 °F
臨界点
(推定)439[ 3] K , 6.8[ 3]
融解熱
(推定)23.5[ 3]
蒸発熱
(推定)19.4[ 3]
原子特性
酸化数
0, +2[ 4] [ 4]
イオン化エネルギー
第1: (推定)975 ± 155[ 1]
第2: (推定)1450[ 5]
原子半径
(推定)152 [ 2]
共有結合半径
(推定)230[ 5]
その他
CAS登録番号
54144-19-3[ 6]
主な同位体
詳細はオガネソンの同位体 を参照
オガネソン (英 : Oganesson )は、元素記号 Og 、原子番号 118の合成元素 である。2002年にロシア連邦 ドゥブナ のドゥブナ合同原子核研究所 で、ロシアとアメリカ合衆国 の科学者の合同チームにより、加速器 によってカリフォルニウム とカルシウム を当てることによって初めて合成された。原子名が決定するまでは一時的な名称 としてウンウンオクチウムが使われた。2015年12月、国際純正・応用化学連合 (IUPAC)と国際純粋・応用物理学連合 (IUPAP)の合同作業部会により、4つの新元素の1つとして承認され、2016年11月28日に正式に命名された[ 8] [ 9]
オガネソンは、既知の元素の中で最大の原子番号および原子量 を持つ。放射性 を持ち非常に不安定であり、2005年以降、わずか5つ(もしかすると6つ)の294 Ogしか検出されていない[ 10] 化合物 等の特徴を調べる実験はほとんど行えていないが、理論計算により、多くの予測がなされている。例えば、オガネソンは第18族元素 であるが、この族の他の全ての元素 (貴ガス )と異なり、非常に反応性が高い[ 11] 標準状態 では気体 であると考えられていたが、現在はいろいろな説があり、固体 であると考えられている[ 11] 液体 という説も有力になりつつあるため結局は何であるかはまだわかっていない。周期表 上ではPブロック元素 であり、かつ第7周期元素 の最後に位置する。
重元素の発見において主導的役割を果たした核物理学 者のユーリイ・オガネシアン を称え、彼にちなんだ名称がつけられた。存命の人物にちなんで元素が命名されたのは、シーボーギウム に次いで2例目であった[ 12] ヘリウム 以外の第18族元素 の語尾が「on」で終わっているため、それに倣っている。
原子番号118番の元素について最初に真剣に考えたのはデンマーク の物理学者ニールス・ボーア であり、1922年に、その元素は周期表上でラドン の下、7つ目の貴ガスとなるであろうと記している[ 13] ドイツ の核化学 者アリスティッド・フォン・グローセ (英語版 ) 安定の島 の存在は理論化されていなかった。ボーアの予測から80年経ってオガネソンの合成には成功したが、それがラドンのより重い同族体として振る舞うかどうか等、化学的性質についてはまだ調べられていない[ 14]
1998年末、ポーランドの物理学者Robert Smolańczuk は、オガネソンを含む超ウラン元素 の合成のための核融合反応 の計算結果を論文として公表した[ 15] 鉛 をクリプトン と融合することでオガネソンを作ることができ、その反応の融合可能性(反応断面積 )は、シーボーギウムを生成する鉛-クロム の反応と同程度であるというものであった。これは、鉛またはビスマス をターゲットとした反応断面積は、生成する元素の原子番号の増加とともに指数関数的に減少するという予測と矛盾するものであった[ 15]
1999年、ローレンス・バークレー国立研究所 の研究者がこの予測を用いてリバモリウム とオガネソンを発見したとPhysical Review Letters 誌で発表し[ 16] サイエンス 誌でその結果が報告された[ 17]
36 86 Kr + 82 208 Pb → 118 293 Og + n 翌年、他の研究所もローレンス・バークレー国立研究所自体もその結果を追試できなかったことが明らかになった後、この論文は取り下げられた[ 18] ヴィクトル・ニノフ の捏造したデータに基づいていたと発表した[ 19] [ 20] [ 21]
オガネソン原子の崩壊が真に最初に観測されたのは、2002年、ドゥブナ合同原子核研究所であった。アルメニア 出身のロシアの核物理学者ユーリイ・オガネシアンに率いられたチームには、ローレンス・リバモア国立研究所 のアメリカ人科学者も含まれていた[ 22] ポロニウム212m のものと一致しているためこの発見はすぐには発表されず、2005年により多くのオガネソンを作った確認実験が行われた後にようやく発表された[ 23] カリホルニウム249 原子とカルシウム48 イオンの衝突により[ 24] [ 25] [ 26] [ 27] [ 28] [ 29] [ 30]
98 249 Cf + 20 48 Ca → 118 294 Og + 3nオガネソン294の放射性崩壊経路[ 30] 非常に起こりにくい融合反応(反応断面積が)であるため、この実験には4か月の時間がかかり、2.5×1019 個ものカルシウムイオンを含むビームが用いられた[ 31] 偽陽性 ではないと信じられている[ 32]
実験では、3つのオガネソン原子のアルファ崩壊 が観測された。直接の自発核分裂 による4番目の崩壊も提案されている。半減期は0.89ミリ秒と計算されており、オガネソン294はリバモリウム290 に崩壊する。まだ3例しか観測されていないため、観測結果に基づく半減期には、0.89+1.07 −0.31 ミリ秒という大きな不確実性がある[ 30]
118 294 Og → 116 290 Lv + 2 4 Heオガネソン294の同定は、キュリウム245 とカルシウム48イオンを衝突させて作ったリバモリウム290と崩壊系列が一致するかどうかを確認することで行われる[ 30] 崩壊生成物 のリバモリウム290は非常に不安定で、14ミリ秒の半減期でフレロビウム286 に崩壊し、さらにこれも自発核分裂 するかコペルニシウム282 にアルファ崩壊する。さらにこれも自発核分裂をする[ 30]
96 245 Cm + 20 48 Ca → 116 290 Lv + 3nトンネル効果 モデルでは、オガネソン294のアルファ崩壊の半減期は0.66+0.23 −0.18 ミリ秒と予測され[ 33] [ 34] [ 35]
2015年12月、IUPACとIUPAPの共同作業部会は元素の発見を確認し、ドゥブナ合同原子核研究所とローレンス・バークレー国立研究所の共同チームに発見の優先権を与えた[ 36] フレロビウム286 の特性をローレンス・バークレー国立研究所で確認したことと、その他のオガネソン294の崩壊系列を2012年にドゥブナ合同原子核研究所で観測したことを考慮したものである。この実験のゴールは、バークリウム249 とカルシウム48の反応によりテネシン294 を合成することであったが、バークリウム249の寿命の短さのために崩壊生成物のカリホルニウム249 が大量に生成し、その結果、テネシンの代わりにオガネソンが合成された[ 37]
2015年10月1日から2016年4月6日まで、ドゥブナ合同原子核研究所では、より重いオガネソンの同位体であるオガネソン295やオガネソン296を作るために、カリホルニウム249、カリホルニウム250、カリホルニウム251の同位体混合物をターゲットとして同様の実験を行った。ビームエネルギーは、252 MeVと258 MeVが用いられた。低いビームエネルギーの方に1原子のみ観測され、崩壊系列は既に観測されたオガネソン294のものと一致した。高いビームエネルギーの方は何も観測されなかった。セクターフレームの糊がターゲットを覆って、蒸発残渣が検出器に達するのを妨げてしまったため、この実験は中止された。この実験は2017年にも行う計画である[ 38] ドイツ のダルムシュタット にある重イオン研究所 が120番元素(ウンビニリウム 、Ubn)を合成する目的でキュリウム248 とクロム54 の反応を行っていたところ、1原子のオガネソン295が観測されたが、実験データの不確実性により、得られたものがウンビニリウム299かオガネソン295かは確定できなかった。このデータからは、オガネソン295の半減期はオガネソン294の0.7ミリ秒より長い181ミリ秒であることが示唆された[ 39]
118番元素は、合成元素発見パイオニアであるユーリイ・オガネシアンにちなんで名づけられた。2017年12月28日には、アルメニアでオガネシアンとOg294の崩壊系列を描いた切手が発売された。 未発見元素に対するメンデレーエフ の命名法に基づき、エカラドンという名称でも知られる[ 40] 系統名 を与え、発見までの間、118番元素はウンウンオクチウム (英 : Ununoctium )と呼ばれ、Uuo という記号[ 41] [ 42] [ 43]
2002年の論文取り下げまで、ローレンス・バークレー国立研究所では、研究所を率いたアルバート・ギオルソ にちなんでギオルシウム(Gh)と名付けるつもりであった[ 44]
ロシアの研究者が2006年にその合成を報告すると、新元素の発見者が名前を提案する権利を持つというIUPACの勧告に従い、命名権を得た[ 45] ゲオルギー・フリョロフ にちなんだフレロビウムと、研究所の位置するモスクワ州 にちなんだモスコビウムの2つの名前の候補があると述べた[ 46] フリョロフ原子核反応研究所 はこの結果を導けた世界で唯一の施設であったことから、この元素にはロシアにちなんだ名前を与えられるべきであるとも述べた[ 47] フレロビウム )と116番元素(モスコビウム)にも提案されたが[ 48] リバモリウム に決まり[ 49] モスコビウム という名前は115番元素に再度提案されて承認された[ 12]
伝統的に、発見時に貴ガスであることが知られていなかったヘリウム を除く全ての貴ガスの名前には、語尾に「オン」("-on")がついている。しかし、発見が承認された当時のIUPACのガイドラインでは、伝統的に語尾が「イン」("-ine")のハロゲン も貴ガスも含め、新元素の名前の語尾は「イウム」("-ium")とすることが要請されていた[ 50] [ 51]
2016年6月、IUPACは、発見者のチームはこの元素の名前について、60年に渡り超ウラン元素の研究のパイオニアであるロシア人核物理学者のユーリイ・オガネシアン にちなんでオガネソンと名付ける意向があると発表した[ 52] [ 12]
モスコビウム、テネシン、オガネソンの命名式典は、2017年3月2日にモスクワのロシア科学アカデミー で行われた[ 53]
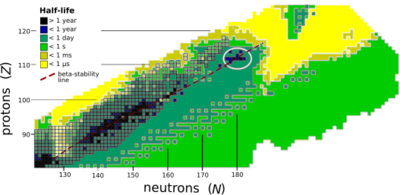
オガネソンは、「安定の島」(白い円)の少し上にあるため、予測よりも若干安定である。 キュリウム 以降の核種の安定性は、原子番号の増加とともに急激に減少する。原子番号101以降の全ての同位体は半減期30時間以内に放射性崩壊する。鉛以降の元素は、安定同位体を持たない[ 54] 陽子 のクーロン力 が大きくなり、長い時間自発核分裂が起こらないように強い力 で原子核 を結び付けておくことができなくなるためである。計算によると、他に安定化因子がない場合には、103以上の陽子を持つ元素は存在できないことになる。しかし、1960年代の研究者は、陽子114個、中性子184個に近い原子核は、この不安定性を弱め、半減期が数千年から数百万年に達するということを提案した。まだ科学はこの島まで辿り着けていないが、オガネソンを含む超重元素の存在によりこの安定効果が真実であることが確認され、既知の核種も予測される島の位置に近い原子核ほど指数関数的に長い寿命を持つ[ 55] [ 56] [ 33] [ 57] [ 58]
トンネル効果モデルを用いた計算により、アルファ崩壊の半減期が1ミリ秒に近く、中性子の多いオガネソンのいくつかの同位体の存在が予測されている[ 59] [ 60]
他の同位体の合成経路や半減期の理論的計算によると、恐らく質量数293、295、296、297、298、300、302等のいくつかの同位体は、合成された質量数294の同位体よりも若干安定であることが示される[ 33] [ 61] [ 33] [ 61] [ 62] チタン50 の衝突による質量数295と296のオガネソンの生成は、2017年から2018年にドゥブナ合同原子核研究所と理化学研究所 で予定されている[ 38] [ 63] [ 64]
オガネソンは原子価 0の18族元素であるが、一般的に18族元素は最外殻のs軌道とp軌道が8つの電子(Heの場合は1s軌道が2つの電子)で埋まっているため、ほとんどの化学反応に対して不活性である。[ 65] 2 7p6 の価電子 配置 の閉殻 を持つと考えられている[ 11]
その結果、閉殻構造を持つ貴ガス、特に周期表の直上にあるラドンと似た性質を持つと考える者もいる[ 66] [ 4] 水銀 のより重いホモログであるフレロビウムやコペルニシウム よりも反応性が高い可能性もある[ 11] [ 11] スピン軌道相互作用 がかなり大きく、オガネソンの閉殻の安定性が著しく低下するからである[ 11] エネルギー準位 と不安定化された7p3/2のエネルギー準位のため[ 67] 電子親和力 を持つ[ 68] [ 69]
オガネソンは、ラドンのほぼ2倍に相当するかなり幅広い分極率 を持つ[ 11] 沸点 は320Kから380Kと推定され[ 11] [ 70] [ 71] [ 11] 単原子 気体であるにも関わらず、最も密度の濃い気体の1つということになる。その高い分極率のため、異常に低いイオン化エネルギー(ラドンの約70%[ 72] [ 73]
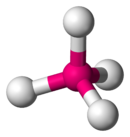
四フッ化キセノン は平面四角形型の分子構造を持つ。四フッ化オガネソン は四面体型の分子構造を持つと予測される。唯一確認されている同位体、オガネソン294は半減期が非常に短いため、化学的な性質は実験的に調べられていない[ 23] [ 40] 酸化数 は0になると考えられるが[ 74] [ 14]
二原子分子 Og2 の計算では、化学結合相互作用はHg2 で計算されるものとほぼ等価であり、また結合解離エネルギー は6 kJ/molでRn2 の約4倍である[ 11] 結合長 がRn2 よりも0.16 Åも短く[ 11] + の結合解離エネルギー(プロトン親和力 )はRnH+ と同程度である[ 11]
OgH中のオガネソンと水素の間の結合は非常に弱いと予測され、真の化学結合というよりは純粋なファンデルワールス力 とみなしうる[ 72] 電気陰性度 が高いことから、例えばコペルニシウムやフレロビウム等よりも安定な原子を作るように考えられる[ 72] 2 やOgF4 が存在しうる[ 75] フッ素 分子の反応によりOgF2 を形成する反応は106 kcal/molのエネルギーを放出し、そのうち約46 kcal/molはこれらの相互作用に由来している[ 72] 2 の場合、形成エネルギー49 kcal/molのうちスピン軌道相互作用の寄与分は約10 kcal/molである[ 72] 4 の四面体形分子構造 を安定化させている。XeF4 やRn4 は平面四角形分子構造 を持つ[ 75] 共有結合 ではなくイオン結合 であり、フッ化オガネソンは不揮発性であると考えられる[ 4] [ 76] 2 は、オガネソンの高い電気陽性度のため、部分的にイオン化していると考えられる[ 77] キセノン とラドンを除く)他の貴ガスと異なり[ 78] [ 79] 塩素 とOg-Cl結合を形成する[ 4] [ 77]
^ a b c d Nash, Clinton S. (2005). “Atomic and Molecular Properties of Elements 112, 114, and 118”. Journal of Physical Chemistry A 109 (15): 3493–3500. doi :10.1021/jp050736o . PMID 16833687 .
^ a b “Oganesson ”. Apsidium. 2008年9月17日時点のオリジナル よりアーカイブ。2008年1月18日 閲覧。
^ a b c d Eichler, R.; Eichler, B., Thermochemical Properties of the Elements Rn, 112, 114, and 118 オリジナル の2011-08-01時点におけるアーカイブ。, https://web.archive.org/web/20110801000000/http://lch.web.psi.ch/files/anrep03/06.pdf 2010年10月23日 閲覧。
^ a b c d e Kaldor, Uzi; Wilson, Stephen (2003). Theoretical Chemistry and Physics of Heavy and Superheavy Elements ISBN 140201371X . https://books.google.co.jp/books?id=0xcAM5BzS-wC&printsec=frontcover&dq=element+118+properties&redir_esc=y&hl=ja#PPA105,M1 2008年1月18日 閲覧。
^ a b Seaborg, Glenn Theodore (1994). Modern Alchemy ISBN 9810214405 . https://books.google.co.jp/books?id=e53sNAOXrdMC&printsec=frontcover&redir_esc=y&hl=ja#PPA172,M1 2008年1月18日 閲覧。
^ “Oganesson: the essentials ”. WebElements Periodic Table. 2017年5月4日 閲覧。 ^ Oganessian, Yu. Ts.; Utyonkov, V.K.; Lobanov, Yu.V.; Abdullin, F.Sh.; Polyakov, A.N.; Sagaidak, R.N.; Shirokovsky, I.V.; Tsyganov, Yu.S.; Voinov, Yu.S.; Gulbekian, G.G.; Bogomolov, S.L.; B. N. Gikal, A. N. Mezentsev, S. Iliev; Subbotin, V.G.; Sukhov, A.M.; Subotic, K; Zagrebaev, V.I.; Vostokin, G.K.; Itkis, M. G.; Moody, K.J; Patin, J.B.; Shaughnessy, D.A.; Stoyer, M.A.; Stoyer, N.J.; Wilk, P.A.; Kenneally, J.M.; Landrum, J.H.; Wild, J.H.; and Lougheed, R.W. (2006-10-09). “Synthesis of the isotopes of elements 118 and 116 in the 249 Cf and 245 Cm+48 Ca fusion reactions” . Physical Review C74 (4): 044602. doi :10.1103/PhysRevC.74.044602 . http://link.aps.org/abstract/PRC/v74/e044602 2008年1月18日 閲覧。 ^ Staff (30 November 2016). “IUPAC Announces the Names of the Elements 113, 115, 117, and 118” . IUPAC . https://iupac.org/iupac-announces-the-names-of-the-elements-113-115-117-and-118/ 1 December 2016 閲覧。 ^ St. Fleur, Nicholas (1 December 2016). “Four New Names Officially Added to the Periodic Table of Elements” . New York Times . https://www.nytimes.com/2016/12/01/science/periodic-table-new-elements.html 1 December 2016 閲覧。 ^ “The Top 6 Physics Stories of 2006 ”. Discover Magazine (7 January 2007). 18 January 2008 閲覧。 ^ a b c d e f g h i j k l Nash, Clinton S. (2005). "Atomic and Molecular Properties of Elements 112, 114, and 118". Journal of Physical Chemistry A. 109 (15): 3493–3500. Bibcode:2005JPCA..109.3493N . doi:10.1021/jp050736o . PMID 16833687 .
^ a b c “IUPAC Is Naming The Four New Elements Nihonium, Moscovium, Tennessine, And Oganesson ”. IUPAC (2016年6月8日). 2016年6月8日 閲覧。
^ Leach, Mark R.. “The INTERNET Database of Periodic Tables ”. 8 July 2016 閲覧。 ^ a b Fricke, Burkhard (1975). "Superheavy elements: a prediction of their chemical and physical properties" . Recent Impact of Physics on Inorganic Chemistry. 21: 89–144. doi:10.1007/BFb0116498 . Retrieved 4 October 2013.
^ a b Smolanczuk, R. (1999). “Production mechanism of superheavy nuclei in cold fusion reactions”. Physical Review C59 (5): 2634–2639. Bibcode : 1999PhRvC..59.2634S . doi :10.1103/PhysRevC.59.2634 .
^ Ninov, Viktor (1999). “Observation of Superheavy Nuclei Produced in the Reaction of 86 Kr with 208 Pb”. Physical Review Letters 83 (6): 1104–1107. Bibcode : 1999PhRvL..83.1104N . doi :10.1103/PhysRevLett.83.1104 . ^ Service, R. F. (1999). “Berkeley Crew Bags Element 118”. Science 284 (5421): 1751. doi :10.1126/science.284.5421.1751 . ^ Public Affairs Department (21 July 2001). “Results of element 118 experiment retracted” . Berkeley Lab. http://enews.lbl.gov/Science-Articles/Archive/118-retraction.html 18 January 2008 閲覧。 ^ Dalton, R. (2002). “Misconduct: The stars who fell to Earth”. Nature 420 (6917): 728–729. Bibcode : 2002Natur.420..728D . doi :10.1038/420728a . PMID 12490902 . ^ Element 118 disappears two years after it was discovered . Physicsworld.com. Retrieved on 2 April 2012.^ Zagrebaev, Valeriy; Karpov, Alexander; Greiner, Walter (2013). “Future of superheavy element research: Which nuclei could be synthesized within the next few years?” . Journal of Physics (IOP Publishing Ltd) 420 : 012001. arXiv :1207.5700 . doi :10.1088/1742-6596/420/1/012001 . http://nrv.jinr.ru/pdf_file/J_phys_2013.pdf . ^ Oganessian, Yu. T. (2002). “Results from the first 249 Cf48 Ca . JINR Communication (JINR, Dubna). http://www.jinr.ru/publish/Preprints/2002/287(D7-2002-287)e.pdf . ^ a b Moody, Ken. “Synthesis of Superheavy Elements”. In Schädel, Matthias; Shaughnessy, Dawn. The Chemistry of Superheavy Elements (2nd ed.). Springer Science & Business Media. pp. 24–8. ISBN 9783642374661
^ “Livermore scientists team with Russia to discover element 118” . Livermore press release. (3 December 2006). https://www.llnl.gov/news/newsreleases/2006/NR-06-10-03.html 18 January 2008 閲覧。 ^ Oganessian, Yu. T. (2006). “Synthesis and decay properties of superheavy elements”. Pure Appl. Chem. 78 (5): 889–904. doi :10.1351/pac200678050889 . ^ Sanderson, K. (2006). “Heaviest element made – again”. Nature News (Nature). doi :10.1038/news061016-4 . ^ Schewe, P. (17 October 2006). “Elements 116 and 118 Are Discovered ”. Physics News Update . American Institute of Physics. 1 January 2012時点のオリジナル よりアーカイブ。18 January 2008 閲覧。 ^ Weiss, R. (17 October 2006). “Scientists Announce Creation of Atomic Element, the Heaviest Yet ”. Washington Post. 18 January 2008 閲覧。 ^ Oganessian, Yu. T. (2002年). “Element 118: results from the first 249 Cf48 Ca ”. Communication of the Joint Institute for Nuclear Research. 2011年7月22日時点のオリジナル よりアーカイブ。2018年12月29日 閲覧。 ^ a b c d e Oganessian, Yu. Ts.; Utyonkov, V. K.; Lobanov, Yu. V.; Abdullin, F. Sh.; Polyakov, A. N.; Sagaidak, R. N.; Shirokovsky, I. V.; Tsyganov, Yu. S.; et al. (2006-10-09). "Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions" . Physical Review C. 74 (4): 044602. Bibcode:2006PhRvC..74d4602O . doi:10.1103/PhysRevC.74.044602 . Retrieved 2008-01-18.
^ “Ununoctium ”. WebElements Periodic Table. 2007年12月9日 閲覧。 ^ Jacoby, Mitch (17 October 2006). “Element 118 Detected, With Confidence” . Chemical & Engineering News . https://pubs.acs.org/cen/news/84/i43/8443element118.html 18 January 2008 閲覧 ^ a b c d Chowdhury, Roy P.; Samanta, C.; Basu, D. N. (2006). “α decay half-lives of new superheavy elements”. Phys. Rev. C 73 : 014612. arXiv :nucl-th/0507054 . Bibcode : 2006PhRvC..73a4612C . doi :10.1103/PhysRevC.73.014612 .
^ Oganessian, Yu. Ts.; Utyonkov, V.; Lobanov, Yu.; Abdullin, F.; Polyakov, A.; Shirokovsky, I.; Tsyganov, Yu.; Gulbekian, G. et al. (2004). “Measurements of cross sections and decay properties of the isotopes of elements 112, 114, and 116 produced in the fusion reactions 233,238 U, 242 Pu, and 248 Cm+48 Ca”. Physical Review C 70 (6): 064609. Bibcode : 2004PhRvC..70f4609O . doi :10.1103/PhysRevC.70.064609 . ^ Samanta, C.; Chowdhury, R. P.; Basu, D.N. (2007). “Predictions of alpha decay half-lives of heavy and superheavy elements”. Nucl. Phys. A 789 : 142–154. arXiv :nucl-th/0703086 . Bibcode : 2007NuPhA.789..142S . doi :10.1016/j.nuclphysa.2007.04.001 . ^ Discovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118 . IUPAC (30 December 2015)^ Karol, Paul J.; Barber, Robert C.; Sherrill, Bradley M.; Vardaci, Emanuele; Yamazaki, Toshimitsu (29 December 2015). “Discovery of the element with atomic number Z = 118 completing the 7th row of the periodic table (IUPAC Technical Report)” . Pure Appl. Chem. 88 (1–2): 155–160. doi :10.1515/pac-2015-0501 . https://www.degruyter.com/downloadpdf/j/pac.2016.88.issue-1-2/pac-2015-0501/pac-2015-0501.pdf 2 April 2016 閲覧。 ^ a b Voinov, A. A.; Oganessian, Yu. Ts; Abdullin, F. Sh.; Brewer, N. T.; Dmitriev, S. N.; Grzywacz, R. K.; Hamilton, J. H.; Itkis, M. G.; Miernik, K.; Polyakov, A. N.; Roberto, J. B.; Rykaczewski, K. P.; Sabelnikov, A. V.; Sagaidak, R. N.; Shriokovsky, I. V.; Shumeiko, M. V.; Stoyer, M. A.; Subbotin, V. G.; Sukhov, A. M.; Tsyganov, Yu. S.; Utyonkov, V. K.; Vostokin, G. K. (2016). "Results from the Recent Study of the 249–251 Cf + 48 Ca Reactions". In Peninozhkevich, Yu. E.; Sobolev, Yu. G. (eds.). Exotic Nuclei: EXON-2016 Proceedings of the International Symposium on Exotic Nuclei . Exotic Nuclei. pp. 219–223. ISBN 9789813226555
^ Hofmann, S.; Heinz, S.; Mann, R.; Maurer, J.; Münzenberg, G.; Antalic, S.; Barth, W.; Burkhard, H. G.; Dahl, L.; Eberhardt, K.; Grzywacz, R.; Hamilton, J. H.; Henderson, R. A.; Kenneally, J. M.; Kindler, B.; Kojouharov, I.; Lang, R.; Lommel, B.; Miernik, K.; Miller, D.; Moody, K. J.; Morita, K.; Nishio, K.; Popeko, A. G.; Roberto, J. B.; Runke, J.; Rykaczewski, K. P.; Saro, S.; Schneidenberger, C.; Schött, H. J.; Shaughnessy, D. A.; Stoyer, M. A.; Thörle-Pospiech, P.; Tinschert, K.; Trautmann, N.; Uusitalo, J.; Yeremin, A. V. (2016). "Remarks on the Fission Barriers of SHN and Search for Element 120". In Peninozhkevich, Yu. E.; Sobolev, Yu. G. Exotic Nuclei: EXON-2016 Proceedings of the International Symposium on Exotic Nuclei. Exotic Nuclei. pp. 155–164. ISBN 9789813226555 .
^ a b Grosse, A. V. (1965). "Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em)". Journal of Inorganic and Nuclear Chemistry. Elsevier Science Ltd. 27 (3): 509–19. doi:10.1016/0022-1902(65)80255-X
^ Chatt, J. (1979). “Recommendations for the Naming of Elements of Atomic Numbers Greater than 100”. Pure Appl. Chem. 51 (2): 381–384. doi :10.1351/pac197951020381 . ^ Wieser, M.E. (2006). “Atomic weights of the elements 2005 (IUPAC Technical Report)”. Pure Appl. Chem. 78 (11): 2051–2066. doi :10.1351/pac200678112051 . ^ Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). "Transactinides and the future elements". In Morss; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (3rd ed.). Dordrecht, The Netherlands: Springer Science+Business Media . ISBN 1-4020-3555-1 .
^ “Discovery of New Elements Makes Front Page News ”. Berkeley Lab Research Review Summer 1999 (1999年). 18 January 2008 閲覧。 ^
Koppenol, W. H. (2002). “Naming of new elements (IUPAC Recommendations 2002)” . Pure and Applied Chemistry 74 (5): 787. doi :10.1351/pac200274050787 . http://media.iupac.org/publications/pac/2002/pdf/7405x0787.pdf .
^ “New chemical elements discovered in Russia`s Science City ” (12 February 2007). 9 February 2008 閲覧。 ^ Yemel'yanova, Asya (17 December 2006). “118-й элемент назовут по-русски (118th element will be named in Russian) ” (Russian). vesti.ru. 18 January 2008 閲覧。 ^ “Российские физики предложат назвать 116 химический элемент московием (Russian Physicians Will Suggest to Name Element 116 Moscovium) ” (Russian). rian.ru (2011年). 8 May 2011 閲覧。 ^ “News: Start of the Name Approval Process for the Elements of Atomic Number 114 and 116 ”. International Union of Pure and Applied Chemistry . 23 August 2014時点のオリジナル よりアーカイブ。2 December 2011 閲覧。 ^ Koppenol, W. H. (2002). “Naming of new elements (IUPAC Recommendations 2002)” . Pure and Applied Chemistry 74 (5): 787–791. doi :10.1351/pac200274050787 . http://media.iupac.org/publications/pac/2002/pdf/7405x0787.pdf . ^ Koppenol, Willem H.; Corish, John; García-Martínez, Javier; Meija, Juris; Reedijk, Jan (2016). “How to name new chemical elements (IUPAC Recommendations 2016)”. Pure and Applied Chemistry 88 (4). doi :10.1515/pac-2015-0802 . ^ “What it takes to make a new element” . Chemistry World . https://www.chemistryworld.com/what-it-takes-to-make-a-new-element/1017677.article 2016年12月3日 閲覧。 ^ Fedorova, Vera (3 March 2017). “At the inauguration ceremony of the new elements of the Periodic table of D.I. Mendeleev ”. jinr.ru . Joint Institute for Nuclear Research. 4 February 2018 閲覧。 ^ de Marcillac, P.; Coron, N.; Dambier, G.; Leblanc, J.; Moalic, J.-P. (2003). “Experimental detection of α-particles from the radioactive decay of natural bismuth”. Nature 422 (6934): 876–878. Bibcode : 2003Natur.422..876D . doi :10.1038/nature01541 . PMID 12712201 . ^ Considine, G. D.; Kulik, Peter H. (2002). Van Nostrand's scientific encyclopedia (9th ed.). Wiley-Interscience. ISBN 978-0-471-33230-5 . OCLC 223349096 ^ Oganessian, Yu. Ts.; Sobiczewski, A.; Ter-Akopian, G. M. (9 January 2017). “Superheavy nuclei: from predictions to discovery”. Physica Scripta 92 : 023003-1–21. doi :10.1088/1402-4896/aa53c1 . ^ Oganessian, Yu. T. (2007). “Heaviest nuclei from 48 Ca-induced reactions”. Journal of Physics G: Nuclear and Particle Physics 34 (4): R165–R242. Bibcode : 2007JPhG...34..165O . doi :10.1088/0954-3899/34/4/R01 . ^ “New Element Isolated Only Briefly ”. The Daily Californian (18 October 2006). 23 August 2014時点のオリジナル よりアーカイブ。18 January 2008 閲覧。 ^ Chowdhury, Roy P.; Samanta, C.; Basu, D. N. (2008). “Search for long lived heaviest nuclei beyond the valley of stability”. Physical Review C 77 (4): 044603. arXiv :0802.3837 . Bibcode : 2008PhRvC..77d4603C . doi :10.1103/PhysRevC.77.044603 . ^ Chowdhury, R. P.; Samanta, C.; Basu, D.N. (2008). “Nuclear half-lives for α -radioactivity of elements with 100 ≤ Z ≤ 130”. Atomic Data and Nuclear Data Tables 94 (6): 781–806. arXiv :0802.4161 . Bibcode : 2008ADNDT..94..781C . doi :10.1016/j.adt.2008.01.003 . ^ a b Royer, G.; Zbiri, K.; Bonilla, C. (2004). “Entrance channels and alpha decay half-lives of the heaviest elements”. Nuclear Physics A 730 (3–4): 355–376. arXiv :nucl-th/0410048 . Bibcode : 2004NuPhA.730..355R . doi :10.1016/j.nuclphysa.2003.11.010 .
^ Duarte, S. B.; Tavares, O. A. P.; Gonçalves, M.; Rodríguez, O.; Guzmán, F.; Barbosa, T. N.; García, F.; Dimarco, A. (2004). “Half-life predictions for decay modes of superheavy nuclei” . Journal of Physics G: Nuclear and Particle Physics 30 (10): 1487–1494. Bibcode : 2004JPhG...30.1487D . doi :10.1088/0954-3899/30/10/014 . https://inis.iaea.org/collection/NCLCollectionStore/_Public/36/073/36073846.pdf . ^ Sychev, Vladimir (8 February 2017). “Юрий Оганесян: мы хотим узнать, где кончается таблица Менделеева [Yuri Oganessian: we want to know where the Mendeleev table ends]” (Russian). RIA Novosti . https://ria.ru/interview/20170208/1487412085.html 31 March 2017 閲覧。 ^
Roberto, J. B. (31 March 2015). “Actinide Targets for Super-Heavy Element Research ”. cyclotron.tamu.edu . Texas A & M University. 28 April 2017 閲覧。
^ Bader, Richard F.W. “An Introduction to the Electronic Structure of Atoms and Molecules ”. McMaster University. 18 January 2008 閲覧。 ^ “Ununoctium (Uuo) – Chemical properties, Health and Environmental effects ”. Lenntech. 16 January 2008時点のオリジナル よりアーカイブ。18 January 2008 閲覧。 ^ Landau, Arie; Eliav, Ephraim; Ishikawa, Yasuyuki; Kador, Uzi (25 May 2001). “Benchmark calculations of electron affinities of the alkali atoms sodium to eka-francium (element 119)” . Journal of Chemical Physics 115 (6): 2389–92. Bibcode : 2001JChPh.115.2389L . doi :10.1063/1.1386413 . https://www.researchgate.net/profile/Ephraim_Eliav2/publication/234859102_Benchmark_calculations_of_electron_affinities_of_the_alkali_atoms_sodium_to_eka-francium_(element_119)/links/00b4951b1c7eb49ffc000000.pdf 15 September 2015 閲覧。 ^ Goidenko, Igor; Labzowsky, Leonti; Eliav, Ephraim; Kaldor, Uzi; Pyykkö, Pekka (2003). “QED corrections to the binding energy of the eka-radon (Z=118) negative ion”. Physical Review A 67 (2): 020102(R). Bibcode : 2003PhRvA..67b0102G . doi :10.1103/PhysRevA.67.020102 . ^ Eliav, Ephraim; Kaldor, Uzi; Ishikawa, Y.; Pyykkö, P. (1996). “Element 118: The First Rare Gas with an Electron Affinity”. Physical Review Letters 77 (27): 5350–5352. Bibcode : 1996PhRvL..77.5350E . doi :10.1103/PhysRevLett.77.5350 . PMID 10062781 . ^ Seaborg, Glenn Theodore (1994). Modern Alchemy . World Scientific. p. 172. ISBN 981-02-1440-5 ^ Takahashi, N. (2002). “Boiling points of the superheavy elements 117 and 118”. Journal of Radioanalytical and Nuclear Chemistry 251 (2): 299–301. doi :10.1023/A:1014880730282 . ^ a b c d e Han, Young-Kyu; Bae, Cheolbeom; Son, Sang-Kil; Lee, Yoon Sup (2000). "Spin–orbit effects on the transactinide p-block element monohydrides MH (M=element 113–118)". Journal of Chemical Physics. 112 (6): 2684. Bibcode:2000JChPh.112.2684H . doi:10.1063/1.480842
^ Nash, Clinton S.; Bursten, Bruce E. (1999). “Spin-Orbit Effects, VSEPR Theory, and the Electronic Structures of Heavy and Superheavy Group IVA Hydrides and Group VIIIA Tetrafluorides. A Partial Role Reversal for Elements 114 and 118”. Journal of Physical Chemistry A 1999 (3): 402–410. Bibcode : 1999JPCA..103..402N . doi :10.1021/jp982735k . ^ “Ununoctium: Binary Compounds ”. WebElements Periodic Table. 18 January 2008 閲覧。 ^ a b Han, Young-Kyu; Lee, Yoon Sup (1999). “Structures of RgFn (Rg = Xe, Rn, and Element 118. n = 2, 4.) Calculated by Two-component Spin-Orbit Methods. A Spin-Orbit Induced Isomer of (118)F4 ”. Journal of Physical Chemistry A 103 (8): 1104–1108. Bibcode : 1999JPCA..103.1104H . doi :10.1021/jp983665k .
^ Pitzer, Kenneth S. (1975). “Fluorides of radon and element 118”. Journal of the Chemical Society, Chemical Communications (18): 760–761. doi :10.1039/C3975000760b . ^ a b Seaborg, Glenn Theodore (c. 2006). “transuranium element (chemical element) ”. Encyclopædia Britannica. 16 March 2010 閲覧。
^ 张青莲 (November 1991) (中国語). Beijing: Science Press. pp. P72. ISBN 7-03-002238-6 ^ Proserpio, Davide M.; Hoffmann, Roald; Janda, Kenneth C. (1991). “The xenon-chlorine conundrum: van der Waals complex or linear molecule?”. Journal of the American Chemical Society 113 (19): 7184. doi :10.1021/ja00019a014 .
Scerri, Eric (2007). The Periodic Table, Its Story and Its Significance . New York: Oxford University Press. ISBN 978-0-19-530573-9
Element 118: experiments on discovery , archive of discoverers' official web pageIt's Elemental: Oganesson Oganesson at The Periodic Table of Videos (University of Nottingham)On the Claims for Discovery of Elements 110, 111, 112, 114, 116, and 118 (IUPAC Technical Report) "Element 118, Heaviest Ever, Reported for 1,000th of a Second ", NYTimes.com.
WebElements: Oganesson 『オガネソン 』 - コトバンク