|
Κυκλοπεντάνιο
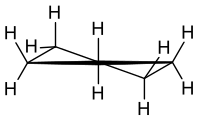
Το κυκλοπεντάνιο[2] (αγγλικά Cyclopentane) είναι οργανική χημική ένωση, που περιέχει άνθρακα και υδρογόνο, δηλαδή είναι υδρογονάνθρακας, με μοριακό τύπο C5H10. Πιο συγκεκριμένα, είναι ένας αλεικυκλικός υδρογονάνθρακας . Δομικά, κάθε μόριό του αποτελείται από ένα δακτύλιο που αποτελείται από πέντε (5) άτομα άνθρακα, το καθένα από τα οποία συνδέεται με δύο (2) άτομα υδρογόνου. Το κυκλοπεντάνιο ανήκει στην ομόλογη σειρά των κυκλοαλκανίων, δηλαδή των κορεσμένων υδρογονανθράκων με ένα δακτύλιο. Ο όρος επεικτείνεται και πέρα της «μητρικής» ένωσης, και σε μια σειρά «θυγατρικών» παραγώγων αυτής, που, μαζί με τη «μητρική», ονομάζονται συλλήβδην «κυκλοπεντάνια». ΙστορίαΠαράχθηκε για πρώτη φορά το 1893 από το Γερμανό χημικό Γιοχάνες Βισλικένους (Johannes Wislicenus).[3] Φυσική παρουσίαΤο κυκλοπεντάνιο εμφανίζεται ως συστατικό του αργού πετρελαίου. Δομή κυκλοπεντανίων«Κυκλοπεντάνια» ονομάζονται τα κυκλοαλκάνια με (έναν τουλάχιστον) πενταμελή δακτύλιο, που αποτελεί και το χαρακτηριστικό της δομής τους. Οι πλευρικές αλυσίδες, όταν υπάρχουν, διαμορφώνονται όπως στα αλκάνια. Ο γραμμικός τύπος που χρησιμοποιείται δεν αντικατοπτρίζει την «πραγματική» μοριακή δομή των κυκλοπεντανίων. Τα πέντε (5) ανθρακοάτομα του δακτυλίου δεν είναι συνεπίπεδα. Το άτομο άνθρακα (και οι υποκαταστάτες του) που βρίσκεται σε σχετικά υπερυψωμένη θέση και τα υπόλοιπα στις σχετικά χαμηλότερες δεν παραμένουν σταθερά εκεί, αλλά στις θέσεις αυτές εναλλάσσονται. Αυτό το φαινόμενο της εσωτερικής μοριακής κίνησης ονομάζεται «ψευδοπεριστροφή» (pseudorotation). Οι ενεργειακά ευνοϊκές διαμορφώσεις είναι η διαμόρφωση «φακέλου» (envelope) και «ημιανάκλιντρου» (half-chair), όπως αποδείχθηκε από πειράματα περίθλασης ηλεκτρονίων: Στη δομή αυτή προκύπτουν δεσμικές γωνίες με μέσο όρο 105° < 109° 28΄, που είναι η συνηθισμένη γωνία δεσμού σ (2sp³-2sp³) που αντιστοιχεί σε κορεσμένο, οπότε προκύπτει «ενέργεια τάσης δεσμών», όπως στα κυκλοπροπάνια, αλλά πολύ μικρότερη: Υπολογίστηκε ότι ανέρχεται σε ΔQ = 29 kJ/mole[4]. Αποτέλεσμα των παραπάνω είναι τα κυκλοπεντάνια να μη δείνουν αντιδράσεις κυκλοδιάνοιξης, γιατί σ' αυτά η ενέργεια τάσης δεσμών είναι ανεπαρκής. ΠαραγωγήΒιομηχανικά παράγεται με απομόνωσή του από το αργό πετρέλαιο, με πυρόλυση κυκλοεξανίου, παρουσία αλουμίνας (Al2O3) ως καταλύτη, ή και με καταλυτική αναμόρφωση μεθυλοβουτανίου, με τη χρήση λευκοχρύσου ως καταλύτη. Σημειώνεται ότι το κυκλοπεντάνιο έχει μεγαλύτερο βαθμό οκτανίου (141) και από το κυκλοεξάνιο (με βαθμό οκτανίου 110) και από το μεθυλοβουτάνιο (με βαθμό οκτανίου 99). Εναλλακτικές μέθοδοιΜε θέρμανση αλάτων δικαρβονικών οξέων με Ca ή BaΚατά τη θέρμανση εξανοδιικού ασβεστίου ή εξανοδιικού βαρίου παίρνουμε κυκλοπεντανόνη. Στη συνέχεια αυτή ανάγεται προς το κυκλοπεντάνιο. Π.χ. υδροξείδιο του ασβεστίου [Ca(OH)2][5]: Με διαμοριακή συμπύκνωση διεστέρων δικαρβονικών οξέωνΗ διαμοριακή συμπύκνωση δύο διεστέρων δικαρβονικών οξέων, από τους οποίους ο ένας είναι του οξαλικού οξέως και ο άλλος του πεντανοδιικού οξέος, γίνεται με επίδραση μεταλλικού νατρίου. Με τον τρόπο αυτό σχηματίζεται δικετοδικαρβοξυλικός διεστέρας με πενταμελή δακτύλιο. Στη συνέχεια αυτός ανάγεται προς σαπωνοποείται προς το αντίστοιχο δικαρβονικό άλας. Το τελευταίο διαποκαρβοξυλιώνεται προς την αντίστοιχη κυκλοδικετόνη, που τελικά ανάγεται προς το αντίστοιχο κυκλοαλκάνιο[6]:
Πενταμελής δακτύλιος με αντίδραση Pauson-KhandΚατά την επίδραση αλκινίων και μονοξειδίου του άνθρακα σε αλκένια έχουμε την ονομαζόμενη αντίδραση Pauson-Khand η οποία στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων κυκλοπεντενόνης, τα οποία στη συνέχεια ανάγονται σε κυκλοπεντάνια. Π.χ. με αιθένιο και αιθίνιο παράγεται κυκλοπεντεν-2-όνη[7][8]: Φυσικοχημικές ιδιότητεςΤο χημικά καθαρό κυκλοπεντάνιο, υπό κανονική πίεση 1 atm, πήζει στους -94 °C και βράζει στους 49 °C. Είναι πρακτικά αδιάλυτο στο νερό, αλλά είναι αναμίξιμο με πολλούς οργανικούς διαλύτες. Έχει τάση ατμών 34,6 kPa στους 20 °C. Στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, το κυκλοπεντάνιο είναι ένα άχρωμο πτητικό και ιδιαίτερα εύφλεκτο υγρό, της οποίας είναι ιδιαίτερα επιθυμητό συστατικό, αφού το χημικά καθαρό κυκλοπεντάνιο έχει βαθμό οκτανίου 141.[9] Η ελάχιστη θερμοκρασία ανάφλεξής του είναι -51 °C, ενώ η θερμοκρασία αυτανάφλεξής του είναι 320 ° C.[10] Χημικές ιδιότητες
Οξείδωση1. Όπως όλα τα κυκλοαλκάνια, το κυκλοπεντάνιο με περίσσεια οξυγόνου καίγεται προς διοξείδιο του άνθρακα (CO2) και νερό (H2O)[12][13]:
2. Παραγωγή υδραερίου: 3. Καταλυτική οξείδωση προς κυκλοπεντανόνη: Αλογόνωση
Ανάλυση του μηχανισμού της χλωρίωσης του κυκλοπεντανίου:
Επίδραση καρβενίων
Νίτρωση
Βιομηχανικές εφαρμογέςΑπό τη δεκαετία του 1990, κυκλοπεντάνιο (προαιρετικά αναμεμιγμένο με τα άλλα ισομερή του ή και με υδρογονάνθρακες C4) χρησιμοποιείται επίσης ως φυσικός παράγοντας εμφύσησης στην παραγωγή άκαμπτων αφρών πολυουρεθάνης. Η πλειοψηφία των νεότερων οικιακών ψυγείων που διατίθενται στη Γερμανία (και όχι μόνο) περιέχουν μεθυλοβουτάνιο ως ψυκτικό μέσο και το κυκλοπεντάνιο ως προωθητικό αέριο αφρού. Το κυκλοπεντάνιο χρησιμοποιήθηκε για την παραγωγή (σχετικά) «οικολογικό» ψυκτικού υγρού σε οικιακά ψυγεία και καταψύκτες, αντικαθιστώντας ψυκτικά τύπου φρεόν όπως τα CFC-11 και HCFC-14b[21]. Χρησιμοποιήθηκε, ακόμη, ως πρόδρομη ένωση για την παραγωγή κυκλοπεντανόνης, μετά από καταλυτική οξείδωση.[22] Πιο προχωρημένες τεχνολογίες, όπως είναι οι σκληροί δίσκοι ηλεκτρονικών υπολογιστών και κάποια είδη διαστημικού εξοπλισμού, χρησιμοποιούν πολυαλκυλιωμένα παράγωγα κυκλοπεντανίου, (MAC, MultiAlcylated Cyclopentane) ως λιπαντικά, επειδή έχουν πολύ χαμηλή πτητικότητα[23]. Στις ΗΠΑ παράγονται πάνω από 500.000 τόνοι κυκλοπεντανίου το χρόνο. Οδηγίες ασφαλείαςΤο (υγρό) κυκλοπεντάνιο είναι (σχετικά) ελαφρά εύφλεκτο και ελαφρά επικίνδυνο για τους υδρόβιους οργανισμούς (WGK 1). Οι ατμοί του, όμως, σχηματίζουν πολύ εύφλεκτα μείγματα με τον αέρα, εξαιτίας της χαμηλής θερμοκρασίας βρασμού του (49 °C) και της χαμηλής ελάχιστης θερμοκρασίας ανάφλεξης (-51 °C). Το εκρηκτικό εύρος κυμαίνεται μεταξύ 1,5 και 8,7% κατ' όγκο.[10] Η ελάχιστη ενέργεια ανάφλεξης της ένωσης ανέρχεται σε 0,24 mJoule, με αποτέλεσμα τα μείγματα κυκλοπεντανίου - υδρατμών να είναι ιδιαίτερα αναφλέξιμα.[24][25] Η έκθεση ανθρώπων σε υψηλές συγκεντρώσεις κυκλοπεντανίου μπορούν να οδηγήσει σε αναισθησία. Αναφορές και σημειώσεις
Πηγές
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


















![{\displaystyle \mathrm {+5H_{2}O{\xrightarrow[{700-1100^{o}C}]{Ni}}5CO+10H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/16b89a274d7cf46b74a02ef8308163c6ef57a1e9)
![{\displaystyle \mathrm {+O_{2}{\xrightarrow[{\triangle }]{Cu}}H_{2}O+} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ad0e766c90ff9dd6d78efd9e1c5ab564423ca9e)
![{\displaystyle \mathrm {+X_{2}{\xrightarrow[{\triangle }]{UV}}HX+} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/32d971c77e4c7bf3933a6b8058fff314dd3f149a)

![{\displaystyle \mathrm {Cl_{2}{\xrightarrow[{\triangle }]{UV}}2Cl^{\bullet }-239kJ} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/73fe9c8e7397e9e50d5b5a7ea91a25e26bed2f96)










