|
Ceratocisto odontogênico
Ceratocisto odontogênico (CO) ou queratocisto odontogênico (QO) é um cisto odontogênico do desenvolvimento localmente agressivo.[1] Acredita-se que sua origem esteja na lâmina dentária e afeta mais frequentemente a mandíbula posterior.[1] O QO foi inicialmente descrito por Philipsen em 1956 e classificado como um cisto de origem odontogênica. Em 2005, o QO foi renomeado tumor queratocístico odontogênico e classificado pela OMS como uma neoplasia odontogênica.[2] Porém, em 2017 o QO foi reclassificado como cisto e voltou à sua nomenclatura original, onde permanece atualmente.[2][3] Sinais e sintomasO QO é tipicamente assintomático, mas pode apresentar sinais e sintomas como:[4]
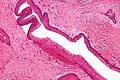
Devido ao seu padrão de crescimento anteroposterior, ele raramente causa expansão óssea, o que o torna difícil de identificar clinicamente.[4] Aspectos radiográficos e histológicos Radiograficamente, o QO se caracteriza como uma lesão radiolúcida uni ou multilocular, de bordas bem delimitadas e halo esclerótico, podendo ou não estar associada a um dente incluso.[4] Lesões maiores tendem a ter um aspecto multicístico festonado (aspecto de "bolha de sabão" ou de "favo de mel"), enquanto lesões menores tendem a ser unicísticas.[4] As lesões podem apresentar comportamento agressivo, com reabsorção óssea e dos dentes, deslocamento dos dentes e expansões ósseas.[5] Cerca de 25 a 40% dos queratocistos são associados a dentes inclusos.[4] Queratocistos menores podem ser confundidos com cisto dentígero, cisto radicular ou cisto periodontal lateral.[6] Na tomografia computadorizada de feixe cônico (TCFC), o QO e o ameloblastoma possuem radiodensidades muito semelhantes, mas o ameloblastoma apresenta expansão da cortical óssea e poucas áreas de alta densidade tecidual.[7] Histologicamente, o QO é caracterizado como uma cavidade cística revestida por uma camada fina de epitélio estratificado escamoso paraqueratinizado, com uma camada basal de células cuboidais ou colunares hipercromáticas em paliçada[4][5]. A queratina na superfície possui um aspecto corrugado característico.[4]
CausasO QO surge a partir de restos epiteliais da lâmina dentária, e seu crescimento está relacionado a fatores ainda desconhecidos, sejam eles ineres ao próprio epitélio ou à atividade enzimática na parede cística.[8] Sabe-se que há influência genética no seu crescimento, pela mutação ou inativação do gene PTCH1 presente nos queratocistos.[2][3][8] Em 2005, a lesão foi classificada como um tumor pela presença dessa mutação no gene PTCH1 e pelo seu crescimento agressivo e com recidiva.[2] Entretanto, ele responde bem à descompressão/marsupialização, o que indica ausência de crescimento autônomo, um ponto que vai contra a teoria de que o QO é uma neoplasia.[9] Apesar disso, o consenso atual na literatura, defendido pela OMS, é de que não há evidências suficientes para que ele seja classificado como neoplasia.[2][3] Além do PTCH1, os genes PTCH2 e SUNU também foram relatados como mutações de interesse para o QO.[3] EpidemiologiaO QO representa entre 4 a 12% de todos os cistos odontogênicos, afetando mais pacientes na 3ª e 4ª décadas de vida, com ligeira predileção por homens.[3][4] O QO acomete majoritariamente a região posterior da mandíbula, no ramo, e casos em maxila são raros.[3] DiagnósticoO diagnóstico do QO se dá pelo exame de imagem e exame anatomopatológico.[8] Além da radiografia panorâmica, a TCFC é utilizada para o planejamento cirúrgico da lesão, especialmente para lesões extensas.[8] O diagnóstico diferencial inclui:[4][6]
Pacientes com múltiplos QO devem ser avaliados geneticamente para a síndrome do nevo basocelular (síndrome de Gorlin).[4] A síndrome de Gorlin é uma doença autossômica dominante que resulta em mutações do gene PTCH, um gene supressor de tumor no cromossomo 9q22, e está relacionada a múltiplos carcinomas de células basaloides, depressões nas palmas das mãos, múltiplos QOs, e calcificação bilamelar da foice cerebral.[4] Prognóstico e tratamentoO QO possui um prognóstico que pode variar de bom a razoável: a sua taxa de recidiva varia entre 20 e 62%, e depende do tratamento utilizado.[4] O tratamento de escolha é a ressecção cirúrgica completa, que diminui o risco de recidiva para menos de 2%, mas opções mais conservadoras como a enucleação possuem chance maior de recidiva (cerca de 56%).[4][5] Lesões grandes podem passar por descompressão, e algumas mais brandas podem até mesmo regredir completamente com a descompressão.[10] Durante a cirurgia, terapias adjuvantes são utilizadas para diminuir o risco de recidiva, como o uso de solução de Carnoy e aplicação tópica de 5-fluoruracila (5-FU), um antineoplásico que gera apoptose celular.[5] Observa-se que a osteotomia (ressecção com ampla margem de segurança) associada à solução de Carnoy apresentou menor taxa de recidiva, seguida da osteotomia periférica, enucleação com solução de Carnoy, e apenas enucleação.[10] A literatura recomenda o acompanhamento por no mínimo cinco anos, mas há relatos na literatura de recidivas até 10 anos após a remoção da lesão original.[9][10] Apesar de rara, pode ocorrer malignização em um carcinoma escamoso.[11] Por isso, o acompanhamento a longo prazo do paciente é fundamental.[4][10] Ver tambémReferências
|
||||||||||||