|
ფთორი
ფთორი[1][2] (ლათ. Fluorum; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეორე პერიოდის, მეჩვიდმეტე ჯგუფის (მოძველებული კლასიფიკაციით — მეშვიდე ჯგუფის მთავარი ქვეჯგუფის, VIIა) ქიმიური ელემენტი. მისი ატომური ნომერია — 9, ატომური მასა — 18.998. ფთორი ქიმიურად ძალიან ძლიერი აქტიური არალითონია და ყველაზე ძლიერი მჟანგავი. წარმოადგენს ყველაზე მჩატე ელემენტს ჰალოგენებს შორის. ფთორი ნორმალური პირობების დროს ორატომიანი აირია (ფორმულა F2) მკრთალი-მოყვითალო ფერისაა, მკვეთრი სუნით, მოგვაგონებს ოზონს ან ქლორს. ძლიერი საწამლავია. ისტორიაფთორის პირველი ნაერთი — ფლუორიტი (მდნობი შპატი) CaF2 — აღწერილია XV ს. ბოლოს „ფლუორის“ სახელწოდებით. 1771 წ. კარლ ვილჰელმ შეელემ მიიღო ფთორწყალბადმჟავა. როგორც ფთორწყალბადმჟავის ერთ-ერთი ატომი, ელემენტი ფთორი იწინასწარმეტყველეს 1810 წ., გამოიყო 76 წლის შემდეგ, ანრი მუასანის მიერ, 1886 წელს თხევადი უწყლო წყალბადის ფთორიდის ელექტროლიზის მეთოდით, რომელიც შეიცავდა მჟავე კალიუმის ფთორიდის მინარევს KHF2. პრაქტიკულად ყველა მკვლევარი, რომლებიც ცდილობდნენ ფთორის აღმოჩენას, ეს სიცოცხლის ან ჯანმრთელობის ფასად უჯდებოდათ. სახელწოდების წარმომავლობასახელწოდება «ფთორი» (ძვ. ბერძნ. φθόρος — დარღვევა, დაშლა), შემოთავაზებულ იქნა ანდრე მარი ამპერის მიერ 1810 წ., იხმარება ქართულში და სხვა რამდენიმე ენაში; ბევრ ქვეყანაში მიღებულია სახელწოდება, რომელიც წარმოებულია ლათინური «fluorum»-დან (რომელიც მოდის, თავის მხრივ, fluere — «დენა» (ჟონვა) ფთორის ნაერთის, ფლუორიტის თვისების გამო (CaF2). ის დაბლა სწევს მადნის დნობის ტემპერატურა და ზრდის შენადნობის დენადობას). გავრცელება ბუნებაშიფთორის არსებობა ბუნებაში ატომურ პროცენტებში ნაჩვენებია ცხრილში:
ბუნებაში ფთორი მნიშვნელოვნად თავმოყრილია ძირითადად მინერალში ფლუორიტში (CaF2), მასის მიხედვით 51,2 % Ca და 48,8 % F. ფთორით შედარებით მდიდარია ოსპი და ხახვი. ფთორის შემცველობა ნიადაგში განპირობებულია ვულკანური აირებით, რადგანაც მათ შემადგენლობაში შედის დიდი რაოდენობით ფთორწყალბადი. იზოტოპური შემადგენლობაფთორი წარმოადგენს მონოიზოტოპურ ელემენტს, რადგანაც ბუნებაში არსებობს მხოლოდ ერთი სტაბილური ფთორის იზოტოპი 19F. ცნობილია ასევე ფთორის 17 რადიოაქტიური იზოტოპი მასური რიცხვით 14-დან 31-მდე და ერთი ბირთვული იზომერი — 18Fm. ფთორის რადიოაქტიული იზოტოპებიდან ყველაზე სიცოცხლისუნარიანია 18F ნახევარდაშლის პერიოდით 109,771 წუთი, პოზიტრონების მნიშვნელოვანი წყაროა, რომელიც გამოიყენება პოზიტრონ-ემისიურ ტომოგრაფიაში. ფთორის იზოტოპების ბირთვული თვისებები
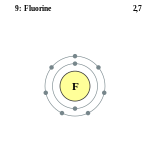
ბირთვების მაგნიტური თვისებებიიზოტოპის 19F ბირთვს აქვს ნახევრადსრული ელექტრონის ზურგის მაგნიტური მომენტების ურთიერთქმედება, ამიტომაც შესაძლებელია ამ ბირთვების გამოყენება ბირთვულ მაგნიტურ რეზონანსში (ბ.მ.რ.)-მოლეკულების საკვლევად. ბ.მ.რ.-ის სპექტრი -19F წარმოადგენს საკმაოდ თვისობრივს ფთორორგანული ნაერთებისათვის. ელექტრონული აღნაგობა ფთორის ატომის ელექტრონული კონფიგურაცია შემდეგია: 1s22s22p5. ფთორის ატომებს ნაერთებში შეუძლიათ გამოავლინონ დაჟანგვის ხარისხი (ვალენტობა) −1. ჟანგვის დადებითი ხარისხი ნაერთებში არ რეალიზირდება, რადგანაც ფთორი წარმოადგენს ყველაზე ელექტროუარყოფით ელემენტს. ფთორის კვანტოქიმიური ტერმ. — ²P3/2 მოლეკულის აღნაგობამოლეკულური ორბიტალების თეორიის თვალსაზრისით, ორატომიანი ფთორის მოლეკულის აღნაგობა შეიძლება დახასიათებულ იქნას შემდეგი დიაგრამით. მოლეკულაში არის 4 შემაკავშირებელი ორბიტალი და 3 გამაფხვიერებელი. როგორც ჩანს, მოლეკულაში კავშირი რიგი 1 -ის ტოლია. კრისტალური მესერი ატმოსფერული წნევის პირობებში ფთორი ქმნის ორ კრისტალურ მოდიფიკაციას:
მიღება ფთორის მიღების სამრეწველო ხერხი შეიცავს ფლიუორიტული მადნის მოპოვებას და გამდიდრებას, მისი კონცენტრატის გოგირდმჟავიანი დაშლა, გაუწყლოებული HF-ის წარმოქმნით და მისი ელექტროლიტური დაშლით. ფთორის ლაბორატირიულად მისაღებად გამოიყენებენ ზოგიერთი ნაერთის დაშლას, მაგრამ ისინი არ გვხვდება ბუნებაში საკმაო რაოდენობით და იღებენ თავისუფალი ფთორის მეშვეობით. ლაბორატორიული მეთოდი
ასევე ფთორის ლაბორატორიული მიღებისათვის შეიძლება გამოვიყენოთ კობალტის ფთორიდის (III) გახურებით 300 °С-მდე, ვერცხლის ფთორიდის დაშლით (ძალიან ძვირია) და სხვა ხერხები. სამრეწველო მეთოდიფთორის სამრეწველო წარმოება ხორციელება KF·3HF მჟავე კალიუმის ფთორიდის შენადნობის ელექტროლიზით (ხშირად ლითიუმის ფთორიდის დამატებით), რომელიც წარმოიქმნება შენადნობის - KF გაჯერებით ფთორწყალბადით შემცველობის 40—41 % HF. ელექტრილიზის პროცესი მიმდინარეობს დაახლოებით 100 °C ტემპერატურის დროს, ფოლადის ელექტროლიზერებში ფოლადის კათოდით და ნახშირის ანოდით. ფიზიკური თვისებებიმკრთალი-ყვითელი აირი, მცირე კონცენტრაციისას სუნი გვახსენებს ერთდროულად ოზონს და ქლორს, ძალიან აგრესიულია და მომწამლავია. ფთორს აქვს ანომალიურად დაბალი დუღილის (დნობის) ტემპერატურა. ეს დაკავშირებულია იმასთან რომ, ფთორს არ გააჩნია d-ქვედონე და არ შეუძლია შექმნას ერთნახევრიანი კავშირები, რითაც განსხვავდება ყველა ჰალოგენისაგან (კავშირების ჯერადობა სხვა ჰალოგენებში მიახლოებით არის 1.1) [7] ქიმიური თვისებებიფთორი ყველაზე აქტიური არალითონია, აქტიურად ურთიერთქმედებს თითქმის ყველა ნივთიერებასთან გარდა, რა თქმა უნდა ფთორიდებთან და იშვიათ გამონაკლისად — ფთოროპლასტებთან, და ბევრ მათგანთან — წვით და ფეთქებით. ფთორის კონტაქტი წყალბადთან იწვევს აალებას და აფეთქებას დაბალ ტემპერატურების დროსაც კი (−252 თარგი:გრადუს ცელსიუსი). ფთორის ატმოსფეროში იწვის წყალი და პლატინაც კი:
რეაქციებში, სადაც ფთორი ფორმალურად წარმოადგენს აღმდგენს, მიეკუთვნება უმაღლესი ფთორიდების დაშლის რეაქციები, მაგალითად:
ფთორს ასევე შეუძლია დაჟანგოს ჟანგბადი, და წარმოქმნის ჟანგბადის ფთორიდს OF2. ყველა ნაერთებში ფთორი ავლენს -1 დაჟანგვის ხარისხს (ვალენტობა). იმისათვის რომ ფთორი ავლენდეს დადებით დაჟანგვის ხარისხს საჭიროა ექსიმერული მოლეკულების შექმნა ან სხვა ექსტრემალური პირობები. ამას საჭიროებს ფთორის ატომების ხელოვნურ იონიზაციას.[8] შენახვაფთორს ინახავენ გაზისებურ მდგომარეობაში (წნევის ქვეშ) და შეკუმშული სახით (თხევადი აზოტით გაციებულს) ნიკელის აპარატებში და მის საფუძველზე არსებული შენადნობებში (მონელ-ლითონი), სპილენძისაგან, ალუმინისა და მისი შენადნობებისაგან, თითბერისაგან, უჟანგავი ფოლადისაგან (ეს შესაძლებელია იმიტომ, რომ ეს ლითონები და შენადნობები იფარებიან ფთორისათვის გადაულახავი ფთორიდების ფენით (აპკით) დამზადებულ ჭურჭელში[9]). გამოყენებაგამოყენება ქიმიაშიგაზისებური ფთორი გამოიყენება შემდეგი ნივთიერებების მისაღებად:
სარაკეტო ტექნიკაფთორის ნაერთები გამოიყენება სარაკეტო ტექნიკაში, როგორც სარაკეტო საწვავის მჟანგავი. გამოყენება მედიცინაშიფთორის ნაერთები ფართოდ გამოიყენებიან მედიცინაში, როგორც სისხლის დანამატები. ბიოლოგიური და ფიზიოლოგიური როლიფთორი წარმოადგენს ორგანიზმის სიცოცხლისუნარიანობისათვის აუცილებელ ელემენტს. ადამიანის ორგანიზმში ფთორი, ძირითადად, შედის კბილის მინანქრის ფთორაპატიტის შემადგენლობაში — Ca5F(PO4)3. არასაკმარისი რაოდენობისას (0,5 მგ/ლ ნაკლები სასმელ წყალში) ან ჭარბი (1 მგ/ლ მეტი) ფთორის მოხმარებისაგან ორგანიზმში შეიძლება განვითარდეს კბილის დაავადებები: კარიესი და ფლუოროზი (მინანქრის დაწინწკლულობა) და ოსტეოსარკომა, შესაბამისად[10]. ფთორის მცირე შემცველობა შლის მინანქარს ფთორის გამორეცხვის ხარჯზე ფთორაპატიტიდან ჰიდროქსოაპატიტის წარმოქმნით, და პირუკუ.  კარიესის პროფილაქტიკისათვის რეკომენდებულია ფთორიანი კბილის პასტები ან ფთორირებული წყლის გამოყენება (1 მგ/ლ-მდე კონცენტრაციით), ან ადგილობრივად 1-2 % ნატრიუმის ფთორიდის ან კალას ფთორიდის ხსნარებთან ერთად გამოყენება. ასეთ ქმედებებს შეუძლიათ კარიესის წარმოქმნის შესაძლებლობის შემცირება 30-50 %-ით. ფთორის ზღვრული დასაშვები კონცენტრაცია[11] სამრეწველო ფართების ჰაერში ტოლია 0,0005 მგ/ლ. იხილეთ აგრეთველიტერატურა
რესურსები ინტერნეტში
სქოლიო
ვიკისაწყობში არის გვერდი თემაზე:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||