|
ตัวกั้นระหว่างเลือดกับสมอง
ตัวกั้นระหว่างเลือดกับสมอง (อังกฤษ: Blood-brain barrier ตัวย่อ BBB) เป็นเยื่อที่เลือกให้สารบางอย่างผ่าน ซึ่งแยกระบบไหลเวียน (โลหิต) ออกจากสมองกับน้ำนอกเซลล์ (extracellular fluid) ภายในระบบประสาทกลาง (CNS)[1] ตัวกั้นประกอบด้วยเซลล์เนื้อเยื่อบุโพรง (endothelial cell) ของผนังหลอดเลือดฝอย, ปลายส่วนยื่น (end-feet) ของแอสโทรไซต์ที่หุ้มเส้นเลือดฝอย และเพริไซต์ (pericyte) ซึ่งเป็นเซลล์หดตัวได้ (contractile cells) ที่พันรอบเซลล์เนื้อเยื่อบุโพรงและฝังอยู่ในเยื่อฐาน (basement membrane) ของเส้นเลือด[2] ระบบนี้ยอมให้สารบางอย่างไหลแพร่ผ่านเข้าไปได้โดยไม่ต้องอาศัยพลังงานนอกระบบ สารรวมทั้งน้ำ แก๊สบางอย่าง และโมเลกุลที่ละลายได้ในลิพิด ระบบยังมีกลไกขนส่งโมเลกุลบางอย่างผ่านตัวกั้นโดยใช้พลังงานเพราะเป็นโมเลกุลสำคัญต่อการทำงานของสมอง โมเลกุลเช่น กลูโคสและกรดอะมิโน มีโครงสร้างพิเศษหลายอย่างในสมองที่มีบทบาทเกี่ยวกับการรับรู้ (sensory) และการคัดหลั่ง (secretory) ภายในวงจรประสาท (neural circuit) ต่าง ๆ ที่ไม่มีตัวกั้นกลางระหว่างเลือดกับสมอง โครงสร้างรวมทั้ง circumventricular organ และ choroid plexus (ที่สร้างน้ำสมองร่วมไขสันหลัง คือ CSF ภายในโพรงสมอง) ตัวกั้นกลางระหว่างเลือดกับสมองจะจำกัดการแพร่ตัวละลายในเลือด (เช่น แบคทีเรีย) และโมเลกุลขนาดใหญ่หรือชอบน้ำ (hydrophilic) เข้าไปในน้ำสมองร่วมไขสันหลัง ในขณะที่ไม่จำกัดการแพร่ของโมเลกุลกลัวน้ำ (hydrophobic) (เช่น ออกซิเจน คาร์บอนไดออกไซด์ และฮอร์โมน) และโมเลกุลมีขั้ว (polar) ขนาดเล็ก[3] เซลล์ของตัวกั้นยังขนส่งผลผลิตทางเมทาบอลิซึม (เช่นกลูโคส) ข้ามผ่านตัวกั้นโดยใช้พลังงานและใช้โปรตีนขนส่งข้ามเยื่อโดยเฉพาะ ๆ[4] โครงสร้าง  ความเป็น "ตัวกั้น" นี้มาจากการเลือกให้ผ่านของไทต์ จังก์ชัน ที่อยู่ระหว่างเซลล์เนื้อเยื่อบุโพรงต่าง ๆ ในหลอดเลือดของระบบประสาทกลาง ซึ่งจำกัดการผ่านของสารละลาย[1] คือ ที่จุดต่อระหว่างเลือดกับสมอง จะมีเซลล์เนื้อเยื่อบุโพรงที่ยึดอยู่ด้วยกันอาศัยไทต์จังก์ชัน ซึ่งก็ประกอบด้วยหน่วยย่อย ๆ บ่อยครั้งเป็นไดเมอร์ (dimer) ซึ่งเป็นโปรตีนผ่านเยื่อ (transmembrane protein) เช่น occludin, claudins, junctional adhesion molecule (JAM) หรือ ESAM[4] โปรตีนแต่ละอย่างเช่นนี้จะยึดฝังอยู่กับเซลล์เนื้อเยื่อบุโพรงด้วยคอมเพลกซ์โปรตีนอีกอย่างหนึ่ง รวมทั้ง ZO-1 และโปรตีนที่เกี่ยวข้องกันอื่น ๆ[4] ตัวกั้นจะประกอบด้วยเซลล์มีความหนาแน่นสูงที่จำกัดการผ่านเข้าของสารต่าง ๆ จากเลือด โดยจำกัดมากยิ่งกว่าเซลล์เนื้อเยื่อบุโพรงในหลอดเลือดฝอยส่วนอื่น ๆ ของร่างกาย[5] ส่วนยื่นของแอสโทรไซต์ที่เรียกว่า astrocytic feet (หรือ glia limitans) จะล้อมเซลล์เยื่อบุโพรงของ BBB โดยเป็นตัวหล่อเลี้ยงทางชีวเคมีของเซลล์[6] BBB นั้นต่างกับตัวกั้นระหว่างเลือดกับน้ำสมองร่วมไขสันหลัง (blood-cerebrospinal fluid barrier) ซึ่งเป็นหน้าที่ของ choroidal cell ใน choroid plexus และต่างกับตัวกั้นระหว่างเลือดกับจอประสาทตา (blood-retinal barrier) แม้ทั้งหมดต่างก็เป็นตัวกั้น[7] มีบริเวณสมองมนุษย์หลายเขตที่ไม่ได้อยู่ด้านสมองของตัวกั้น ตัวอย่างรวมทั้ง circumventricular organs, เพดานของโพรงสมองที่สามและที่สี่, หลอดเลือดฝอยในต่อมไพเนียลที่เพดานของ diencephalon และต่อมไพเนียลเอง เพราะต่อมไพเนียลหลั่งฮอร์โมนเมลาโทนิน "เข้าไปในระบบไหลเวียนโดยตรง"[8] ดังนั้นตัวกั้นจึงไม่มีผลต่อเมลาโทนิน[9] พัฒนาการดั้งเดิมแล้ว งานทดลองในคริสต์ทศวรรษ 1920 ดูเหมือนจะแสดง (อย่างผิด ๆ) ว่า BBB ยังเจริญไม่เต็มที่ในเด็กเกิดใหม่ ซึ่งเป็นความผิดพลาดเนื่องกับวิธีการ คือน้ำที่ทดลองฉีดเข้าเส้นเลือดมีความดันออสโมซิสสูงเกินจนกระทั่งหลอดเลือดฝอยที่เปราะบางของเด็กเสียหายเป็นบางส่วน แต่งานทดลองต่อ ๆ มาซึ่งลดปริมาณน้ำที่ฉีดก็ได้แสดงว่า ตัวบ่งชี้ที่วัดจริง ๆ ไม่สามารถผ่าน BBB แม้ของเด็กได้ คือได้รายงานว่า สารธรรมชาติต่าง ๆ เช่น albumin, α-1-fetoprotein หรือ transferrin ในพลาสมาที่เข้มข้นขึ้นตรวจสอบไม่พบนอกเซลล์ภายในสมองของเด็กเกิดใหม่ อนึ่ง โปรตีนขนส่งคือ transporter P-glycoprotein ก็มีอยู่ในเนื้อเยื่อบุโพรง (เอนโดทีเลียม) ของสัตว์ตัวอ่อนแล้ว[10] 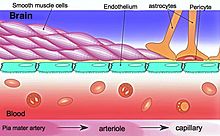 การวัดการดูดซึมนำเข้าเนื้อเยื่อสมองซึ่งสารต่าง ๆ รวมทั้ง acetamide, antipyrine, benzyl alcohol, butanol, กาเฟอีน, cytosine, เฟนิโทอิน, เอทานอล, เอทิลีนไกลคอล, เฮโรอีน, mannitol, เมทานอล, phenobarbital, propylene glycol, ไทโอยูเรีย และยูเรียในกระต่ายเกิดใหม่ซึ่งให้ยาชาเทียบกับกระต่ายโตแล้ว แสดงว่า เนื้อเยื่อบุโพรงของลูกกระต่ายและกระต่ายโตแล้วทำงานคล้าย ๆ กันในเรื่องการให้ซึมผ่านได้ซึ่งอำนวยโดยลิพิด[11] ข้อมูลนี้ยืนยันว่า ไม่มีความแตกต่างในการเลือกให้ผ่านของ BBB ระหว่างสัตว์เกิดใหม่กับสัตว์ที่โตแล้ว คือไม่พบความแตกต่างการนำเข้ากลูโคส กรดอะมิโน กรดอินทรีย์ พิวรีน นิวคลีโอไซด์ หรือ choline ของเนื้อเยื่อสมองระหว่างกระต่ายที่โตแล้วกับลูกกระต่าย[11] การทดลองเหล่านี้แสดงว่า BBB ของสัตว์เกิดใหม่มีคุณสมบัติจำกัดการให้ผ่านเหมือนกับสัตว์ที่โตแล้ว เทียบกับข้อเสนอว่าสัตว์วัยเยาว์ยังมีตัวกั้นที่ไม่โตเต็มที่ งานศึกษาหล่านี้แสดงว่า BBB ที่เลือกให้ผ่านทำงานได้ดีแล้วตั้งแต่เกิด หน้าที่ตัวกั้นกลางระหว่างเลือดกับสมองป้องกันจุลชีพก่อโรคที่อยู่ในระบบไหลเวียนไม่ให้เข้าไปในสมอง เพราะเหตุนี้ การติดเชื้อในสมองเนื่องกับเลือดจึงมีน้อยมาก[1] โดยที่เกิดก็บ่อยครั้งรักษาได้ยาก เพราะสารภูมิต้านทานมีขนาดใหญ่เกินที่จะผ่านตัวกั้นได้ และมียาปฏิชีวนะบางอย่างเท่านั้นที่ผ่านเข้าไปได้[12] ในบางกรณี ยาต้องฉีดเข้าไปในน้ำสมองร่วมไขสันหลัง (CSF) โดยตรง ซึ่งจะสามารถเข้าไปในสมองผ่านตัวกั้นกลางระหว่างเลือดกับน้ำสมองร่วมไขสันหลัง (blood-cerebrospinal fluid barrier ตัวย่อ BCSFB)[13][14] ตัวกั้นอาจเริ่มรั่วในโรคทางประสาทบางโรค เช่น อะไมโอโทรฟิก แลเทอรัล สเกลอโรซิส, โรคลมชัก, สมองบาดเจ็บ, สมองบวมน้ำ และในโรคที่มีผลทั้งร่างกาย (systemic disease) เช่น ตับล้มเหลว[1] อนึ่ง ตัวกั้นยังเปิดให้ผ่านมากกว่าเมื่อเกิดการอักเสบ[1] ทำให้ยาปฏิชีวนะและเซลล์กลืนกิน (phagocyte) ผ่านตัวกั้นเข้าไปได้ แต่แบคทีเรียและไวรัสก็ผ่านเข้าไปได้เช่นกัน[12][15] ตัวอย่างจุลชีพก่อโรคที่สามารถผ่านตัวกั้นเข้าไปได้รวมทั้ง Toxoplasma gondii ซึ่งก่อโรค toxoplasmosis, spirochaetes (ไฟลัม Spirochaetes) เช่น Borrelia ซึ่งก่อโรคไลม์, streptococcus กลุ่มบีซึ่งก่อเยื่อหุ้มสมองอักเสบในทารกเกิดใหม่[16] และ spirochaete คือ Treponema pallidum ซึ่งก่อซิฟิลิส แบคทีเรียอันตรายเหล่านี้บางอย่างเข้าไปได้โดยปล่อยสารเป็นพิษต่อเซลล์ (cytotoxin) เช่น pneumolysin[17] ซึ่งเป็นพิษโดยตรงต่อเนื้อเยื่อบุโพรงของเส้นเลือดฝอยในสมอง[18] และต่อไทต์จังก์ชัน Circumventricular organcircumventricular organ (CVO) เป็นโครงสร้างเดี่ยว ๆ ที่อยู่ติดกับโพรงสมองที่สี่หรือที่สาม มีลักษณะเป็นกลุ่มเส้นเลือดฝอย (capillary bed ) ที่มีเซลล์เนื้อเยื่อบุโพรงซึ่งเลือกให้ผ่านโดยไม่เหมือนกับตัวกั้นกลางระหว่างเลือดกับสมอง[19][20] CVO ซึ่งมีเส้นเลือดฝอยที่ไหลผ่านได้มากรวมทั้ง area postrema, subfornical organ, vascular organ of the lamina terminalis, median eminence, ต่อมไพเนียล และพูต่อมใต้สมองสามพู[19][21] เส้นเลือดฝอยซึ่งไหลผ่านได้มากของ CVO รับรู้ (sensory CVO) คือ area postrema, subfornical organ และ vascular organ of the lamina terminalis ช่วยให้โครงสร้างเหล่านี้ตรวจจับสัญญาณในระบบไหลเวียน ส่วนที่เป็นของ CVO คัดหลั่ง (secretory CVO) รวมทั้ง median eminence, ต่อมไพเนียล และต่อมใต้สมอง ช่วยให้ส่งสัญญาณจากสมองเข้าไปยังเลือดได้ง่าย[19][20] ดังนั้น เส้นเลือดฝอยที่ผ่านได้มากของ CVO จึงจัดเป็นช่องการสื่อสารระหว่างเลือดกับสมองในระบบประสาทร่วมต่อมไร้ท่อ[19][21][22] โซนที่ไหลผ่านได้เป็นพิเศษโซนช่วงต่อระหว่างเนื้อเยื่อสมองที่ป้องกันด้วย BBB กับโซนที่ "เปิด" รับสัญญาณจากเลือดใน CVO บางอย่าง มีเส้นเลือดฝอยไฮบริดพิเศษที่ไหลผ่านได้มากกว่าเส้นเลือดฝอยในสมองโดยทั่วไป แต่ไม่มากเท่ากับเส้นเลือดฝอยของ CVO โซนเช่นนี้อยู่ที่ชายแดนระหว่าง area postrema กับ nucleus tractus solitarii (NTS)[23] และระหว่าง median eminence กับ hypothalamic arcuate nucleus[22][24] โซนเหล่านี้ดูเหมือนจะใช้เป็นบริเวณซึ่งขนส่งสัญญาณได้อย่างรวดเร็วของโครงสร้างสมองที่มีบทบาทในวงจรประสาทต่าง ๆ (โครงสร้างเช่น NTS และ arcuate nucleus) เพื่อให้ฮอร์โมนประสาทสามารถออกฤทธิ์ได้อย่างรวดเร็ว[22][23] อนึ่ง เขตระหว่าง median eminence กับ hypothalamic arcuate nucleus ยังมีช่องรอบ ๆ เส้นเลือดฝอย (pericapillary spaces) ที่ค่อนข้างใหญ่ ซึ่งช่วยให้สารละลายระหว่างโครงสร้างทั้งสองนี้ไปถึงกันและกันได้ ซึ่งแสดงว่า median eminence ไม่ใช่เพียงอวัยวะคัดหลั่ง แต่อาจเป็น CVO ที่รับรู้ด้วย[22][24] ความสำคัญทางคลินิกเป็นเป้าหมายของยาBBB เกิดจากเนื้อเยื่อบุโพรง (เอนโดทีเลียม) เส้นเลือดฝอยในสมอง ซึ่งกันสมองจากยารักษาทางประสาทที่โมเลกุลใหญ่ได้เกือบ 100% และยาโมเลกุลเล็กได้มากกว่า 98%[1] การพิชิตปัญหาการส่งยาเข้าไปยังเขตโดยเฉพาะ ๆ ในสมองเป็นเรื่องท้าทายสำคัญในการรักษาโรคทางสมองโดยมาก หน้าที่ป้องกันประสาทของมันจึงจำกัดการขนส่งสารที่ใช้วินิจฉัยและรักษาโรคเข้าไปในสมอง เพราะโมเลกุลและสารภูมิต้านทานที่อาจมีประสิทธิผลไม่ว่าจะในเรื่องการตรวจวินิจฉัยหรือการรักษา ไม่สามารถผ่าน BBB เข้าไปได้อย่างเพียงพอ ยาซึ่งมีเป้าหมายที่สมองปกติจะต้องส่งผ่านหรือข้าม BBB ไป ที่ส่งผ่าน BBB จะต้องระงับการทำงานของมันไม่ว่าจะโดยวิธีทางออสโมซิส หรือวิธีทางชีวเคมีด้วยการใช้สารที่มีผลต่อขนาดเส้นเลือด เช่น bradykinin[25] หรือแม้แต่การจี้โฟกัสเป็นจุดด้วยคลื่นเสียงความถี่สูง (high-intensity focused ultrasound ตัวย่อ HIFU)[26] วิธีการผ่าน BBB อื่นรวมระบบขนส่งที่มีตามธรรมชาติ รวมทั้งที่ใช้โปรตีนขนส่งเช่น โปรตีนขนส่งกลูโคส หรือโปรตีนขนส่งกรด, กระบวนการ receptor-mediated transcytosis สำหรับอินซูลินหรือ transferrin และการระงับฤทธิ์ของโปรตีนขนส่งสิ่งแปลกปลอมออกนอกเซลล์ (active efflux transporters) เช่น p-glycoprotein แต่ก็พบว่า ตัวนำยาที่ใช้โปรตีนขนส่งของ BBB เช่น transferrin receptor ในบางกรณีจะติดอยู่ในเส้นเลือดฝอยของเนื้อเยื่อบุโพรง คือยาไม่ผ่าน BBB เข้าไปในเนื้อสมอง (cerebral parenchyma)[27][28] การส่งยาข้าม BBB รวมทั้งการฝังเข้าไปในสมอง (intracerebral implantation) เช่นด้วยเข็ม หรือด้วย convection-enhanced distribution แอลกอฮอล์น้ำตาลแมนนิทอลก็สามารถใช้เลี่ยง BBB ได้ด้วย อนุภาคนาโนนาโนเทคโนโลยีอาจช่วยส่งยาผ่าน BBB ได้[29][30] นักวิจัยกำลังพยายามสร้างลิโพโซม (liposome) บรรจุอนุภาคนาโน (nanoparticle) เพื่อส่งผ่านเข้า BBB แต่ก็ต้องทำงานวิจัยมากขึ้นเพื่อหากลยุทธ์ซึ่งมีประสิทธิภาพที่สุด และเพื่อเช็คดูว่า จะทำคนไข้เนื้องอกสมองให้อาการดีขึ้นได้อย่างไร การเปิด BBB ให้รับสารโดยเฉพาะ ๆ เพื่อรักษาเนื้องอกในสมองเป็นเรื่องที่กำลังสำรวจในเบื้องต้น เป็นการประยุกต์ใช้นานาเทคโนโลยีทางประสาทวิทยาศาสตร์เพื่อการรักษาซึ่งดูมีอนาคตที่สุดอย่างหนึ่ง เพราะอนุภาคนาโนอาจทำกิจหลาย ๆ อย่างได้เป็นลำดับ ซึ่งเป็นเรื่องสำคัญมากเมื่อต้องส่งยาข้าม BBB งานวิจัยจำนวนสำคัญได้ตรวจสอบวิธีการส่งยาต้านมะเร็ง (antineoplastic) ที่อำนวยโดยอนุภาคนาโนไปยังเนื้องอกในระบบประสาทกลาง ยกตัวอย่างเช่น นักวิจัยได้ส่ง radiolabeled polyethylene glycol coated hexadecylcyanoacrylate nanospheres คืออนุภาคนาโนรูปทรงกลม (hexadecylcyanoacrylate nanosphere) ที่เคลือบด้วย polyethylene glycol ซึ่งประกอบด้วยไอโซโทปกัมมันตรังสี (radiolabeled) ให้เข้าไปสะสมที่ก้อนมะเร็งแบบ gliosarcoma ในสมองของหนู[31] อย่างไรก็ดี วิธีนี้ยังไม่พร้อมที่จะทดลองทางคลินิก เพราะอนุภาคนาโนก็สะสมที่เนื้อเยื่อปกติรอบ ๆ เนื้องอกด้วย ส่วนวิธีการอีกอย่างที่ดูจะมีอนาคตก็คือการเคลือบอนุภาคนาโนแบบ polyalkylcyanoacrylate หรือ poly-lactic-co-glycolic acid (PLGA) ด้วย polysorbate 80 หรือ poloxamer 188 เพราะการเคลือบเช่นนี้ อนุภาคจึงสามารถดูดซึม apolipoproteins E หรือ apolipoproteins A-1 จากเลือดแล้วมีปฏิกิริยากับโปรตีนส่งสัญญาณ (signaling protein) คือ LRP1 หรือกับ scavenger receptor แล้วตามด้วย transcytosis[A] ข้าม BBB เข้าไปในสมอง[36] อนุภาคจะบรรจุยาเคมีบำบัดคือ doxorubicin ซึ่งใช้รักษา glioblastomas โดยยังอยู่ในระยะการทดลองทางคลินิกระยะที่ 1 ในปี 2013 ยังได้ค้นพบอนุภาคนาโนที่มีสมรรถภาพหลายอย่างที่เรียกว่า magneto-electric nanoparticles (MENs) ซึ่งสามารถใช้นำแล้วปล่อยยาข้าม BBB และยังใช้กระตุ้นเซลล์ในส่วนลึกของสมองโดยควบคุมได้โดยไม่ต้องต่อสาย เป็นวิธีที่อาศัยการควบคุมสนามแม่เหล็กไม่ได้ควบคุมสิ่งแวดล้อมภายในเซลล์ ซึ่งนักวิจัยได้ทดลองทั้งในสภาพแวดล้อมเทียม (in vitro) และในสมองของหนูที่ยังมีชีวิต (in vivo)[37] อย่างไรก็ดี เซลล์เนื้อเยื่อบุโพรงของเส้นเลือดและเพริไซต์ (pericyte) บ่อยครั้งจะผิดปกติเมื่อมีเนื้องอก และ BBB ในกรณีเช่นนี้อาจจะเสียหายได้ อนึ่ง เยื่อฐาน (basement membrane) บางครั้งก็ไม่สมบูรณ์ด้วย ปัจจัยอื่น ๆ เช่น แอสโทรไซต์ อาจมีผลให้ดื้อการรักษาเนื้อเยื่อสมอง[38][39] เพปไทด์เพปไทด์สามารถข้าม BBB ได้โดยอาศัยกลไกต่าง ๆ จึงเป็นจุดที่สามารถหาวิธีการตรวจวินิจฉัยและรักษาโรคเพิ่มขึ้นได้[40] แต่ข้อมูลเรื่องการขนส่งสารต่าง ๆ ข้าม BBB ก็กระจายไปทั่วในวรรณกรรมของสาขาต่าง ๆ โดยใช้วิธีการรายงานข้อมูลการนำเข้า (influx) หรือการกำจัดออก (efflux) ต่าง ๆ กัน จึงมีการสร้างฐานข้อมูลเพปไทด์เนื่องกับ BBB คือ Brainpeps เพื่อเก็บข้อมูลในวรรณกรรม เป็นฐานข้อมูลที่รายงานทั้งผลบวกและผลลบ/ว่าง จึงมีประโยชน์เพื่อเลือกเพปไทด์เมื่อตรวจสอบการตอบสนองของ BBB ข้อมูลที่มียังจัดหมวดหมู่วิธีการที่ใช้และผลที่พบอีกด้วย อนึ่ง ความสัมพันธ์ระหว่างกลไกการขนส่งผ่าน BBB ต่าง ๆ ก็ได้ทำให้ชัดเจนยิ่งขึ้นด้วย[41] casomorphin ซึ่งเป็นเพปไทด์แบบโอปิออยด์และ heptapeptide ก็สามารถผ่านข้าม BBB ได้ด้วย[42] โรคเยื่อหุ้มสมองอักเสบเยื่อหุ้มสมองอักเสบเป็นการอักเสบของเยื่อหุ้มสมองและไขสันหลัง ซึ่งรวม ๆ เรียกว่าเยื่อหุ้มสมองและไขสันหลัง (meninges) โรคเกิดเพราะการติดจุลชีพก่อโรคต่าง ๆ ตัวอย่างเชื้อโรครวมทั้ง Streptococcus pneumoniae (เชื้อโรคหลักที่ก่อโรคปอดบวม) และ Haemophilus influenzae (ซึ่งเป็นเหตุให้ติดเชื้อต่าง ๆ มากมาย) เมื่อเยื่อหุ้มสมองอักเสบ BBB อาจไม่ทำงาน[12] ซึ่งทำให้สารต่าง ๆ ผ่านเข้าไปในสมองได้เพิ่มขึ้น ไม่ว่าจะเป็นสารก่อพิษหรือยาปฏิชีวนะ ยาปฏิชีวนะที่ใช้รักษาอาการนี้อาจเพิ่มการอักเสบภายในระบบประสาทกลางเพราะสารก่อพิษทางประสาทที่ปล่อยจากผนังเซลล์ของแบคทีเรีย เช่น lipopolysaccharide (LPS)[43] แพทย์มักจะรักษาด้วยยาปฏิชีวนะเซฟาโลสปอรินหรือแอมโฟเทอริซินบีขึ้นอยู่กับจุลชีพก่อโรคว่าจะเป็นแบคทีเรีย รา หรือโพรโทซัว[44] ฝีในสมองฝีในสมอง (brain abscess) ก็เหมือนกับฝีอื่น ๆ เพราะมีเหตุจากการอักเสบและการสะสมของเซลล์ระบบน้ำเหลืองและของเสียอื่น ๆ ที่มาจากการติดเชื้อใกล้ ๆ หรือแม้แต่ไกล ๆ แต่ฝีในสมองนั้นมีน้อยและเป็นอันตรายต่อชีวิต ต้นกำเนิดฝีในสมองใกล้ ๆ อาจมาจากการติดเชื้อที่หู ช่องปากกับฟัน โพรงอากาศรอบ ๆ จมูก หรือฝีเหนือเยื่อดูรา (epidural) ที่ไกล ๆ อาจมาจากการติดเชื้อที่ปอด หัวใจ หรือไต แต่ฝีในสมองก็อาจมาจากการบาดเจ็บที่ศีรษะหรือเป็นผลข้างเคียงของการผ่าตัดด้วย ในเด็ก ฝีในสมองปกติจะเกี่ยวกับโรคหัวใจแต่กำเนิด[45] ในกรณีโดยมาก จะต้องรักษาด้วยยาปฏิชีวนะเป็นเวลา 8-12 สัปดาห์[12] โรคลมชักโรคลมชักเป็นโรคทางประสาทที่สามัญ มีอาการชักที่เป็นแล้วเป็นอีก และบางครั้งรักษาไม่ได้ ข้อมูลทางคลินิกและการทดลองได้ระบุว่า การทำงานของ BBB ที่ล้มเหลวเป็นเหตุจุดชนวนการชักเรื้อรังหรือฉับพลัน[46][47][48][49][50] งานศึกษาบางงานระบุว่า มีเหตุจากอันตรกิริยาระหว่างโปรตีนในเลือด (คือ albumin) กับแอสโทรไซต์[51] ข้อระบุเหล่านี้แสดงว่า การชักแบบฉับพลันเป็นผลที่พยากรณ์ได้เนื่องกับความล้มเหลวของ BBB ไม่ว่าจะโดยวิธีการที่ทำขึ้นหรือโดยกลไกการอักเสบ อนึ่ง การแสดงออกของโมเลกุลและโปรตีนขนส่งซึ่งดื้อยาที่ BBB ยังเป็นกลไกการดื้อยาต้านชักที่ใช้อย่างสามัญ[52][53] โรคปลอกประสาทเสื่อมแข็งโรคปลอกประสาทเสื่อมแข็ง (MS) จัดเป็นความผิดปกติทางภูมิต้านตนเอง (autoimmune disorder) และความผิดปกติซึ่งทำให้ประสาทเสื่อม (neurodegenerative disorder) ที่ระบบภูมิคุ้มกันเข้าทำลายปลอกไมอีลินที่ป้องกันและเป็นฉนวนไฟฟ้าให้แก่เซลล์ประสาททั้งในระบบประสาทกลางและระบบประสาทนอกส่วนกลาง ปกติแล้ว เซลล์เม็ดเลือดขาวจะเข้าไปยังระบบประสาทไม่ได้เนื่องจาก BBB แต่ภาพ MRI ได้แสดงว่า เมื่อคนไข้มีปัญหาเกี่ยวกับ MS ส่วน BBB ในสมองหรือในไขสันหลังจะไม่ทำงาน ทำให้เซลล์เม็ดเลือดขาว คือ T lymphocytes เข้าไปในสมองแล้วทำปลอกไมอีลินให้เสียหายได้ จนถึงกับเสนอว่า MS ไม่ใช่โรคของภูมิคุ้มกัน แต่เป็นโรคของ BBB[54] ฺBBB อาจอ่อนแอลงเนื่องกับความผิดปกติของเซลล์เนื้อเยื่อบุโพรงภายในเส้นเลือด ซึ่งอาจเป็นเพราะผลิตโปรตีน P-glycoprotein ได้ไม่ดี[55] ปัจจุบันยังมีการตรวจสอบการรักษาเหตุที่ทำให้ BBB เสียหายอยู่ โดยเชื่อว่า oxidative stress (คือความไม่สมดุลระหว่างสารก่อปฏิกิริยาที่มีออกซิเจนกับระบบร่างกายที่มีหน้าที่กำจัดมันหรือซ่อมแซมผลเสียหายของมัน) มีบทบาทสำคัญทำให้ BBB เสียหาย ดังนั้น สารต้านอนุมูลอิสระ เช่น กรดลิโปอิก (lipoic acid) อาจช่วยสร้างเสถียรภาพให้แก่ BBB ได้[56] โรคเส้นประสาทตากับไขสันหลังอักเสบโรคเส้นประสาทตากับไขสันหลังอักเสบ (neuromyelitis optica, NMO) หรือ Devic's disease คล้ายคลึงกับ MS ซึ่งบ่อยครั้งทำให้สับสน ในบรรดาความแตกต่างกับ MS ได้พบว่า ภูมิต้านตนเองมีเป้าหมายที่ต่างกัน คือคนไข้ NMO มีสารภูมิต้านทานต่อโปรตีน aquaporin 4 (เป็นองค์ประกอบของส่วนยื่น คือ foot processes ของแอสโทรไซต์ที่ BBB) ในระดับสูง[57] Late-stage neurological trypanosomiasis (sleeping sickness)อาการทางประสาทคือ trypanosomiasis ซึ่งเป็นความเจ็บป่วยในการนอนหลับในระยะท้าย ๆ มีเหตุจากโพรโทซัวในสกุล trypanosoma ในเนื้อเยื่อสมอง ยังไม่ชัดเจนว่า ปรสิตนี้เข้าไปในสมองจากเลือดได้อย่างไร แต่คาดว่า ผ่านเข้าทางข่ายประสาทคอรอยด์ (choroid plexus) ซึ่งเป็น circumventricular organ อย่างหนึ่ง Progressive multifocal leukoencephalopathy (PML)progressive multifocal leukoencephalopathy (PML) เป็นโรคทำลายปลอกไมอีลินในระบบประสาทกลางที่มีเหตุจากการฟื้นกำเริบของ papovavirus ที่ซ่อนตัวอยู่ คือ JC polyomavirus ซึ่งสามารถผ่านเข้า BBB ได้ มันก่อโรคในคนไข้ที่ภูมิต้านทานเสียหาย และปกติจะเกิดในคนไข้โรคเอดส์ De Vivo diseaseGLUT1 deficiency syndrome เป็นโรคมีน้อยที่เกิดจากการขนส่งน้ำตาลกลูโคสข้าม BBB ไม่เพียงพอ ทำให้โตช้าและมีปัญหาทางประสาทอื่น ๆ ปัญหาทางพันธุกรรมของโปรตีนขนส่งกลูโคสคือ glucose transporter type 1 (GLUT1) ดูเหมือนจะเป็นเหตุหลัก[58][59] โรคอัลไซเมอร์หลักฐานบางส่วนชี้ว่า การทำงานของ BBB ที่เสียหายของคนไข้โรคอัลไซเมอร์ทำให้ amyloid beta (Aβ) ในน้ำเลือดเข้าไปในสมอง ซึ่ง Aβ จะเข้าไปติดที่ผิวของแอสโทรไซต์อย่างเฉพาะเจาะจง[60] ผลเช่นนี้จึงก่อสมมติฐานว่า[61]
สมองบวม (cerebral edema)สมองบวม (cerebral edema) เป็นการสะสมน้ำมากเกินไปในพื้นที่นอกเซลล์ภายในสมอง ซึ่งเกิดเมื่อการขาดออกซิเจน (hypoxia) ทำให้ BBB เปิด โรคเกี่ยวกับพรีออนและที่คล้าย ๆ กันโรคทำให้ประสาทเสื่อมหลายอย่างรวมทั้งโรคพาร์คินสันและโรคอัลไซเมอร์เชื่อว่า เกิดจากการม้วนตัวผิด ๆ ซึ่งก่อสภาวะโรคของโปรตีนต่าง ๆ นอกเซลล์ที่เรียกว่าพรีออน สมมติฐานนี้เริ่มได้หลักฐานมากขึ้น ๆ ในงานศึกษาในสิ่งแวดล้อมที่ทำเทียม (in vitro) และบางส่วนที่ทำในสัตว์ (in vivo) โปรตีนเช่นนี้ยังตรวจพบเพิ่มขึ้นเรื่อย ๆ ในน้ำเลือดของคนไข้โรคเหล่านี้ (โดยเฉพาะโปรตีน alpha-synuclein ในคนไข้โรคอัลไซเมอร์) ขอบเขตและกลไกที่โปรตีนคล้ายพรีออนเหล่านี้ผ่านเข้าไปใน BBB ได้ยังไม่ชัดเจน ภาวะสมองอักเสบจากเอชไอวีเชื่อว่า[62] เชื้อเอชไอวีแฝง (latent) สามารถข้าม BBB เมื่ออยู่ในโมโนไซต์ที่ไหลเวียนอยู่ในเลือด (เรียกสมมติฐานนี้ว่า "Trojan horse theory") ภายใน 14 วันแรกที่ติดเชื้อ เมื่อเข้าไปแล้ว โมโนไซต์ก็จะแปลงเป็นมาโครฟาจ (macrophage) ซึ่งก็ปล่อยอนุภาคไวรัสคือ virion เข้าไปในเนื้อเยื่อสมองที่อยู่ใกล้ ๆ เส้นเลือดฝอย อนุภาคเหล่านี้น่าจะดึงดูดความสนใจของเซลล์ภูมิคุ้มกันคือไมโครเกลียและมาโครฟาจรอบ ๆ เส้นเลือด แล้วจุดชนวนกระบวนการอักเสบเป็นลำดับ ซึ่งอาจก่อการส่งสัญญาณระหว่างเซลล์ (intracellular signaling) ภายในเซลล์เนื้อเยื่อบุโพรง แล้วทำทั้งหน้าที่และโครงสร้างของ BBB ให้เสียหาย[63] เป็นการอักเสบที่เรียกว่า HIV encephalitis (HIVE) HIVE น่าจะเกิดเป็นระยะ ๆ ตลอดการมีโรคเอดส์ และเป็นจุดตั้งต้นให้มีภาวะสมองเสื่อม คือ HIV-associated dementia (HAD) นักวิจัยมักศึกษาการเกิด HIVE ในลิง โรคพิษสุนัขบ้าในช่วงที่หนูติดเชื้อโรคพิษสุนัขบ้าที่ทำให้ถึงตาย BBB จะไม่ยอมให้เซลล์ภูมิคุ้มกันที่ต่อต้านไวรัสเข้าไปในสมอง ซึ่งเป็นบริเวณหลักที่ไวรัสพิษสุนัขบ้าแพร่พันธุ์ ลักษณะเช่นนี้มีผลต่อการก่อโรคของไวรัส ดังนั้น การเพิ่มการผ่านได้ของ BBB อาจช่วยให้กำจัดไวรัสได้ นี่จึงเป็นวิธีการใหม่หนึ่งที่เสนอเพื่อรักษาโรค แต่ก็ยังไม่มีใครพยายามศึกษาดูว่า นี่จะช่วยได้หรือไม่ การอักเสบทั่วร่างกายการอักเสบในร่างกายอาจมีผลต่อสมองผ่าน BBB เพราะเมื่อมีการอักเสบทั่วร่างกาย (systemic inflammation) ไม่ว่าจะเป็นการติดเชื้อหรือการอักเสบที่ไม่ใช่การติดเชื้อ BBB อาจแปรสภาพ[64] แม้การอักเสบเช่นนี้อาจจะเป็นการตอบสนองที่มีประโยชน์เนื่องกับการอักเสบทั่วร่างกาย แต่ก็อาจก่อผลไม่ดีในระบบประสาทกลาง ความเปลี่ยนแปลงของ BBB น่าจะมีบทบาทต่อพฤติกรรมเมื่อเจ็บป่วย (sickness behaviour) ของคนไข้เมื่อติดเชื้อทั่วร่างกาย[65] ความเปลี่ยนแปลงก็อาจจุดชนวนหรือเร่งภาวะโรคภายในสมอง เช่น โรคปลอกประสาทเสื่อมแข็ง (MS) และโรคอัลไซเมอร์ ซึ่งอาจอธิบายเป็นบางส่วนได้ว่า ทำไมคนไข้โรคเหล่านี้จึงแย่ลงเมื่อติดเชื้อ[66][67] อนึ่ง คนไข้ที่มีโรคทางประสาทอาจมี BBB ที่ไวต่อผลของการติดเชื้อทั้งระบบ ประวัตินพ. เพาล์ แอร์ลิช เป็นนักวิทยาแบคทีเรียที่ศึกษาการแต้มสีตัวอย่าง ซึ่งเป็นวิธีการที่ใช้ในการศึกษาทางกล้องจุลทรรศน์หลายอย่าง เพื่อทำให้โครงสร้างทางชีวภาพมองเห็นได้ด้วยสีเคมี[68] เมื่อหมอฉีดสี (โดยเฉพาะ aniline dye ที่ใช้อย่างกว้างขวางในสมัยนั้น) สีก็จะเปื้อนอวัยวะต่าง ๆ ของสัตว์ยกเว้นสมอง[68] ในเวลานั้น หมอเข้าใจว่า สมองไม่ติดสีเท่ากันเพียงเท่านั้น[69] แต่ในการทดลองต่อมาปี 1913 นักศึกษาของหมอเองคือ เอ็ดวิน โกลด์แมนน์ ได้ฉีดสีเข้าไปในน้ำสมองร่วมไขสันหลัง (CSF) ของสัตว์โดยตรง แล้วพบว่า สมองติดสีแต่ร่างกายที่เหลือไม่ติด ซึ่งแสดงความแยกกันระหว่างร่างกายกับสมอง ในเวลานั้น เชื่อว่าตัวเส้นเลือดเองเป็นตัวกั้น เพราะไม่พบเนื้อเยื่ออะไรอื่น ๆ ที่ชัดเจน อย่างไรก็ดี แพทย์ชาวเบอร์ลิน (Lewandowsky) ได้เสนอแนวคิดเรื่องตัวกั้นระหว่างเลือดกับสมอง (เรียกว่า hematoencephalic barrier ในเวลานั้น) ตั้งแต่ปี 1900 แล้ว[70] ดูเพิ่ม
เชิงอรรถ
อ้างอิง
บรรณานุกรม
แหล่งข้อมูลอื่น
|
||||||||||||||||
