|
มาลาเรีย
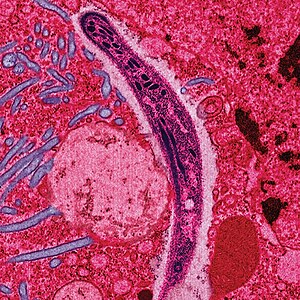
มาลาเรีย (อังกฤษ: malaria) หรือไข้จับสั่น ไข้ป่า ไข้ป้าง ไข้ร้อนเย็นหรือไข้ดอกสัก เป็นโรคติดเชื้อของมนุษย์และสัตว์อื่นที่มียุงเป็นพาหะ มีสาเหตุจากปรสิตโปรโตซัว (จุลินทรีย์เซลล์เดียวประเภทหนึ่ง) ในสกุล Plasmodium (พลาสโมเดียม) อาการทั่วไปคือ มีไข้ อ่อนเพลีย อาเจียนและปวดศีรษะ ในรายที่รุนแรงอาจทำให้ตัวเหลือง ชัก โคม่าหรือเสียชีวิตได้[1] โรคมาลาเรียส่งผ่านโดยการกัดของยุงเพศเมียในสกุล Anopheles (ยุงก้นปล่อง) และปกติอาการเริ่ม 10 ถึง 15 วันหลังถูกกัด หากไม่ได้รับการรักษาอย่างเหมาะสม บุคคลอาจมีอาการของโรคในอีกหลายเดือนให้หลัง ในผู้ที่เพิ่งรอดจากการติดเชื้อ การติดเชื้อซ้ำมักมีอาการเบากว่า การต้านทานบางส่วนนี้จะหายไปในเวลาเป็นเดือนหรือปีหากบุคคลไม่ได้สัมผัสมาลาเรียอย่างต่อเนื่อง[1] เมื่อถูกยุง Anopheles เพศเมียกัดจะนำเชื้อปรสิตจากน้ำลายของยุงเข้าสู่เลือดของบุคคล ปรสิตจะไปตับซึ่งจะเจริญเติบโตและสืบพันธุ์ มนุษย์สามารถติดเชื้อและส่งต่อ Plasmodium ห้าสปีชีส์ ผู้เสียชีวิตส่วนมากเกิดจากเชื้อ P. falciparum เพราะ P. vivax, P. ovale และ P. malariae โดยทั่วไปก่อให้เกิดมาลาเรียแบบที่รุนแรงน้อยกว่า สปีชีส์รับจากสัตว์ P. knowlesi พบมากในเอเชียตะวันออกเฉียงใต้ การวินิจฉัยมาลาเรียตรงแบบทำโดยการตรวจเลือดด้วยกล้องจุลทรรศน์โดยใช้ฟิล์มเลือดหรือการวินิจฉัยชนิดรวดเร็ว (rapid diagnostic test) ที่อาศัยแอนติเจน มีการพัฒนาวิธีซึ่งใช้ปฏิกิริยาลูกโซ่พอลิเมอเรสเพื่อตรวจจับดีเอ็นเอของปรสิต แต่ยังไม่มีใช้แพร่หลายในพื้นที่ซึ่งมีโรคมาลาเรียทั่วไปเนื่องจากราคาแพงและซับซ้อน[5] ความเสี่ยงของโรคลดได้โดยการป้องกันไม่ให้ถูกยุงกัด โดยใช้มุ้งหรือสารขับไล่แมลง หรือด้วยมาตรการควบคุมยุง เช่น การฉีดพ่นยาฆ่าแมลงหรือการระบายน้ำนิ่ง มียารักษาโรคหลายชนิดที่ป้องกันมาลาเรียในผู้ที่เดินทางไปยังบริเวณที่พบโรคมาลาเรียทั่วไป แนะนำให้ใช้ยารักษาโรคซัลฟาด็อกซีน/ไพริเมธามีนบางครั้งในทารกและหลังไตรมาสแรกของการตั้งครรภ์ในบริเวณซึ่งมีโรคมาลาเรียอัตราสูง โรคมาลาเรียยังไม่มีวัคซีน แต่กำลังพัฒนา[2] การรักษาโรคมาลาเรียที่แนะนำ คือ การใช้ยาต้านมาลาเรียหลายชนิดร่วมกันซึ่งรวมอาร์ตีมิซินิน[2][1] ยาชนิดที่สองอาจเป็นเมโฟลควิน ลูมีแฟนทรีนหรือซัลฟาด็อกซีน/ไพริเมธามีน[6] อาจใช้ควินินร่วมกับด็อกซีไซคลินได้หากไม่มีอาร์ติมิซินิน[6] แนะนำว่าในพื้นที่ซึ่งมีโรคมาลาเรียทั่วไป ให้ยืนยันโรคมาลาเรียหากเป็นไปได้ก่อนเริ่มการรักษาเนื่องจากความกังวลว่ามีการดื้อยาเพิ่มขึ้น มีการพัฒนาการดื้อยาในปรสิตต่อยาต้านมาลาเรียหลายชนิด เช่น P. falciparum ซึ่งดื้อต่อคลอโรควินได้แพร่ไปยังพื้นที่ซึ่งมีการระบาดมากที่สุด และการดื้อยาอาร์ทีมิซินินเป็นปัญหาในบางพื้นที่ของเอเชียตะวันออกเฉียงใต้[2] โรคนี้แพร่หลายในเขตร้อนและอบอุ่นซึ่งอยู่เป็นแถบกว้างรอบเส้นศูนย์สูตร[1] ซึ่งรวมพื้นที่แอฟริกาใต้สะฮารา ทวีปเอเชียและละตินอเมริกาบริเวณกว้าง โรคมาลาเรียมักสัมพันธ์กับความยากจนและยังอาจเป็นอุปสรรคต่อการพัฒนาเศรษฐกิจ[7][8] ในทวีปแอฟริกา มีการประเมินว่ามีการสูญเสีย 12,000 ล้านดอลลาร์สหรัฐต่อปีเนื่องจากค่าใช้จ่ายสาธารณสุขเพิ่มขึ้น เสียความสามารถการทำงาน และผลเสียต่อการท่องเที่ยว[9] องค์การอนามัยโลกประเมินว่ามีผู้ป่วย 198 ล้านคน ใน พ.ศ. 2556[10][11] มีผู้เสียชีวิตด้วยโรคมาลาเรียระหว่าง 584,000 ถึง 855,000 คน ส่วนใหญ่ (90%) เกิดในทวีปแอฟริกา[10][12] อาการและอาการแสดง ปกติอาการและอาการแสดงของมาลาเรียจะเริ่มต้น 8–25 วันหลังการติดเชื้อ[13] อย่างไรก็ดี อาการอาจเกิดขึ้นหลังจากนี้ในผู้ที่ทานยาต้านมาลาเรียป้องกันไว้ก่อน[5] การแสดงเริ่มต้นของโรคเป็นอาการคล้ายหวัด[14] ซึ่งเหมือนกันในมาลาเรียทุกสปีชีส์ และสามารถเหมือนกับอาการป่วยอื่น เช่น ภาวะเลือดเป็นพิษ กระเพาะอาหารและลำไส้เล็กอักเสบ และโรคไวรัส[5] การแสดงอาการอาจรวมปวดศีรษะ เป็นไข้ สั่น ปวดในข้อ อาเจียน โลหิตจางเพราะเม็ดเลือดแดงแตก ดีซ่าน มีฮีโมโกลบินในปัสสาวะ จอตาเสียหายและการชัก[15] อาการตรงต้นแบบของมาลาเรีย คือ อาการกำเริบ ซึ่งเป็นการเกิดการหนาวฉับพลัน ตามด้วยการสั่น และไข้และเหงื่อออกเป็นวัฏจักร แต่ละสปีชีส์มีความถี่ต่างกัน ในการติดเชื้อ P. vivax และ P. ovale อาการกำเริบทุกสองวัน P. malariae อาการกำเริบทุกสามวัน การติดเชื้อ P. falciparum สามารถเกิดไข้กลับทุก 36–48 ชั่วโมงหรือไข้แทบไม่สร่าง[16] มาลาเรียรุนแรงปกติเกิดจาก P. falciparum อาการแสดงของมาลาเรียประเภทนี้เริ่มขึ้น 9–30 วันหลังการติดเชื้อ[14] บุคคลที่มีมาลาเรียขึ้นสมอง (cerebral malaria) มักแสดงอาการทางระบบประสาทบ่อยครั้ง ซึ่งรวมถึงท่าร่างผิดปกติ อาการตากระตุกแกว่ง อัมพาตเมื่อดูด้วยสองตา (ตาไม่สามารถกลอกไปในทิศทางเดียวกัน) อาการเกร็งหลังแอ่น ชักหรือโคม่า[14] ภาวะแทรกซ้อนโรคมาลาเรียมีภาวะแทรกซ้อนรุนแรงหลายอย่าง ภาวะแทรกซ้อนหนึ่งคือการพัฒนาการหายใจอึดอัด ซึ่งเกิดขึ้นมากถึง 25% ในผู้ใหญ่ และ 40% ในเด็กที่ป่วยด้วยมาลาเรียชนิด P. falciparum รุนแรง สาเหตุอาจเนื่องจากการชดเชยภาวะเลือดเป็นกรดเมตะบอลิกด้วยการหายใจ ปอดบวมน้ำที่ไม่ได้มีสาเหตุจากโรคหัวใจ ปอดบวมเกิดร่วม และโลหิตจางรุนแรง กลุ่มอาการหายใจลำบากเฉียบพลันพบได้ 5–25% ของผู้ใหญ่ และมากถึง 29% ของสตรีมีครรภ์ ทว่าพบน้อยในเด็กเล็กที่ป่วยเป็นโรคมาลาเรียรุนแรง[17] การติดเชื้อเอชไอวีร่วมกับมาลาเรียเพิ่มอัตราตาย[18] ภาวะไตล้มเหลวเป็นลักษณะของไข้น้ำดำ ซึ่งฮีโมโกลบินจากเม็ดเลือดแดงที่แตกรั่วออกสู่ปัสสาวะ[14] การติดเชื้อ P. falciparum อาจส่งผลให้เกิดมาลาเรียขึ้นสมอง ซึ่งเป็นรูปแบบของมาลาเรียรุนแรงที่มีโรคสมองร่วมด้วย ภาวะดังกล่าวสัมพันธ์กับจอตาขาว (retinal whitening) ซึ่งอาจเป็นอาการแสดงทางคลินิกที่มีประโยชน์ในการแยกมาลาเรียจากสาเหตุอื่นของไข้[19] นอกจากนี้ยังอาจเกิดม้ามโต ปวดศีรษะรุนแรง ตับโต น้ำตาลในเลือดต่ำ และมีฮีโมโกลบินในปัสสาวะร่วมกับไตล้มเหลวได้[14] มาลาเรียในสตรีมีครรภ์เป็นสาเหตุสำคัญของการตายคลอด ทารกตายและมีน้ำหนักแรกคลอดต่ำ[20] โดยเฉพาะอย่างยิ่งในการติดเชื้อ P. falciparum แต่การติดเชื้อ P. vivax ก็พบได้[21] สาเหตุปรสิตมาลาเรียเป็นสิ่งมีชีวิตในสกุล Plasmodium (ไฟลัม Apicomplexa) P. falciparum, P. malariae, P. ovale, P. vivax และ P. knowlesi[22][23] เป็นสาเหตุของมาลาเรียในมนุษย์ ซึ่งในสปีชีส์เหล่านี้ P. falciparum เป็นสปีชีส์ที่พบมากที่สุด (~75%) รองลงมาคือ P. vivax (~20%)[5] แม้ว่าเดิม P. falciparum เป็นชนิดที่ทำให้มีผู้เสียชีวิตมากที่สุด[24] แต่หลักฐานปัจจุบันเสนอว่า มาลาเรีย P. vivax สัมพันธ์กับภาวะที่อาจอันตรายถึงชีวิตได้บ่อยครั้งเท่ากับการวินิจฉัยการติดเชื้อ P. falciparum[25] มาลาเรีย P. vivax พบนอกทวีปแอฟริกามากกว่าโดยสัดส่วน[26] มีการบันทึกการติดเชื้อมาลาเรียพลาสโมเดียมสปีชีส์ที่มาจากลิงไม่มีหางชั้นสูงในมนุษย์ อย่างไรก็ดี สปีชีส์เหล่านี้ส่วนใหญ่มีความสำคัญทางสาธารณสุขน้อย[27] โดยยกเว้น P. knowlesi ซึ่งเป็นสปีชีส์รับจากสัตว์ที่ก่อโรคมาลาเรียในลิงมาคาก[23] ภาวะโลกร้อนน่าจะส่งผลต่อการส่งผ่านโรคมาลาเรีย แต่ความรุนแรงและการกระจายทางภูมิศาสตร์ของผลดังกล่าวยังไม่แน่ชัด[28][29] วงจรชีวิต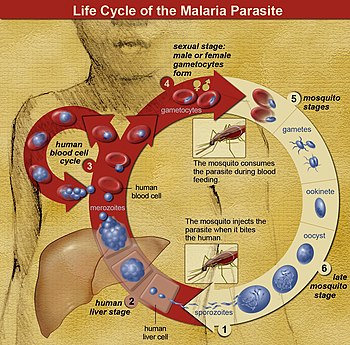 ในวงจรชีวิตของ Plasmodium ยุงก้นปล่องเพศเมีย (ตัวถูกเบียนแท้) ส่งผ่านระยะติดต่อที่เคลื่อนที่ได้ (เรียก สปอโรซอยต์) มายังตัวถูกเบียนสัตว์มีกระดูกสันหลัง เช่น มนุษย์ (ตัวถูกเบียนมัธยันตร์) ฉะนั้นยุงก้นปล่องจึงเป็นเสมือนตัวนำโรคแพร่เชื้อ สปอโรซอยต์เดินทางผ่านเส้นเลือดไปยังเซลล์ตับ ที่ซึ่งมันจะสืบพันธุ์แบบไม่อาศัยเพศ (เรียกว่า tissue schizogony) ทำให้ได้เมอโรซอยต์นับหลายพันเซลล์ เมอโรซอยต์เหล่านี้เข้าไปติดเซลล์เม็ดเลือดแดงใหม่และเริ่มต้นวงจรการเพิ่มจำนวนแบบไม่อาศัยเพศ (เรียกว่า blood schizogony) ซึ่งทำให้ได้เมอโรซอยต์ที่สามารถติดเชื้อได้ใหม่ 8 ถึง 24 เซลล์ ในระยะนี้ เซลล์จะระเบิดและวงจรการติดเชื้อเริ่มต้นใหม่[30] เมอโรซอยต์อื่นเจริญไปเป็นแกมีโตไซต์ที่ยังเจริญไม่เต็มที่ (immature gametocyte) ซึ่งเป็นเซลล์ต้นกำเนิดของเซลล์สืบพันธุ์เพศผู้และเพศเมีย เมื่อยุงกัดมนุษย์ แกมีโตไซต์จะถูกดูดจากเลือดและไปเจริญในทางเดินอาหารของยุง แกมีโตไซต์เพศผู้และเพศเมียผสมกันและก่อเป็นโอโอไคนีต (ookinete) ซึ่งเป็นไซโกตที่ได้รับการผสมและเคลื่อนที่ได้ จากนั้นโอโอไคนีตเจริญไปเป็นสปอโรซอยต์ใหม่ที่จะเคลื่อนที่ไปยังต่อมน้ำลายของยุง และพร้อมที่จะติดเชื้อตัวถูกเบียนสัตว์มีกระดูกสันหลังใหม่ เมื่อยุงดูดเลือดอีก สปอโรซอยต์ในน้ำลายจะถูกฉีดเข้าสู่ผิวหนัง[31] เฉพาะยุงเพศเมียเท่านั้นที่ดูดเลือด ส่วนยุงเพศผู้กินน้ำต้อยของพืชเป็นอาหาร ฉะนั้นจึงไม่ส่งต่อโรค ยุงก้นปล่องเพศเมียมักดูดเลือดในยามกลางคืน โดยปกติเริ่มค้นหาอาหารในช่วงเย็น และจะค้นหาต่อไปทั้งคืนจนกว่าจะได้ดูดเลือด[32] ปรสิตมาลาเรียยังสามารถส่งผ่านได้โดยการถ่ายเลือด แม้จะพบน้อยก็ตาม[33] มาลาเรียกลับเป็นซ้ำอาการแสดงของมาลาเรียสามารถกลับเป็นซ้ำได้หลังจากช่วงที่ไม่มีอาการแสดงต่าง ๆ กัน การกลับเป็นซ้ำนี้สามารถจำแนกตามสาเหตุได้เป็นการกลับกำเริบ การเป็นโรคกลับหรือการติดเชื้อซ้ำ การกลับกำเริบคือ การที่กลับแสดงอาการอีกครั้งหลังช่วงที่ไม่แสดงอาการ ซึ่งเกิดจากปรสิตที่ยังหลงเหลืออยู่ในเลือดซึ่งเป็นผลจากการรักษาที่ไม่เพียงพอหรือไม่มีประสิทธิภาพ[34] การเป็นโรคกลับคือการที่กลับแสดงอาการหลังปรสิตถูกกำจัดหมดไปจากเลือดแล้วแต่ยังคงอยู่เป็นฮิพโนซอยต์แฝงในเซลล์ตับ การเป็นโรคกลับมักเกิดระหว่าง 8–24 สัปดาห์และมักพบในการติดเชื้อ P. vivax และ P. ovale[5] ผู้ป่วยมาลาเรียชนิด P. vivax ในเขตอบอุ่นมักสัมพันธ์กับการที่ฮิพโนซอยต์มีชีวิตอยู่ในฤดูหนาว โดยการเป็นโรคกลับเริ่มต้นในปีถัดจากปีที่ถูกยุงกัด[35] การติดเชื้อซ้ำหมายถึงปรสิตที่ก่อการติดเชื้อครั้งก่อนได้ถูกกำจัดหมดไปจากร่างกายแล้ว แต่มีการได้รับปรสิตใหม่เข้ามา การติดเชื้อซ้ำไม่สามารถแยกจากการกลับกำเริบได้ทันที แม้ว่าการกลับติดเชื้อซ้ำภายในสองสัปดาห์ของการรักษาการติดเชื้อครั้งแรกมักมีสาเหตุจากความล้มเหลวในการรักษา[36] บุคคลอาจแสดงภูมิคุ้มกันระยะสั้น (premunity) ในกรณีการติดเชื้อซ้ำได้[37] พยาธิกำเนิดโรคมาลาเรียในมนุษย์มีสองระยะ ระยะหนึ่งอยู่นอกเม็ดเลือดแดง คืออยู่ในเซลล์ตับ อีกระยะหนึ่งอยู่ในเม็ดเลือดแดง เมื่อยุงที่ติดเชื้อมาลาเรียไปดูดเลือดจากมนุษย์ สปอโรซอยต์ในน้ำลายของยุงตัวนั้นจะเข้าไปสู่กระแสเลือด แล้วเชื้อจะเดินทางไปตับ เมื่อไปถึงแล้ว เชื้อจะเข้าไปอยู่ในเซลล์ตับ และจะเพิ่มจำนวนแบบไม่อาศัยเพศโดยไม่แสดงอาการเป็นเวลา 8–30 วัน[38] หลังระยะสงบอยู่ในตับ เชื้อมาลาเรียจะเปลี่ยนแปลงไปให้เมอโรซอยต์หลายพันเซลล์ เมื่อเซลล์ตัวถูกเบียนแตก เมอโรซอยต์เหล่านี้จะเล็ดรอดเข้าสู่กระแสเลือดเพื่อเริ่มวงจรชีวิตระยะในเม็ดเลือดแดง[38] เชื้อนี้ออกจากตับโดยเอาเยื่อหุ้มเซลล์ของเซลล์ตับคลุมตัวเองไว้ ภูมิคุ้มกันจึงไม่สามารถตรวจจับได้[39] ในเม็ดเลือดแดง เชื้อจะเพิ่มจำนวนแบบไม่อาศัยเพศอีกครั้ง เมื่อได้จำนวนมากถึงระดับหนึ่งก็จะทำให้เม็ดเลือดแดงแตกออก และเชื้อจำนวนมากก็จะถูกแพร่เข้าสู่กระแสเลือดไปสู่เม็ดเลือดแดงใหม่ต่อไป แต่ละครั้งที่เม็ดเลือดแดงแตกออกและมีเชื้อจำนวนมากเข้าสู่กระแสเลือดพร้อมกัน ผู้ป่วยจะมีไข้เป็นระยะ[38] ซึ่งช่วงของการเกิดไข้จะเป็นไปแล้วแต่ชนิดของเชื้อ การมีไข้จับเป็นระยะนี้เอง ที่เรียกว่า "จับไข้" สปอโรซอยต์ P. vivax บางส่วนไม่เจริญไปเป็นเมอโรซอตยต์ระยะนอกเม็ดเลือดแดงทันที แต่จะผลิตฮิปโนซอยต์ (hypnozoite) ซึ่งสงบอยู่ระยะหนึ่งตั้งแต่หลายเดือน (ปกติ 7–10 เดือน) ถึงหลายปี หลังระยะสงบอยู่ ฮิปโนซอยต์จะกลับมาพัฒนาไปเป็นเมอโรซอนต์อีก ฮิปโนซอยต์เป็นสาเหตุที่การติดเชื้อ P. vivax มีระยะฟักนานและการเป็นโรคกลับภายหลัง[35] ยังไม่ทราบแน่ชัดว่า P. ovale มีระยะฮิปโนซอยต์ด้วยหรือไม่ [40] ปรสิตมาลาเรียแทบไม่ถูกระบบภูมิคุ้มกันของร่างกายกำจัด เพราะวงจรชีวิตในมนุษย์ส่วนใหญ่อยู่ในเซลล์ตับและเซลล์เม็ดเลือดแดง ทำให้ภูมิคุ้มกันของร่างกายตรวจไม่พบ อย่างไรก็ดี เซลล์เม็ดเลือดที่ติดเชื้อจะถูกกรองและทำลายทิ้งที่ม้าม ซึ่งเป็นการทำลายเชื้อได้ทางหนึ่ง อย่างไรก็ดี เชื้อ P. falciparum มีวิธีหลบหลีกจากกระบวนการของร่างกายดังกล่าวโดยปรสิตจะมีการสร้างโปรตีนยึดเกาะบนผิวเซลล์เม็ดเลือดแดง ทำให้เม็ดเลือดแดงที่ติดเชื้อไปติดอยู่กับผนังหลอดเลือดขนาดเล็ก ซึ่งทำให้เม็ดเลือดติดเชื้อนั้นไม่ถูกกำจัดที่ม้าม[41] การอุดกั้นหลอดเลือดขนาดเล็กก่อให้เกิดอาการ เช่น ในมาลาเรียรก (placental malaria)[42] เซลล์เม็ดเลือดแดงที่ติดผนังหลอดเลือดขนาดเล็กนี้สามารถเจาะผ่าน blood–brain barrier และทำให้เกิดมาลาเรียขึ้นสมอง (cerebral malaria) ได้[43] ความต้านทานทางพันธุกรรมตามการทบทวนในปี 2548 โรคมาลาเรียได้สร้างความกดดันการคัดเลือกที่ยิ่งใหญ่ที่สุดต่อจีโนมมนุษย์ในประวัติศาสตร์ล่าสุด เนื่องจากระดับอัตราตายและอัตราการเกิดโรคจากมาลาเรียสูง โดยเฉพาะอย่างยิ่งชนิด P. falciparum ปัจจัยทางพันธุกรรมหลายอย่างให้ความต้านทานมาลาเรียบ้าง เช่น ลักษณะเซลล์รูปเคียว ลักษณะธาลัสซีเมีย ภาวะพร่องกลูโคส-6-ฟอสเฟต ดีไฮโดรจีเนส และการขาดแอนติเจนดัฟฟีบนเม็ดเลือดแดง[44][45] ผลกระทบของลักษณะเซลล์รูปเคียวต่อภูมิคุ้มกันมาลาเรียแสดงถึงการแลกเปลี่ยนทางวิวัฒนาการซึ่งเกิดขึ้นเพราะมาลาเรียประจำถิ่น ลักษณะเซลล์รูปเคียวก่อให้เกิดความบกพร่องในโมเลกุลฮีโมโกลบินในเลือด โมเลกุลเอสที่เปลี่ยนแปลงของฮีโมโกลบินทำให้เซลล์กลายเป็นรูปเคียวหรือบิดเบี้ยวเป็นทรงโค้ง ขณะที่เม็ดเลือดแดงปกติจะคงทรงเว้าเข้าหากัน เนื่องจากทรงรูปเคียว เม็ดเลือดแดงจึงมีประสิทธิภาพรับหรือปล่อยออกซิเจนด้อยกว่าปกติ การติดเชื้อมาลาเรียทำให้เม็ดเลือดแดงเป็นทรงเคี้ยวยิ่งขึ้น ฉะนั้นจึงถูกขจัดออกจากระบบไหลเวียนโลหิตเร็วขึ้น จึงเป็นการลดความถี่ซึ่งปรสิตมาลาเรียจะครบวงจรชีวิตในเซลล์ บุคคลที่เป็นฮอโมไซกัส (คือ มีแอลลีลฮีโมโกลบินบีตาที่ผิดปกติสองแอลลีล) จะเป็นโลหิตจางเม็ดเลือดแดงรูปเคียว ขณะที่ผู้ที่เป็นเฮเทอโรไซกัส (คือ มีแอลลีลปกติและผิดปกติอย่างละหนึ่ง) จะมีความต้านทานต่อมาลาเรีย แม้ว่าความคาดหมายการคงชีพของผู้มีสภาพฮอโมไซกัสจะไม่ดำรงความอยู่รอดของลักษณะดังกล่าว แต่ลักษณะนี้ยังสืบทอดมาเพราะประโยชน์จากแบบเฮเทอโรไซกัส[45][46] การทำหน้าที่ผิดปรกติของตับการทำหน้าที่ผิดปรกติของตับอันเป็นผลจากมาลาเรียนั้นพบไม่บ่อยและโดยปกติเกิดเฉพาะในผู้ที่มีภาวะของตับอื่นอยู่ก่อนแล้ว เช่น ตับอักเสบจากไวรัสหรือโรคตับเรื้อรัง กลุ่มอาการดังกล่าวบางครั้งเรียก ตับอักเสบมาลาเรีย (malarial hepatitis) แม้ว่าจะถูกมองว่าเป็นเหตุการณ์ที่เกิดขึ้นน้อย แต่พบโรคตับมาลาเรียมากขึ้น โดยเฉพาะอย่างยิ่งในเอเชียตะวันออกเฉียงใต้และอินเดีย ความไวของตับในผู้ป่วยมาลาเรียสัมพันธ์กับโอกาสมีภาวะแทรกซ้อนและการเสียชีวิตมากขึ้น[47] การวินิจฉัย 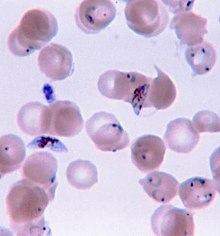 เนื่องจากมาลาเรียแสดงอาการไม่จำเพาะ การวินิจฉัยมาลาเรียนอกพื้นที่ประจำถิ่นต้องมีความสงสัยระดับสูง ซึ่งอาจค้นหาได้จากต่อไปนี้ ประวัติเดินทางล่าสุด ม้ามโต มีไข้ เกล็ดเลือดในเลือดต่ำ และมีระดับบิลิรูบินในเลือดสูงกว่าปกติร่วมกับระดับเม็ดเลือดขาวปกติ[5] มักยืนยันมาลาเรียด้วยการตรวจฟิล์มเลือดด้วยกล้องจุลทรรศน์ หรือด้วยการทดสอบวินิจฉัยรวดเร็ว (RDT) โดยใช้แอนติเจน[48][49] จุลทรรศนศาสตร์เป็นวิธีที่ใช้มากที่สุดเพื่อตรวจจับปรสิตมาลาเรีย โดยในปี 2553 มีการตรวจฟิล์มเลือดเพื่อหามาลาเรียราว 165 ล้านฟิล์ม[50] แม้ว่าจะมีการใช้แพร่หลาย การวินิจฉัยด้วยจุลทรรศนศาสตร์มีข้อเสียหลักสองประการ คือ หลายสถานที่ (โดยเฉพาะอย่างยิ่งในชนบท) ไม่มีเครื่องมือเพียงพอที่จะดำเนินการทดสอบ และความแม่นของผลขึ้นอยู่กับทั้งทักษะของผู้ตรวจฟิล์มเลือดและระดับปรสิตในเลือด ความไวของฟิล์มเลือดมีพิสัยตั้งแต่ 75–90% ในสภาพเหมาะที่สุด ไปจนถึง 50% ชุดน้ำยาตรวจอย่างรวดเร็วที่มีขายเชิงพาณิชย์มักทำนายการมีปรสิตมาลาเรียได้แม่นกว่าฟิล์มเลือด แต่ชุดน้ำยาตรวจดังกล่าวมีความไวและความจำเพาะวินิจฉัยแปรผันขึ้นอยู่กับผู้ผลิต และไม่สามารถบอกได้ว่ามีปรสิตมากเท่าใด[50] ในท้องที่ที่การทดสอบทางห้องปฏิบัติการมีพร้อมแล้ว ควรตั้งข้อสงสัยหรือทดสอบหามาลาเรียในผู้ป่วยทุกคนที่อยู่ในพื้นที่ซึ่งมีมาลาเรียประจำถิ่น ในพื้นที่ซึ่งไม่สามารถจ่ายการทสอบวินิจฉัยทางห้องปฏิบัติการได้ การใช้เพียงประวัติไข้เพื่อเป็นการบ่งชี้การรักษามาลาเรียกลายเป็นปกติ ซึ่งเป็นคำสอนปกติ "ไข้เท่ากับมาลาเรียเว้นแต่พิสูจน์ได้เป็นอย่างอื่น" ข้อเสียของการปฏิบัตินี้คือ การวินิจฉัยมาลาเรียเกินความเป็นจริงและการจัดการกับไข้ที่ไม่ได้สาเหตุจากมาลาเรียอย่างผิด ๆ ซึ่งสิ้นเปลืองทรัพยากรอันจำกัด บั่นทอนความเชื่อมั่นในระบบสาธารณสุขและส่งเสริมการดื้อยา[51] แม้จะมีการพัฒนาการทดสอบที่ใช้ปฏิกิริยาลูกโซ่พอลิเมอเรสขึ้น แต่ในปี 2555 การทดสอบดังกล่าวยังไม่มีใช้แพร่หลายในพื้นที่ซึ่งพบมาลาเรียเป็นปกติ เนื่องจากเป็นวิธีที่ซับซ้อน[5] การจำแนกองค์การอนามัยโลกจำแนกมาลาเรียเป็น "มีอาการรุนแรง" หรือ "ไม่มีอาการแทรกซ้อน"[5] หากเข้าข่ายเกณฑ์ด้านล่างนี้แม้แต่ข้อหนึ่งให้เป็นมาลาเรียที่มีอาการรุนแรง มิฉะนั้นให้ถือเป็นมาลาเรียที่ไม่มีอาการแทรกซ้อน[52]
มาลาเรียขึ้นสมองนิยามว่าเป็นมาลาเรียชนิด P. falciparum ที่มีอาการรุนแรงซึ่งแสดงด้วยอาการทางประสาทวิทยา รวมถึงโคม่า (โดยมีแบบประเมินความรู้สึกตัวของกลาสโกวน้อยกว่า 11 หรือแบบประเมินความรู้สึกตัวแบลนไทร์มากกว่า 3) หรือโคม่าที่กินเวลานานกว่า 30 นาทีหลังชัก[53] การป้องกันวิธีซึ่งใช้ป้องกันมาลาเรีย ได้แก่ ยารักษาโรค การกำจัดยุงและการป้องกันไม่ให้ถูกยุงกัด ไม่มีวัคซีนมาลาเรีย มาลาเรียจะมีในพื้นที่ซึ่งมีความหนาแน่นของประชากรมนุษย์สูง มีความหนาแน่นของประชากรยุงก้นปล่องสูงและอัตราการส่งผ่านจากมนุษย์สู่ยุงและจากยุงสู่มนุษย์สูง หากปัจจัยข้อหนึ่งข้อใดลดลงมากพอ ปรสิตมาลาเรียจะหายไปจากพื้นที่นั้นในที่สุด ดังที่เกิดขึ้นแล้วในทวีปอเมริกาเหนือ ทวีปยุโรปและตะวันออกกลางบางส่วน ทว่า แม้ว่าปรสิตมาลาเรียจะถูกกำจัดหมดไปจากโลกแล้ว ปรสิตก็อาจกลับมาหากสภาวะต่าง ๆ กลับเอื้ออำนวยต่อการสืบพันธุ์ของปรสิตอีก ยิ่งไปกว่านั้น ราคาต่อคนของการกำจัดยุงก้นปล่องเพิ่มขึ้นเมื่อความหนาแน่นของประชากรลดลง ทำให้วิธีดังกล่าวไม่คุ้มค่าทางเศรษฐกิจในบางพื้นที่[54] การป้องกันมาลาเรียอาจคุ้มค่ากว่าการรักษาโรคในระยะยาว แต่ประชากรยากจนที่สุดของโลกไม่สามารถจ่ายราคาเริ่มต้นได้ ราคาการควบคุม (ให้ความประจำถิ่นต่ำ) และโครงการกำจัดในแต่ละประเทศมีผลต่างกว้าง ตัวอย่างเช่น ในประเทศจีน ซึ่งรัฐบาลในปี 2553 ประกาศยุทธศาสตร์ในการกำจัดมาลาเรียในจีน การลงทุนที่กำหนดเป็นสัดส่วนน้อยของรายจ่ายสาธารณะด้านสาธารณสุข ในทางตรงข้าม โครงการคล้ายกันในประเทศแทนซาเนียจะมีมูลค่าประเมินไว้หนึ่งในห้าของงบประมาณสาธารณสุข[55] การควบคุมตัวนำโรคการควบคุมตัวนำโรค หมายถึง วิธีซึ่งใช้ลดมาลาเรียด้วยการลดระดับการส่งผ่านโดยยุง สำหรับการป้องกันส่วนบุคคล สารขับไล่แมลงอันทรงประสิทธิภาพที่สุดอาศัยดีอีอีทีหรือพิคาริดิน[56] มีการแสดงแล้วว่า มุ้งชุบยาฆ่าแมลงและการพ่นเคมีชนิดมีฤทธิตกค้าง (indoor residual spraying) มีประสิทธิภาพสูงในการป้องกันมาลาเรียในเด็กในพื้นที่ซึ่งพบมาลาเรียทั่วไป[57][58] การรักษาผู้ป่วยยืนยันแล้วอย่างทันท่วงทีด้วยการรักษาแบบผสมที่อาศัยอาร์ติมิซินินยังอาจลดการส่งผ่านได้[59] มุ้งช่วยกันยุงจากมนุษย์และลดอัตราการติดเชื้อและส่งผ่านมาลาเรีย มักชุบมุ้งด้วยยาฆ่าแมลงซึ่งออกแบบมาเพื่อฆ่ายุงก่อนยุงหาทางผ่านมุ้งได้ มีการประเมินว่ามุ้งชุบยาฆ่าแมลงมีประสิทธิภาพเป็นสองเท่าของมุ้งที่ไม่ได้ชุบยาและให้การป้องกันดีกว่าการไม่ใช้มุ้ง 70%[60] ระหว่างปี 2543 ถึง 2551 มุ้งชุบยาฆ่าแมลงช่วยชีวิตทารก 250,000 คนโดยประมาณในแอฟริกาใต้สะฮารา[61] ครัวเรือนราว 13% ในประเทศใต้สะฮารามีมุ้งชุบยาฆ่าแมลง[62] ในปี 2543 มุ้งป้องกันเด็กแอฟริกา 1.7 ล้านคน (1.8%) ที่อาศัยอยู่ในสภาวะมาลาเรียประจำถิ่นคงตัว จำนวนเด็กแอฟริกาที่ใช้มุ้งชุบยาฆ่าแมลงเพิ่มขึ้นเป็น 20.3 ล้านคน (18.5%) ในปี 2550 ทว่าอีก 89.6 ล้านคนยังไม่ได้รับการป้องกัน[63] ในปี 2551 มีการประเมินว่าครัวเรือนแอฟริกา 31% มีมุ้งชุบยาฆ่าแมลงอย่างน้อยหนึ่งหลัง มุ้งส่วนมากถูกชุบด้วยไพรีทรอยด์ ซึ่งเป็นยาฆ่าแมลงชนิดมีพิษต่ำ การใช้ที่แนะนำคือให้แขวนมุ้งไว้เหนือกลางเตียงให้แขวนอยู่เหนือเตียงทั้งหมดโดยพับขอบเข้า มุ้งชุบไพรีทรอยต์และมุ้งชุบยาฆ่าแมลงที่ออกฤทธิ์นานให้การป้องกันอย่างดีที่สุด และมีประสิทธิภาพมากที่สุดเมื่อใช้ตั้งแต่เย็นถึงเช้า[64] การพ่นเคมีชนิดมีฤทธิตกค้างเป็นการพ่นยาฆ่าแมลงบนผนังภายในบ้าน หลังดูดเลือดแล้ว ยุงจำนวนมากจะพักบนพื้นผิวใกล้เคียงขณะย่อย ฉะนั้นหากฉาบผนังบ้านด้วยยาฆ่าแมลง ยุงที่พักอยู่จะตายก่อนที่จะทันได้กัดคนอื่นและส่งผ่านปรสิตมาลาเรีย[65] ในปี 2549 องค์การอนามัยโลกแนะนำให้ใช้ยาฆ่าแมลง 12 ชนิดในการพ่นเคมีชนิดมีฤทธิตกค้าง รวมถึงดีดีทีและไซฟลูทรินและเดลตาเมทรินในกลุ่มไพรีทรอยด์[66] อนุสัญญาสต็อกโฮล์มอนุญาตให้ใช้ดีดีทีปริมาณน้อยในทางสาธารณสุข แต่ห้ามการใช้ในทางการเกษตร[67] ปัญหาหนึ่งของการพ่นเคมีชนิดมีฤทธิตกค้างทุกรูปแบบ คือ การดื้อยาฆ่าแมลง ยุงที่ได้รับผลกระทบจากการพ่นเคมีชนิดมีฤทธิตกค้างมีแนวโน้มพักและอาศัยอยู่ในอาคาร และเนื่องจากการระคายเคืองอันเกิดจากการฉีดพ่น ลูกหลานของมันมีแนวโน้มจะพักและอาศัยอยู่นอกอาคารมากกว่า หมายความว่า พวกมันจะได้รับผลกระทบจากการพ่นเคมีชนิดมีฤทธิตกค้างน้อยกว่า[68] มีวิธีอื่นอีกหลายวิธีในการลดยุงกัดและชะลอการระบาดของมาลาเรีย ความพยายามลดลูกน้ำโดยลดการเข้าถึงแหล่งน้ำเปิดซึ่งเป็นที่เจริญของยุงหรือโดยการเพิ่มสารเพื่อลดการเจริญของยุงนั้นมีประสิทธิภาพในบางที่[69] ไม่มีหลักฐานสนับสนุนอุปกรณ์ขับไล่ยุงอิเล็กทรอนิกส์ซึ่งสร้างเสียงความถี่สูงมากซึ่งน่าจะช่วยไล่ยุงเพศเมีย[70] วิธีการอื่นมีการใช้วิธีการมีส่วนร่วมของชุมชนและยุทธศาสตร์สุขศึกษาซึ่งเสริมสร้างความตระหนักมาลาเรียและความสำคัญของมาตรการควบคุมเพื่อลดอุบัติการณ์ของมาลาเรียในโลกกำลังพัฒนาบางพื้นที่อย่างได้ผล[71] การรับรู้โรคในระยะต้น ๆ สามารถหยุดไม่ให้โรคถึงตายได้ การศึกษายังสามารถแจ้งประชาชนให้ปิดบริเวณน้ำนิ่ง เช่น แทงก์น้ำ ซึ่งเป็นแหล่งผสมพันธุ์ชั้นดีสำหรับปรสิตและยุง ฉะนั้นจึงลดความเสี่ยงของการส่งผ่านระหว่างมนุษย์ได้ วิธีการนี้โดยทั่วไปใช้ในเขตเมืองซึ่งมีศูนย์ประชากรขนาดใหญ่ในพื้นที่จำกัดและมีแนวโน้มการส่งผ่านในพื้นที่เหล่านี้มาก[72] การบำบัดป้องกันมีเว้นระยะ (intermittent preventive therapy) เป็นอีกการช่วยเหลือหนึ่งที่ใช้เพื่อควบคุมมาลาเรียในสตรีมีครรภ์และทารก[73] และเด็กก่อนวัยเรียนซึ่งการส่งผ่านเป็นแบบตามฤดูกาลได้สำเร็จ[74] ยารักษาโรคมียาหลายชนิดที่สามารถช่วยป้องกันมาลาเรียขณะเดินทางไปยังถิ่นระบาดได้ ยาเหล่านี้ส่วนมากบางครั้งใช้ในการรักษาด้วย คลอโรควินอาจใช้ได้ในที่ซึ่งปรสิตยังไวต่อยา[75] เนื่องจาก Plasmodium ส่วนใหญ่ดื้อต่อยารักษาโรคตั้งแต่หนึ่งชนิดขึ้นไป จึงมักใช้ยาหนึ่งในสามชนิดนี้ เมโฟลควิน (ลาเรียม) ดอกซีไซคลีน หรือการรวมอะโตวาโควนและโพรกวานิลไฮโดรคลอไรด์ (มาลาโรน)[75] ผู้ป่วยสามารถทนฤทธิ์ยาดอกซีไซคลินและการรวมอะโตวาโควนและโพรกวานิลได้ดีที่สุด เมโฟลควินสัมพันธ์กับการเสียชีวิต การฆ่าตัวตาย และอาการทางประสาทวิทยาและจิตเวช[75] ผลคุ้มครองยังไม่เริ่มทันที และผู้ที่จะเดินทางไปยังพื้นที่ถิ่นระบาดของมาลาเรียปกติทานยาหนึ่งถึงสองสัปดาห์ก่อนเดินทางไปและยังทานต่อไปสี่ถึงหกสัปดาห์หลังเดินทางกลับ (ยกเว้นอะโตวาโควน/โพรกวานิล ซึ่งต้องเริ่มสองวันก่อนเดินทางและทานต่อเนื่องเป็นเวลาเจ็ดวันจากนั้น)[76] การใช้ยาคุ้มครองแทบไม่ได้ผลสำหรับผู้ที่อาศัยอยู่ในบริเวณที่มีมาลาเรียอยู่แล้ว และปกติใช้เฉพาะในผู้เดินทางและนักท่องเที่ยวระยะสั้นเท่านั้น ทั้งนี้ เนื่องจากราคายา ผลข้างเคียงจากการใช้ระยะยาว และความยากในการได้มาซึ่งยาต้านมาลาเรียในประเทศยากจน[77] การใช้ยาคุ้มครองในที่ซึ่งมียุงที่เป็นตัวนำโรคมาลาเรียอาจส่งเสริมให้มีการพัฒนาการดื้อยาบางส่วน (partial resistance)[78] การรักษามาลาเรียรักษาด้วยยารักษาโรคต้านมาลาเรีย ยาที่ใช้ขึ้นอยู่กับประเภทและความรุนแรงของโรค แม้ว่ามีการใช้ยาลดไข้ทั่วไป แต่ผลของยาต่อผลลัพธ์นั้นไม่ชัดเจน[79] มาลาเรียชนิดไม่มีอาการแทรกซ้อนอาจรักษาด้วยยารักษาโรคทางปาก การรักษาการติดเชื้อ P. falciparum ที่ได้ผลที่สุด คือ การใช้อาร์ตีมิซินินรวมกับยาต้านมาลาเรียอื่น (รู้จักกันในชื่อ การบำบัดรวมอาร์ตีมิซินิน [artemisinin-combination therapy หรือ ACT]) ซึ่งลดการดื้อยาต่อส่วนประกอบยาเดี่ยว ๆ[80] ยาต้านมาลาเรียเพิ่มเหล่านี้ได้แก่ เอโมไดอาควิน ลูมิแฟนทริน เมโฟลควินหรือซัลฟาดอกซิน/ไพริเมทามีน[81] การรวมอีกแบบหนึ่งที่แนะนำ คือ ไดไฮโดรอาร์ตีมิซินินและไพเพอราควิน[82][83] ACT ใช้รักษามาลาเรียชนิดไม่มีอาการแทรกซ้อนได้ผลราว 90%[61] องค์การอนามัยโลกแนะนำให้ใช้ควินินและคลินดามัยซินในการรักษามาลาเรียขณะตั้งครรภ์ช่วงแรก (ไตรมาสที่ 1) และ ACT ในช่วงหลัง (ไตรมาสที่ 2 และ 3)[84] เมื่อใช้รักษามาลาเรียระหว่างการต้งครรภ์ ในคริสต์ทศวรรษ 2000 มีมาลาเรียที่ดื้ออาร์ตีมิซินินบางส่วนเกิดขึ้นในเอเชียตะวันออกเฉียงใต้[85][86] การติดเชื้อ P. vivax, P. ovale หรือ P. malariae ปกติรักษาโดยไม่ต้องอยู่โรงพยาบาล การรักษา P. vivax ต้องมีทั้งการรักษาระยะเลือด (ด้วยคลอโรควินหรือ ACT) ตลอดจนการรักษาเชื้อในรูปตับด้วยไพรมาควิน[87] การรักษามาลาเรียชนิดรุนแรงที่แนะนำ คือ การใช้ยาต้านมาลาเรียในหลอดเลือดดำ สำหรับมาลาเรียชนิดรุนแรง อาร์ตีซูเนตให้ผลดีกว่าควินินทั้งในเด็กและผู้ใหญ่[88] การรักษามาลาเรียชนิดรุนแรงเกี่ยวข้องกับมาตรการประคับประคองซึ่งควรทำในหน่วยอภิบาล ซึ่งรวมการจัดการไข้สูงเกินและการชักซึ่งอาจเกิดจากมาลาเรีย นอกจากนี้ ยังรวมการเฝ้าดูอาการหายใจเร็วกว่าปกติ น้ำตาลในเลือดต่ำ และโพแทสเซียมในเลือดต่ำด้วย[24] การดื้อยาการดื้อยาเป็นปัญหาที่เพิ่มขึ้นของการรักษามาลาเรียในคริสต์ศตวรรษที่ 21 ปัจจุบัน การดื้อยาพบทั่วไปต่อยาต้านมาลาเรียทุกกลุ่ม ยกเว้นอาร์ตีมิซินิน[89] การรักษาสายพันธุ์ดื้อยาต้องอาศัยยากลุ่มนี้มากขึ้น ราคาของอาร์ตีมิซินินทำให้มีการใช้ในประเทศกำลังพัฒนาจำกัด[90] สายพันธุ์มาลาเรียที่พบตรงชายแดนกัมพูชา-ไทยดื้อต่อการบำบัดรวมซึ่งรวมอาร์ตีมิซินิน ฉะนั้นจึงอาจรักษาไม่ได้เลย[91] การสัมผัสประชากรปรสิตต่อการบำบัดด้วยอาร์ตีมิซินินอย่างเดียว (artemisinin monotherapy) ในขนาดต่ำกว่ารักษาโรคได้เกิน 30 ปีและการมีอาร์ตีมิซินินต่ำกว่ามาตรฐานมีแนวโน้มผลักดันการเลือกฟีโนไทป์ที่ดื้อยา[92] การดื้ออาร์ตีมิซินินพบแล้วในประเทศกัมพูชา พม่า ไทยและเวียดนาม[93] การพยากรณ์โรค
เมื่อรักษาอย่างเหมาะสม ผู้ป่วยมาลาเรียสามารถคาดหมายการฟื้นตัวอย่างสมบูรณ์[94] ทว่า มาลาเรียรุนแรงสามารถดำเนินอย่างรวดเร็วยิ่งและทำให้เสียชีวิตได้ในไม่กี่ชั่วโมงหรือวัน[95] ในผู้ป่วยมาลาเรียที่รุนแรงที่สุด อัตราป่วยตายอาจถึง 20% แม้ได้รับการอภิบาลและรักษาก็ตาม[5] ในระยะยาว มีบันทึกความบกพร่องทางการเจริญในเด็กที่ป่วยเป็นมาลาเรียรุนแรงหลายครั้ง[96] การติดเชื้อเรื้อรังโดยไม่เป็นโรครุนแรงสามารถเกิดได้ในกลุ่มอาการภูมิคุ้มกันบกพร่องซึ่งสัมพันธ์กับการตอบสนองที่ลดลงต่อแบคทีเรียซัลโมเนลลาและไวรัสเอ็ปไตน์–บาร์[97] ในวัยเด็ก มาลาเรียทำให้เกิดโลหิตจางระหว่างการเจริญของสมองที่รวดเร็ว และยังก่อความเสียหายโดยตรงต่อสมองอันเกิดจากมาลาเรียขึ้นสมอง[96] ผู้รอดชีวิตจากมาลาเรียขึ้นสมองบางส่วนมีความเสี่ยงต่อความบกพร่องทางประสาทวิทยาและการรู้ ความผิดปกติทางพฤติกรรมและโรคลมชักเพิ่มขึ้น[98] มาตรการป้องกันโรคมาลาเรียแสดงแล้วว่าช่วยพัฒนาการทำหน้าที่การรู้และผลการเรียนในการทดลองทางคลินิกเมื่อเทียบกับกลุ่มยาหลอก[96] ระบาดวิทยา ♦ การอุบัติของมาลาเรียดื้อคลอโรควินหรือหลายชนิดเพิ่มขึ้น ♦ การอุบัติของมาลาเรียดื้อคลอโรควิน ♦ ไม่มี Plasmodium falciparum หรือดื้อคลอโรควิน ♦ ไม่มีมาลาเรีย องค์การอนามัยโลกประเมินว่าในปี 2553 มีผู้ป่วยมาลาเรีย 219 ล้านคน มีผู้เสียชีวิต 660,000 คน[5][100] องค์การอื่นประเมินจำนวนผู้ป่วยไว้ระหว่าง 350 ถึง 550 ล้านคนสำหรับมาลาเรียชนิดฟัลซิปารัม[101] และมีผู้เสียชีวิต 1.24 ล้านคนในปี 2553 เพิ่มขึ้นจาก 1.0 ล้านคนในปี 2533[102] ผู้ป่วยส่วนใหญ่ (65%) เป็นเด็กอายุน้อยกว่า 15 ปี[103] สตรีมีครรภ์ราว 125 ล้านคนเสี่ยงต่อการติดเชื้อทุกปี ในแอฟริกาใต้สะฮารา มาลาเรียของมารดาสัมพันธ์กับการเสียชีวิตของทารกที่ประเมินถึง 200,000 คนต่อปี[20] มีผู้ป่วยมาลาเรียราว 10,000 คนต่อปีในยุโรปตะวันตก และ 1,300–1,500 คนต่อปีในสหรัฐอเมริกา[17] ราว 900 คนเสียชีวิตจากโรคในทวีปยุโรประหว่างปี 2536 ถึง 2546[56] ทั้งอุบัติการณ์ของโรคทั่วโลกและอัตราตายอันเกิดจากโรคลดลงในช่วงหลัง ตามข้อมูลองค์การอนามัยโลก การเสียชีวิตจากโรคมาลาเรียในปี 2553 ลดลงกว่าหนึ่งในสามจากปี 2543 ซึ่งประเมินไว้ 985,000 คน ส่วนใหญ่เนื่องจากการใช้มุ้งชุบยาฆ่าแมลงและการบำบัดผสมผสานยึดอาร์ตีมิซินิน[61] ในปี 2555 มีผู้ป่วยมาลาเรีย 207 ล้านคน ในปีนั้น ประมาณว่ามีผู้เสียชีวิตจากโรคระหว่าง 473,000 ถึง 789,000 คน ซึ่งจำนวนมากเป็นเด็กในทวีปแอฟริกา[2] ความพยายามลดโรคมาลาเรียในทวีปแอฟริกานับแต่เริ่มสหัสวรรษใหม่มีผลบางส่วน โดยอัตราโรคในทวีปแอฟริกาลดลงโดยประมาณ 40%[104] มาลาเรียปัจจุบันประจำถิ่นในแถบกว้างรอบเส้นศูนย์สูตร ในพื้นที่ทวีปอเมริกา หลายส่วนของทวีปเอเชีย และส่วนใหญ่ของทวีปแอฟริกา พบการเสียชีวิตจากมาลาเรีย 85–90% ในแอฟริกาใต้สะฮารา ประเมินปี 2552 รายงานว่าประเทศที่มีอัตราตายสูงสุดต่อประชากร 100,000 คน คือ ไอวอรีโคสต์ (86.15) แองโกลา (56.93) และบูร์กินาฟาโซ (50.66)[105] ประเมินปี 2553 ชี้ว่าประเทศที่มีการเสียชีวิตจากมาลาเรียมากที่สุดต่อประชากร คือ ประเทศบูร์กินาฟาโซ โมซัมบิกและมาลี[103] โครงการแอตลัสมาลาเรียมุ่งทำแผนที่ระดับประจำถิ่นทั่วโลกของมาลาเรีย โดยเป็นวิธีใช้ตัดสินการจำกัดตามพื้นที่ทั่วโลกของโรคและประเมินภาระโรค[106][107] ความพยายามนี้นำไปสู่การพิมพ์เผยแพร่แผนที่ภาวะประจำถิ่นของ P. falciparum ในปี 2553[108] ซึ่งราว 100 ประเทศมีมาลาเรียประจำถิ่น[100][109] ทุกปี นักเดินทางระหว่างประเทศ 125 ล้านคนเดินทางเข้าประเทศเหล่านี้ และกว่า 30,000 คนสัมผัสโรค[56] การกระจายทางภูมิศาสตร์ของมาลาเรียในภูมิภาคขนาดใหญ่มีความซับซ้อน และพื้นที่ที่มีมาลาเรียกับพื้นที่ปลอดมาลาเรียมักพบติดกัน[110] มาลาเรียชุกในเขตร้อนและกึ่งเขตร้อนเพราะปริมาณฝน อุณหภูมิสูงต่อเนื่องและความชื้นสูง ร่วมกับน้ำนิ่งซึ่งลูกน้ำพร้อมเจริญเป็นตัวเต็มวัย ทำให้พวกมันมีสิ่งแวดล้อมที่จำเป็นต่อการแพร่พันธุ์อย่างต่อเนื่อง[111] ในพื้นที่ที่แห้งแล้งกว่า การระบาดของมาลาเรียสามารถทำนายได้ค่อนข้างแม่นยำโดยการทำแผนที่ปริมาณฝน[112] มาลาเรียพบในเขตชนบทมากกว่าในเมือง ตัวอย่างเช่น หลายนครในอนุภูมิภาคลุ่มแม่น้ำโขงในเอเชียตะวันออกเฉียงใต้ปลอดมาลาเรียเป็นหลัก แต่โรคชุกในเขตชนบทหลายแห่ง รวมถึงตามเขตแดนระหว่างประเทศและชายป่า[113] ในทางตรงข้าม มาลาเรียในทวีปแอฟริกาพบทั้งในเขตชนบทและเมือง แม้ความเสี่ยงในเมืองใหญ่จะมีต่ำกว่า[114] ประวัติแม้ปรสิตซึ่งก่อโรคมาลาเรีย P. falciparum มีมา 50,000–100,000 ปีแล้ว แต่ขนาดประชากรของปรสิตนั้นไม่เพิ่มจนราว 10,000 ปีก่อน ซึ่งพร้อมกับความก้าวหน้าทางเกษตรกรรม[115] และการพัฒนานิคมมนุษย์ ยังพบเชื้อที่ใกล้ชิดกับปรสิตมาลาเรียมนุษย์ทั่วไปในชิมแพนซี หลักฐานบางอย่างแนะว่า มาลาเรีย P. falciparum อาจกำเนิดในกอริลลา[116] พบการอ้างถึงไข้ตามคาบอันเป็นเอกลักษณ์ของมาลาเรียตลอดประวัติศาสตร์ที่มีบันทึก เริ่มตั้งแต่ 2700 ปีก่อนคริสตกาลในจีน[117] มาลาเรียอาจมีส่วนต่อความเสื่อมลงของจักรวรรดิโรมัน[118] และมีการแพร่ระบาดในโรมมากเสียจนได้ชื่อว่า "ไข้โรมัน"[119] บางภูมิภาคในโรมโบราณถือว่าเสี่ยงต่อโรคเพราะมีสภาพเอื้ออำนวยต่อตัวนำโรคมาลาเรีย พื้นที่ดังกล่าว เช่น ประเทศอิตาลีตอนใต้ เกาะซาร์ดีเนีย หนองปอนตีเน ภูมิภาคต่ำของอิทรูเรียฝั่ง และนครโรมตามแม่น้ำไทเบอร์ ยุงชอบน้ำนิ่งในที่เหล่านี้สำหรับเป็นแหล่งเพาะพันธุ์ สวนชลประทาน ดินคล้ายบึง น้ำไหลผ่านจากการเกษตร และปัญหาการระบายน้ำจากการสร้างถนนทำให้มีน้ำนิ่งเพิ่มขึ้น[120]  คำว่า มาลาเรีย กำเนิดจากภาษาอิตาลีสมัยกลาง mala aria หมายถึง "อากาศเสีย" โรคนี้เดิมเรียก ไข้จับสั่น (ague) หรือไข้หนอง เนื่องจากสัมพันธ์กับบึงหนอง[121] มาลาเรียเคยพบมากในทวีปยุโรปและอเมริกาเหนือส่วนใหญ่[122] แต่ปัจจุบันไม่ใช่ถิ่นระบาดแล้ว[123] แม้ยังมีผู้ป่วยเข้าประเทศบ้าง[124] การศึกษาทางวิทยาศาสตร์ทำให้มีความก้าวหน้าสำคัญครั้งแรกใน พ.ศ. 2423 เมื่อแพทย์ทหารชาวฝรั่งเศสซึ่งทำงานในโรงพยาบาลทหารเมืองกงส์ต็องตีน ประเทศแอลจีเรีย ชื่อ ชาร์ล หลุยส์ อาลฟงส์ ลาฟว์ร็อง สังเกตปรสิตในเม็ดเลือดแดงของผู้ติดเชื้อมาลาเรียเป็นครั้งแรก จึงเสนอว่า มาลาเรียเกิดจากสิ่งมีชีวิตนี้ ครั้งแรกระบุว่าโพรทิสตาเป็นตัวก่อโรค[125] จากการค้นพบนี้และภายหลัง ทำให้เขาได้รับรางวัลโนเบลสาขาสรีรวิทยาหรือการแพทย์ใน พ.ศ. 2450 ปีต่อมา การ์โลส ฟินไลย์ แพทย์ชาวคิวบาที่รักษาผู้ป่วยไข้เหลืองในกรุงอาบานาพบหลักฐานแน่นหนาว่า ยุงส่งผ่านเชื้อไปและรับมาจากมนุษย์[126] งานนี้มีหลังการเสนอก่อนหน้าโดยโจไซอา ซี. นอตต์ (Josiah C. Nott)[127] และงานโดยเซอร์แพตทริก แมนซัน "บิดาเวชศาสตร์เขตร้อน" เรื่อง การแพร่เชื้อโรคเท้าช้าง[128] ในเดือนเมษายน พ.ศ. 2437 แพทย์ชาวสกอต เซอร์โรนัลด์ รอสเยี่ยมเซอร์แพตทริก แมนซันที่บ้านเขาบนถนนควีนแอนน์ กรุงลอนดอน การเยี่ยมครั้งนี้เป็นจุดเริ่มต้นของความร่วมมือและการวิจัยอย่างกระตือรือร้นสี่ปีซึ่งเสร็จสิ้นใน พ.ศ. 2441 เมื่อรอส ซึ่งขณะนั้นกำลังทำงานในโรงพยาบาลประธาน (Presidency General Hospital) ในโกลกาตา พิสูจน์วงจรชีวิตสมบูรณ์ของปรสิตมาลาเรียในยุง เขาจึงพิสูจน์ว่ายุงเป็นตัวนำโรคมาลาเรียในมนุษย์โดยการแสดงว่ายุงบางสปีชีส์แพร่เชื้อมาลาเรียสู่นก[129] เขาแยกปรสิตมาลาเรียจากต่อมน้ำลายของยุงที่ดูดเลือดจากนกที่ติดเชื้อ รอสได้รับรางวัลโนเบลสาขาแพทยศาสตร์ประจำ พ.ศ. 2445 สำหรับงานนี้ หลังลาออกจากราชการแพทย์อินเดีย รอสทำงานที่โรงเรียนเวชศาสตร์เขตร้อนลิเวอร์พูลและเป็นผู้นำความพยายามเพื่อควบคุมมาลาเรียในประเทศอียิปต์ ปานามา กรีซและมอริเชียส[130] ภายหลังคณะกรรมการแพทย์อันมีวัลเทอร์ รีดเป็นผู้นำยืนยันการค้นพบของฟินไลย์และรอสใน พ.ศ. 2443 วิลเลียม ซี. กอร์แกส (William C. Gorgas) นำการแนะนำของคณะกรรมการฯ ไปปฏิบัติในมาตรการสุขภาพที่ดำเนินระหว่างการก่อสร้างคลองปานามา งานสาธารณสุขนี้ช่วยชีวิตคนงานหลายพันคนและช่วยพัฒนาวิธีที่ใช้ในการรณรงค์สาธารณสุขต่อโรคในภายหน้า[131] การรักษามาลาเรียที่ได้ผลอย่างแรกมาจากเปลือกต้นซิงโคนา (cinchona) ซึ่งมีควินิน ต้นไม้นี้ขึ้นบนที่ลาดของเทือกเขาแอนดีส ในประเทศเปรูเป็นหลัก ชนพื้นเมืองของเปรูนำสารละลายแอลกอฮอล์ซิงโนามาควบคุมไข้ พบประสิทธิภาพต่อมาลาเรียและคณะเยสุอิตนำการรักษานี้มาทวีปยุโรปราว พ.ศ. 2183 ใน พ.ศ. 2220 ยานี้รวมอยู่ในตำรับยาลอนดอนเป็นการรักษาต้านมาลาเรีย[132] แต่ก็ล่วงถึง พ.ศ. 2363 จึงได้มีการแยกส่วนประกอบออกฤทธิ์ คือ ควินิน จากเปลือกไม้ แยกและตั้งชื่อโดยนักเคมีชาวฝรั่งเศส ปีแยร์ โฌแซ็ฟ เปลติเยร์ (Pierre Joseph Pelletier) และโฌแซ็ฟ บีย็องแอเม กาว็องตู (Joseph Bienaimé Caventou)[133][134]  ควินินกลายเป็นยารักษาโรคมาลาเรียสำคัญจนคริสต์ทศวรรษ 1920 เมื่อเริ่มมีการพัฒนายารักษาโรคอื่น ในคริสต์ทศวรรษ 1940 ใช้คลอโรควินแทนควินินในการรักษาทั้งมาลาเรียที่ไม่มีอาการแทรกซ้อนและมาลาเรียรุนแรงจนเกิดการดื้อตามมา เริ่มแรกในเอเชียตะวันออกเฉียงใต้และทวีปอเมริกาใต้ในคริสต์ทศวรรษ 1950 และทั่วโลกในคริสต์ทศวรรษ 1980[135] อาร์ติมิซินิน ซึ่งค้นพบโดยนักวิทยาศาสตร์ชาวจีน ทู โหยวโหยว (Tu Youyou) และเพื่อนร่วมงานในคริสต์ทศวรรษ 1970 จากพืช Artemisia annua กลายเป็นการรักษาที่แนะนำสำหรับมาลาเรีย P. falciparum โดยให้ร่วมกับยาต้านมาลาเรียอื่นตลอดจนในโรครุนแรง[136] มีการใช้ Plasmodium vivax ระหว่าง พ.ศ. 2460 ถึงคริสต์ทศวรรษ 1940 เพื่อการบำบัดมาลาเรีย เป็นการฉีดปรสิตมาลาเรียโดยเจตนาเพื่อชักนำให้เกิดไข้เพื่อต่อสู้กับโรคบางชนิด เช่น ซิฟิลิสตติยภูมิ ใน พ.ศ. 2461 ผู้คิดค้นเทคนิคนี้ ยูลีอุส วักแนร์-เยาเรกก์ (Julius Wagner-Jauregg) ไดรับรางวัลโนเบลสาขาสรีรวิทยาหรือแพทยศาสตร์สำหรับการค้นพบของเขา เทคนิคนี้อันตราย ฆ่าผู้ป่วยราว 15% จึงไม่ใช้อีกต่อไป[137] ยาฆ่าแมลงตัวแรกที่ใช้พ่นเคมีชนิดมีฤทธิตกค้าง คือ ดีดีที[138] แม้ทีแรกจะใช้เพื่อต่อสู้กับมาลาเรียโดยเฉพาะ แต่ได้แพร่ไปใช้ในเกษตรกรรมอย่างรวดเร็ว เมื่อเวลาผ่านไป การใช้ดีดีทีหลักกลายเป็นการควบคุมศัตรูพืชแทนการควบคุมโรค และการใช้ในการเกษตรขนานใหญ่นี้นำไปสู่วิวัฒนาการของยุงดื้อในหลายภูมิภาค การดื้อดีดีทีที่ยุงลายแสดงสามารถเทียบได้กับการดื้อยาปฏิชีวินะที่แบคทีเรียแสดง ระหว่างคริสต์ทศวรรษ 1960 ความตระหนักถึงผลลบของการใช้อย่างไม่เลือกเพิ่มขึ้น จนสุดท้ายนำไปสู่การห้ามใช้ดีดีทีในทางการเกษตรในหลายประเทศในคริสต์ทศวรรษ 1970[67] ก่อนหน้าดีดีที มาลาเรียถูกกำจัดหรือควบคุมได้สำเร็จในพื้นที่เขตร้อนอย่างประเทศบราซิลและอียิปต์โดยการขจัดหรือวางยาพิษแหล่งเพาะพันธุ์ยุงหรือที่อยู่ในน้ำของระยะลูกน้ำ ตัวอย่างเช่น การใช้สารประกอบสารหนูมีพิษสูง ปารีสกรีน กับสถานที่ซึ่งมีน้ำนิ่ง[139] วัคซีนมาลาเรียเป็นเป้าหมายการวิจัยมาแต่อดีต มีการดำเนินการศึกษาอันแรกที่มีความหวังซึ่งแสดงศักยะของวัคซีนมาลาเรียใน พ.ศ. 2510 โดยการก่อภูมิคุ้มกันหนูด้วยสปอโรซอยต์มีชีวิตที่ถูกทำให้อ่อนฤทธิ์ด้วยรังสี ซึ่งให้การคุ้มครองอย่างสำคัญแก่หนูเมื่อภายหลังฉีดด้วยสปอโรซอยต์อยู่รอดได้ปกติ นับแต่คริสต์ทศวรรษ 1970 มีความพยายามพอสมควรในการพัฒนายุทธศาสตร์การให้วัคซีนที่คล้ายกันในมนุษย์[140] สังคมและวัฒนธรรมผลกระทบทางเศรษฐกิจมาลาเรียมิได้เป็นเพียงโรคซึ่งสัมพันธ์โดยทั่วไปกับความยากจนเท่านั้น บางหลักฐานให้ข้อมูลว่า อาจเป็นสาเหตุของความยากจนและอุปสรรคสำคัญต่อการพัฒนาเศรษฐกิจ[7][8] แม้ภูมิภาคเขตร้อนจะได้รับผลมากที่สุด ต่ออิทธิพลไกลที่สุดของมาลาเรียไปถึงเขตอบอุ่นบางส่วนซึ่งมีการเปลี่ยนแปลงฤดูกาลสุดโต่ง โรคสัมพันธ์กับผลลบทางเศรษฐกิจสำคัญต่อภูมิภาคซึ่งแพร่หลายนั้น ระหว่างปลายคริสต์ศตรวรรษที่ 19 และต้นคริสต์ศตวรรษที่ 20 โรคเป็นปัจจัยสำคัญในการชะลอการพัฒนาเศรษฐกิจในรัฐทางใต้ของสหรัฐอเมริกา[141] การเปรียบเทียบจีดีพีเฉลี่ยต่อหัวใน พ.ศ. 2538 ปรับความเท่าเทียมกันของอำนาจซื้อ ระหว่างประเทศที่มีมาลาเรียกับประเทศที่ไม่มีมาลาเรียมีความแตกต่างห้าเท่า ($1,526 กับ $8,268) ในช่วง พ.ศ. 2508 ถึง 2533 ประเทศที่มีมาลาเรียทั่วไปมีจีดีพีเฉลี่ยต่อหัวเพิ่มขึ้นเพียง 0.4% ต่อปี เทียบกับ 2.4% ต่อปีในประเทศอื่น[142] ความยากจนสามารถเพิ่มความเสี่ยงของมาลาเรีย เพราะคนยากจนไม่มีสมรรถภาพทางการเงินเพื่อป้องกันหรือรักษาโรค โดยทั้งสิ้น มีการประมาณผลกระทบทางเศรษฐกิจของมาลาเรียต่อทวีปแอฟริกาเป็นมูลค่า 12,000 ล้านดอลลาร์สหรัฐต่อปี ผลกระทบทางเศรษฐกิจนี้รวมมูลค่าสาธารณสุข วันทำงานที่เสียไปเนื่องจากการเจ็บป่วย วันที่เสียไปในการศึกษา ผลิตภาพลดลงเนื่องจากสมองเสียหายจากมาลาเรียขึ้นสมอง และการเสียการลงทุนและการท่องเที่ยว[9] โรคมีภาระหนักในบางประเทศ ซึ่งคิดเป็น 30–50% ของการรับเข้ารักษาในโรงพยาบาล มากถึง 50% ของการเยี่ยมผู้ป่วยนอก และมากถึง 40% ของค่าใช้จ่ายสาธารณสุข[143] มาลาเรียขึ้นสมองเป็นสาเหตุอันดับต้น ๆ ของความพิการทางประสาทวิทยาในเด็กชาวแอฟริกา[98] การศึกษาเปรียบเทียบการทำหน้าที่การรู้ก่อนและหลังการบำบัดการเจ็บป่วยเป็นมาลาเรียรุนแรงต่อเนื่องแสดงให้เห็นผลการเรียนและความสามารถการรู้ที่พร่องอย่างสำคัญแม้หลังฟื้นตัวแล้ว[96] ผลคือ มาลาเรียรุนแรงและมาลาเรียขึ้นสมองมีผลลัพธ์ทางสังคม-เศรษฐกิจกว้างขวางเกินผลทันทีของโรค[144] ยาปลอมและยาไม่ได้มาตรฐานพบการปลอมอย่างแนบเนียนในหลายประเทศเอเชีย เช่น ประเทศกัมพูชา[145] จีน[146] อินโดนีเซีย ลาว ไทยและเวียดนาม และเป็นสาเหตุสำคัญของการเสียชีวิตที่เลี่ยงได้ในประเทศเหล่านี้[147] องค์การอนามัยโลกกล่าวว่า การศึกษาชี้ว่า 40% ของยารักษาโรคมาลาเรียที่มีอาร์ตีซูเนตเป็นยาปลอม โดยเฉพาะอย่างยิ่งในแถบลุ่มน้ำโขงและได้สถาปนาระบบเตือนภัยเร็วซึ่งจะรายงานสารสนเทศเกี่ยวกับยาปลอมอย่างรวดเร็วแก่เจ้าหน้าที่ที่เกี่ยวข้องในประเทศที่เข้าร่วม[148] ไม่มีวิถีน่าเชื่อถือแก่แพทย์หรือประชาชนในการตรวจจับยาปลอมโดยปราศจากห้องปฏิบัติการ บริษัทกำลังพยายามต่อสู้กับการมียาปลอมโดยการใช้เทคโนโลยีใหม่เพื่อให้ความปลอดภัยจากแหล่งถึงการจำหน่าย[149] อีกความกังวลทางคลินิกและสาธารณสุขหนึ่ง คือ การเพิ่มจำนวนยาต้านมาลาเรียไม่ได้มาตรฐานอันเกิดจากความเข้มข้นของส่วนประกอบไม่เหมาะสม ปนเปื้อนด้วยยาอื่นหรือเป็นพิษ ส่วนประกอบคุณภาพต่ำและหีบห่อไม่เพียงพอ[150] การศึกษาใน พ.ศ. 2555 แสดงว่า ยาต้านมาลาเรียราวหนึ่งในสามในเอเชียตะวันออกเฉียงใต้และแอฟริกาใต้สะฮาราไม่ผ่านการวิเคราะห์ทางเคมี หีบห่อหรือถูกพิสูจน์ว่าเป็นเท็จ[151] สงคราม ตลอดประวัติศาสตร์ การติดมาลาเรียมีบทบาทสำคัญต่อชะตาของผู้นำรัฐบาล รัฐชาติ บุคลากรทางทหารและการปฏิบัติทางทหาร[152] ในปี 2453 ผู้ได้รับรางวัลโนเบลสาขาการแพทย์ โรนัลด์ รอส (ซึ่งตัวเขาเองก็รอดชีวิตจากโรคมาลาเรีย) ตีพิมพ์หนังสือชื่อ การป้องกันมาลาเรีย ซึ่งรวมบทชื่อ "การป้องกันมาลาเรียในสงคราม" ผู้ประพันธ์บท พันเอก ซี. เอช. เมลวิล ศาสตราจารย์สุขศาสตร์แห่งราชวิทยาลัยแพทย์ทหารบกในกรุงลอนดอน กล่าวถึงบทบาทสำคัญของมาลาเรียระหว่างสงครามว่า "ประวัติศาสตร์มาลาเรียในสงครามอาจถือเป็นประวัติศาสตร์สงครามทีเดียว ประวัติศาสตร์สงครามในคริสต์ศักราชแน่นอน ... อาจเป็นไปได้กรณีที่ผู้ป่วยโรคที่เรียก ไข้ค่าย (camp fever) จำนวนมาก และอาจยังรวมโรคบิดค่ายสัดส่วนพอสมควร ในสงครามคริสต์ศตวรรษที่สิบหก สิบเจ็ดและสิบแปดกำเนิดจากมาลาเรีย"[153] มาลาเรียเคยเป็นภัยสุขภาพสำคัญที่สุดที่ทหารสหรัฐในแปซิฟิกใต้ประสบระหว่างสงครามโลกครั้งที่สอง ซึ่งทหารประมาณ 500,000 นายติดเชื้อ[154] โจเซฟ แพทริก เบิร์น (Joseph Patrick Byrne) ระบุว่า "ทหารหกหมื่นนายเสียชีวิตด้วยโรคมาลาเรียระหว่างการทัพแอฟริกาและแปซิฟิกใต้"[155] มีการลงทุนการเงินอย่างสำคัญเพื่อจัดหาสารต้านมาลาเรียที่มีอยู่และสร้างสารใหม่ ระหว่างสงครามโลกครั้งที่หนึ่งและสงครามโลกครั้งที่สอง อุปทานไม่ต่อเนื่องของเปลือกต้นซิงโคนาและควินินอันเป็นยาต้านมาลาเรียตามธรรมชาติทำให้มีการลงทุนเพื่อวิจัยและพัฒนายาและวัคซีนอื่น องค์การทหารอเมริกาลงมือริเริ่มวิจัยดังกล่าวซึ่งรวมศูนย์วิจัยการแพทย์ทหารเรือ สถาบันวิจัยทหารบกวัลเทอร์ รีดและสถาบันวิจัยโรคติดเชื้อการแพทย์กองทัพสหรัฐแห่งกองทัพสหรัฐ[156] นอกเหนือจากนี้ ยังมีการริเริ่มอย่างการควบคุมมาลาเรียในพื้นที่สงคราม (MCWA) ซึ่งก่อตั้งในปี 2485 และต่อมาคือ ศูนย์โรคติดต่อ (ปัจจุบันคือ ศูนย์ควบคุมและป้องกันโรคหรือ CDC) ซึ่งก่อตั้งในปี 2489 ข้อมูลของ CDC ว่า MCWA "ตั้งขึ้นเพื่อควบคุมมาลาเรียรอบฐานฝึกทหารในสหรัฐอเมริกาภาคใต้และดินแดนของสหรัฐ ซึ่งมาลาเรียยังเป็นปัญหา"[157] ความพยายามกำจัดมีความพยายามสำคัญหลายครั้งเพื่อกำจัดเชื้อมาลาเรียจากส่วนต่าง ๆ ของโลก หรือกำจัดมันทั่วโลก ในปี 2549 องค์การมาลาเรียโนมอร์ (Malaria No More) ตั้งเป้าสาธารณะกำจัดมาลาเรียจากทวีปแอฟริกาภายในปี 2558 และองค์การมีแผนยุบหากบรรลุเป้าหมายนั้น[158] มีวัคซีนมาลาเรียหลายชนิดกำลังอยู่ในการทดลองทางคลินิกซึ่งตั้งใจให้การคุ้มครองแก่เด็กในพื้นที่ระบาดและช่วยลดความเร็วของการส่งผ่านโรค จวบจนปี 2555 กองทุนต่อสู้เอดส์ วัณโรคและมาลาเรียโลก (Global Fund to Fight AIDS, Tuberculosis and Malaria) ได้แจกจ่ายมุ้งชุบยาฆ่าแมลง 230 ล้านผืนซึ่งตั้งใจหยุดการส่งผ่านมาลาเรียจากยุง[159] มูลนิธิคลินตันในสหรัฐอเมริกาทำงานเพื่อจัดการอุปทานและรักษาเสถียรภาพราคาในตลาดอาร์ตีมิซินิน[160] ความพยายามอื่นอย่างโครงการมาลาเรียแอตลาส (Malaria Atlas Project) มุ่งวิเคราะห์สารสนเทศภูมิอากาศและสภาพอากาศซึ่งจำเป็นต่อการทำนายการระบาดของมาลาเรียอย่างแม่นยำโดยอาศัยการมีถิ่นที่อยู่ของปรสิตที่นำมาลาเรีย[106] คณะกรรมการที่ปรึกษานโยบายมาลาเรียขององค์การอนามัยโลกก่อตั้งขึ้นในปี 2555 "เพื่อให้คำแนะนำทางยุทธศาสตร์และสิ่งเข้าเทคนิคแก่องค์การอนามัยโลกในทุกแง่มุมของการควบคุมและการกำจัดมาลาเรีย"[161] ในเดือนพฤศจิกายน 2556 องค์การอนามัยโลกและกลุ่มผู้จัดหาทุนวัคซีนมาลาเรียวางเป้าหมายพัฒนาวัคซีนซึ่งออกแบบเพื่อหยุดยั้งการส่งผ่านมาลาเรียโดยมีเป้าหมายระยะยาวเพื่อกำจัดมาลาเรีย[162] มาลาเรียถูกกำจัดหรือลดปริมาณลงมากสำเร็จในบางพื้นที่ มาลาเรียเคยพบทั่วไปในสหรัฐอเมริกาและทวีปยุโรปตอนใต้ แต่โครงการควบคุมตัวนำโรค ร่วมกับการเฝ้าสังเกตและรักษามนุษย์ที่ติดเชื้อ ได้กำจัดโรคจากภูมิภาคเหล่านี้ มีหลายปัจจัยส่งผล เช่น การระบายแหล่งเพาะพันธุ์ในพื้นที่ชุ่มน้ำเพื่อเกษตรกรรมและการเปลี่ยนแปลงอื่นในการปฏิบัติจัดการน้ำ และความก้าวหน้าของสุขาภิบาล ซึ่งรวมการใช้กระจกแก้วและบังตามากขึ้นในที่อยู่อาศัย[163] มาลาเรียถูกกำจัดจากส่วนใหญ่ของสหรัฐอเมริกาในต้นคริสต์ศตวรรษที่ 20 โดยวิธีการเหล่านี้ และการใช้ยาฆ่าแมลงดีดีที ตลอดจนวิธีอื่นกำจัดโรคนี้จากวงที่เหลืออยู่ทางใต้ในคริสต์ทศวรรษ 1950[164] ในประเทศซูรินาม มีการกวาดโรคนี้จากเมืองหลวงและพื้นที่ชายฝั่งผ่านแนวทางสามง่ามที่ริเริ่มโดยโครงการกำจัดมาลาเรียทั่วโลกในปี 2498 ซึ่งมีการควบคุมตัวนำโรคโดยการใช้ดีดีทีและไออาร์เอส การเก็บสเมียร์เลือดสม่ำเสมอจากประชากรเพื่อระบุผู้ป่วยมาลาเรียที่มีอยู่ และการให้เคมีบำบัดแก่ทุกคนที่ป่วย[165] ประเทศภูฏานกำลังใช้ยุทธศาสตร์กำจัดมาลาเรียแบบโหม และมีผู้ป่วยที่ยืนยันด้วยกล้องจุลทรรศน์ลดลง 98.7% ตั้งแต่ปี 2537 ถึง 2553 นอกเหนือจากเทคนิคควบคุมตัวนำโรคอย่างไออาร์เอสในพื้นที่ความเสี่ยงสูงและผ่านการกระจายมุ้งชุบยาฆ่าแมลงคงทนแล้ว ปัจจัยอื่นอย่างการพัฒนาเศรษฐกิจและการเพิ่มการเข้าถึงบริการสุขภาพช่วยให้ภูฏานประสบความสำเร็จในการลดอุบัติการณ์ของมาลาเรีย[166] การวิจัยความคิดริเริ่มวาระการวิจัยการกำจัดมาลาเรีย (malERA) เป็นกระบวนการให้คำปรึกษาเพื่อระบุว่าการวิจัยและพัฒนา (R&D) ในด้านใดที่ต้องพิจารณาสำหรับการกำจัดโรคมาลาเรียทั่วโลก[167][168] วัคซีนในปี 2549 คณะกรรมการที่ปรึกษาวัคซีนมาลาเรียขององค์การอนามัยโลกร่าง "แผนเทคโนโลยีวัคซีนมาลาเรีย" ซึ่งมีวัตถุประสงค์จุดหลักหนึ่งเพื่อ "พัฒนาและออกใบอนุญาตวัคซีนมาลาเรียรุ่นแรกซึ่งมีประสิทธิผลมากกว่า 50% ในการป้องกันอาการรุนแรงและการเสียชีวิต และคงอยู่นานกว่าหนึ่งปี" ภายในปี 2558[169] ต่อมาวัคซีนป้องกันโรคมาลาเรียที่มีชื่อว่า RTS,S/AS01 (RTS,S) ได้รับการอนุมัติจากหน่วยงานกำกับดูแลของยุโรปใน พ.ศ. 2558[170] โดยในปี 2562 อยู่ระหว่างการทดลองนำร่องใน 3 ประเทศแถบภูมิภาคแอฟริกาใต้สะฮารา ได้แก่ กานา เคนยา และมาลาวี ซึ่งเป็นส่วนหนึ่งของโครงการแผนดำเนินการวัคซีนมาลาเรีย (MVIP) ขององค์การอนามัยโลก[171] ภูมิคุ้มกันต่อมาลาเรีย P. falciparum เกิดเองตามธรรมชาติได้ แต่เฉพาะหลังการติดเชื้อซ้ำ ๆ หลายปี[172] บุคคลสามารถมีภูมิคุ้มกันต่อการติดเชื้อ P. falciparum หากถูกยุงที่นำปรสิตฉบับที่ถูกการฉายรังสีเอกซ์ขนาดหนึ่งทำให้ไม่ติดเชื้อกัดประมาณหนึ่งพันครั้ง[173] ปัจจุบันกำลังมีการพัฒนาวัคซีนหลายตัว[174] ธรรมชาติพหุสัณฐานอย่างสูงของโปรตีน P. falciparum หลายตัวส่งผลให้เป็นความท้าทายสำคัญในการออกแบบวัคซีน วัคซีนที่มีให้เลือกซึ่งมีเป้าหมายยังเซลล์สืบพันธุ์ ไซโกตและโอโอไคนีตในทางเดินอาหารส่วนกลางของยุงมุ่งหมายเพื่อหยุดการส่งผ่านมาลาเรีย วัคซีนหยุดการส่งผ่านเหนี่ยวนำแอนติบอดีในเลือดมนุษย์ เมื่อยุงดูดเลือดจากบุคคลที่มีภูมิคุ้มกัน แอนติบอดีเหล่านี้ป้องกันปรสิตไม่ให้พัฒนาการเจริญในยุง[175] วัคซีนตัวเลือกอื่น ซึ่งมุ่งเป้าระยะในกระแสเลือดของวงจรชีวิตของปรสิต มีประสิทธิภาพไม่เพียงพอ[176] ตัวอย่างเช่น มีการทดสอบ SPf66 ในพื้นที่ซึ่งพบโรคทั่วไปในคริสต์ทศวรรษ 1990 แต่การทดลองแสดงว่ามันให้ผลที่ไม่เพียงพอ[177] บริษัทเทคโนโลยีชีวภาพ ซานาเรีย กำลังพัฒนาวัคซีนทำให้อ่อนฤทธิ์ของระยะก่อนเม็ดเลือดแดงแตก PfSPZ ซึ่งใช้สปอโรซอยต์ทั้งตัวเพื่อชักนำการสนองของภูมิคุ้มกัน[178] ในปี 2564 นักวิจัยจากมหาวิทยาลัยออกซ์ฟอร์ดรายงานการค้นพบจากการทดลองวัคซีนป้องกันมาลาเรีย R21/Matrix-M ระยะที่ 2b ซึ่งในช่วง 12 เดือนของการติดตามผล แสดงว่ามีประสิทธิภาพถึง 77% วัคซีนนี้เป็นวัคซีนชนิดแรกที่บรรลุเป้าหมายแผนงานเทคโนโลยีวัคซีนมาลาเรียขององค์การอนามัยโลก ซึ่งวัคซีนต้องมีประสิทธิภาพอย่างน้อย 75%[179] ยารักษาโรคปรสิตมาลาเรียมีเอพิโคพลาสต์ (apicoplast) ซึ่งเป็นออร์แกเนลลส์ที่ปกติพบในพืช อยู่ในจีโนมของมัน เชื่อว่าเอพิโคพลาสต์เหล่านี้กำเนิดผ่านเอ็นโดซิมไบโอซิส (endosymbiosis) ของสาหร่ายและมีบทบาทสำคัญในเมแทบอลิซึมด้านต่าง ๆ ของตัวปรสิต เช่น ชีวสังเคราะห์กรดไขมัน พบว่าเอพิโคพลาสต์ผลิตโปรตีนกว่า 400 ชนิด และปัจจุบันกำลังสืบสวนว่าจะเป็นเป้าหมายที่เป็นไปได้สำหรับยาต้านมาลาเรียใหม่หรือไม่[180] เมื่อเริ่มมีปรสิตพลาสโมเดียมดื้อยา จึงกำลังมีการพัฒนายุทธศาสตร์ใหม่เพื่อต่อสู้กับโรคมาลาเรีย แนวทางหนึ่งอยู่ในการนำแอดดักต์ (adduct) กรดอะมิโนไพริดอกซาลสังเคราะห์ ซึ่งปรสิตจะรับเข้าไปจนสุดท้ายขัดขวางความสามารถในการสร้างวิตามินบีจำเป็นหลายชนิด[181][182] ยาต้านมาลาเรียที่ใช้คอมเพล็กซ์โลหะสังเคราะห์กำลังได้รับความสนใจในการวิจัย[183][184] (+)-SJ733: ส่วนหนึ่งของยาทดลองกลุ่มที่ใหญ่กว่า เรียก สไปโรอินโดโลน (spiroindolone) มันยับยั้งโปรตีน ATP4 ของเม็ดเลือดแดงที่ติดเชื้อซึ่งทำให้เซลล์เหี่ยวและกลายเป็นแข็งเหมือนเซลล์แก่ ซึ่งจะกระตุ้นให้ระบบภูมิคุ้มกันกำจัดเซลล์ที่ติดเชื้อออกจากระบบดังที่สาธิตในแบบจำลองหนู ในปี 2557 มีการวางแผนการทดลองทางคลินิกขั้น 1 เพื่อประเมินโพรไฟล์ความปลอดภัยในมนุษย์โดยสถาบันการแพทย์ฮาวาร์ด ฮิวส์ (Howard Hughes Medical Institute)[185], NITD246 และ NITD609 ก็อยู่ในกลุ่มสไปโรอินโดโลน และมีเป้าหมาย คือ โปรตีน ATP4[185] อื่น ๆยุทธศาสตร์การควบคุมตัวนำโรคที่ไม่ใช่สารเคมีเกี่ยวข้องกับการปรับพันธุกรรมของยุงมาลาเรีย ความก้าวหน้าในเทคโนโลยีพันธุวิศวกรรมทำให้การนำดีเอ็นเอจากสิ่งมีชีวิตอื่นเข้าไปในจีโนมของยุงเป็นไปได้ แล้วลดอายุขัยของยุง หรือทำให้ยุงดื้อต่อปรสิตมาลาเรียมากขึ้น เทคนิคยุงปลอดเชื้อเป็นวิธีการควบคุมพันธุกรรมซึ่งยุงเพศผู้ปลอดเชื้อจำนวนมากถูกเพาะเลี้ยงและปล่อย เมื่อผสมพันธุ์กับยุงเพศเมียจะลดประชากรในธรรมชาติในรุ่นหลัง การปล่อยซ้ำ ๆ สุดท้ายจะกำจัดประชากรเป้าหมายได้[60] จีโนมิกส์เป็นหัวใจของการวิจัยมาลาเรีย ด้วยการลำดับพันธุกรรมของ P. falciparum, Anopheles gambiae ยุงตัวนำโรคชนิดหนึ่ง และจีโนมมนุษย์ ทำให้สามารถศึกษาพันธุกรรมของสิ่งมีชีวิตทั้งสามในวงจรชีวิตของมาลาเรียได้[186] การนำเทคโนโลยีพันธุศาสตร์ใหม่ไปใช้อีกอย่างหนึ่ง คือ ความสามารถในการสร้างยุงที่ดัดแปรพันธุกรรมซึ่งไม่ส่งผ่านมาลาเรีย ซึ่งมีศักยภาพควบคุมทางชีววิทยาซึ่งการส่งผ่านมาลาเรียได้[187] สัตว์อื่นมีการระบุสปีชีส์ปรสิต Plasmodium เกือบ 200 ชนิดซึ่งติดเชื้อในนก สัตว์เลื้อยคลานและสัตว์เลี้ยงลูกด้วยนมอื่น[188] และเกือบ 30 ชนิดที่ติดเชื้อไพรเมตที่มิใช่มนุษย์ตามธรรมชาติ[189] ปรสิตมาลาเรียบางชนิดที่ติดเชื้อในไพรเมตที่มิใช่มนุษย์เป็นสิ่งมีชีวิตตัวแบบสำหรับปรสิตมาลาเรียของมนุษย์ เช่น P. coatneyi (เป็นแบบของ P. falciparum) และ P. cynomolgi (P. vivax) เทคนิคการวินิจฉัยที่ใช้ตรวจจับปรสิตในไพรเมตที่มิใช่มนุษย์คล้ายกันกับที่ใช้สำหรับมนุษย์[190] ปรสิตมาลาเรียที่ติดเชื้อในสัตว์ฟันแทะถูกใช้ในการวิจัยอย่างกว้างขวาง เช่น P. berghei[191] มาลาเรียในนกมีผลต่อชนิดในอันดับ Passeriformes เป็นหลัก และเป็นภัยคุกคามค่อนข้างใหญ่สำหรับนกในรัฐฮาวาย หมู่เกาะกาลาปาโกสและกลุ่มเกาะอื่น ทราบว่าปรสิต P. relictum มีบทบาทในการจำกัดการกระจายและความอุดมสมบูรณ์ของนกฮาวายประจำถิ่น คาดว่าปรากฏการณ์โลกร้อนเพิ่มความชุกและการกระจายทั่วโลกของมาลาเรียในนก เพราะอุณหภูมิที่สูงขึ้นทำให้ภาวะเหมาะสมสำหรับการสืบพันธุ์ของปรสิต[192] ดูเพิ่ม
อ้างอิง
แหล่งข้อมูลอื่นวิกิมีเดียคอมมอนส์มีสื่อที่เกี่ยวข้องกับ มาลาเรีย
|
||||||||||||||||||||||||||||||||||