|
วัคซีนโควิด-19
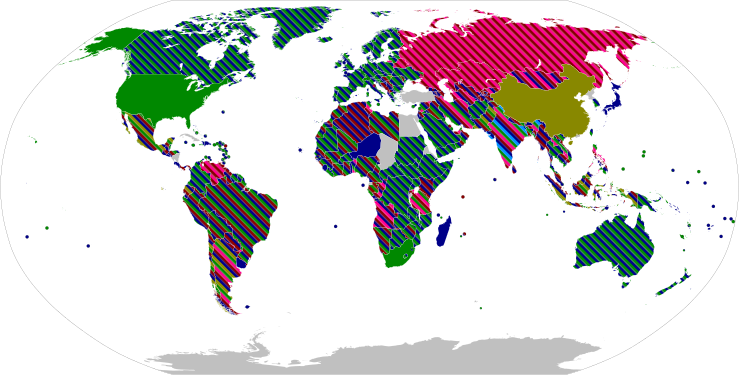
  แผนที่แสดงการอนุมัติให้ใช้วัคซีนโควิดในประเทศต่าง ๆ อนุญาตให้ใช้ทั่วไป กำลังให้วัคซีนเป็นจำนวนมาก อนุญาตให้ใช้เป็นการฉุกเฉิน (EUA) กำลังให้วัคซีนเป็นจำนวนมาก อนุญาตให้ใช้เป็นการฉุกเฉิน (EUA) มีแผนจะให้วัคซีนเป็นจำนวนมาก วัคซีนโรคติดเชื้อไวรัสโคโรนา 2019 เป็นวัคซีนที่มุ่งสร้างภูมิคุ้มกันต่อเชื้อไวรัสโคโรนาที่เป็นสาเหตุของโรคโควิด-19 โดยก่อนที่จะเกิดการระบาดทั่วของโควิด-19 ได้มีความพยายามในการพัฒนาวัคซีนสำหรับโรคไวรัสโคโรนาชนิดที่เป็นสาเหตุของโรคอื่น ๆ เช่น กลุ่มอาการทางเดินหายใจเฉียบพลันรุนแรง (ซาร์ส หรือ SARS) และโรคทางเดินหายใจตะวันออกกลาง (เมอร์ส หรือ MERS) มาอย่างต่อเนื่อง ความพยายามเหล่านี้ได้สะสมความรู้พอสมควรเกี่ยวกับโครงสร้างและการทำงานของไวรัสโคโรนา ซึ่งได้ช่วยให้การพัฒนาเทคโนโลยีวัคซีนโควิดต่าง ๆ ตั้งแต่ต้นปี 2020 ดำเนินไปได้อย่างรวดเร็ว[1] เริ่มตั้งแต่วันที่ 10 มกราคม 2020 ซึ่งมีการเผยแพร่ลำดับยีนผ่านจีเซด (GISAID) และ ณ วันที่ 19 มีนาคม อุตสาหกรรมยาทั่วโลกก็ได้ประกาศคำมั่นสัญญาที่จะทำการเพื่อจัดการโรค[2] วัคซีนโควิด-19ได้เครดิตโดยทั่วไปว่าช่วยลดการติดต่อ ความรุนแรง และอัตราการตายเนื่องกับโรค[3] ในการทดลองทางคลินิกระยะที่ 3 วัคซีนหลายชนิดสามารถป้องกันการติดเชื้อแบบแสดงอาการโดยมีประสิทธิศักย์สูงถึงร้อยละ 95 ณ เดือนกรกฎาคม 2021 มีวัคซีน 20 ชนิดที่ได้ขึ้นทะเบียนให้ใช้ในประเทศอย่างน้อย 1 ประเทศรวมทั้งวัคซีนอาร์เอ็นเอ 2 ชนิด (ไฟเซอร์และโมเดอร์นา), วัคซีนไวรัสโควิด-19 เชื้อตาย 9 ชนิด (BBIBP-CorV ของซิโนฟาร์ม, วัคซีนของ Chinese Academy of Medical Sciences, ซิโนแว็ก, โคแว็กซินของภารัตไบโอเทค, CoviVac ของ Chumakov Centre, COVIran Barakat ของ Shifa Pharmed Industrial Group, Minhai-Kangtai (KCONVAC)[A], QazVac ของ Research Institute for Biological Safety Problems และ WIBP-CorV ของซิโนฟาร์ม) วัคซีนที่ใช้ไวรัสเป็นเวกเตอร์ 5 ชนิด (สปุตนิกไลท์และสปุตนิกวีของสถาบันวิจัยกามาเลีย, แอสตร้าเซนเนก้า, Ad5-nCoV ของแคนซิโนไบโอลอจิกส์ และจอห์นสันแอนด์จอห์นสัน) และวัคซีนหน่วยย่อยโปรตีนของไวรัสโควิด-19 จำนวน 4 ชนิด (Abdala ของ Center for Genetic Engineering and Biotechnology, EpiVacCorona ของสถาบันเวกตอร์, Soberana 02 ของ Finlay Institute และ ZF2001 ของ Anhui Zhifei Longcom)[4][5] มีวัคซีนแคนดิเดตซึ่งได้เข้าสู่การวิจัยเพื่อใช้รักษาแล้ว 330 ชนิด ในจำนวนนี้ 30 ชนิดกำลังทดลองในระยะที่ 1, 30 ชนิดในระยะที่ 1-2, 25 ชนิดในระยะที่ 3 และ 8 ชนิดในระยะที่ 4[4] ประเทศต่าง ๆ มีแผนแจกจำหน่ายวัคซีนโดยจัดลำดับการให้ตามกลุ่มที่เสี่ยงเกิดภาวะแทรกซ้อน เช่น ผู้สูงอายุ และกลุ่มที่เสี่ยงติดแล้วแพร่โรค เช่น บุคลากรทางแพทย์[6] มีประเทศที่กำลังพิจารณาฉีดวัคซีนเพียงโดสเดียวในเบื้องต้นเพื่อขยายฉีดวัคซีนแก่ประชาชนให้มากที่สุดจนกว่าจะมีวัคซีนพอ[7][8][9][10] จนถึงวันที่ 22 สิงหาคม 2021 องค์กรสาธารณสุขรวม ๆ กันทั่วโลกรายงานว่า ได้ฉีดวัคซีนโควิด-19 ถึง 5,000 ล้านโดสแล้ว[11]
ผู้ผลิตวัคซีนได้ระบุจำนวนโดสวัคซีนที่จะสามารถผลิตในปี 2021 ไว้ดังนี้ ออกซฟอร์ด-แอสตร้าเซนเนก้า 3,000 ล้านโดส, ไฟเซอร์}-
สาระสำคัญและประวัติซาร์สและเมอร์สมีวัคซีนป้องกันโรคไวรัสโคโรนาในสัตว์หลายอย่าง รวมทั้งโรคหลอดลมอักเสบเหตุติดเชื้อไวรัส (infectious bronchitis virus) ในนก โรคไวรัสโคโรนาในสุนัข (canine coronavirus) และโรคไวรัสโคโรนาในแมว (feline coronavirus)[17] โครงการก่อน ๆ ที่พัฒนาวัคซีนสำหรับไวรัสในสกุล Coronaviridae ที่มนุษย์ติดเชื้อ มุ่งใช้สำหรับกลุ่มอาการทางเดินหายใจเฉียบพลันรุนแรง (ซาร์ส หรือ SARS) และโรคทางเดินหายใจตะวันออกกลาง (เมอร์ส หรือ MERS) โดยทั้งสองได้ทดสอบในสัตว์ทดลองแล้ว[18][19] ตามวรรณกรรมงานวิจัยที่ตีพิมพ์ในระหว่างปี 2005–2006 แม้รัฐบาลและองค์กรสาธารณสุขต่าง ๆ ทั่วโลกจะได้ให้ความสำคัญกับการหาและพัฒนาวัคซีนบวกยาใหม่ ๆ[20][21][22] แต่จนถึงปี 2020 ก็ยังไม่มีวัคซีนรักษาหรือป้องกันโรคซาร์สที่แสดงว่าปลอดภัยและมีประสิทธิผลในมนุษย์[23][24] โรคเมอร์สก็ยังไม่มีวัคซีนด้วย[25] เมื่อโรคเมอร์สกำลังระบาด เชื่อกันว่า งานวิจัยเกี่ยวกับโรคซาร์สที่ได้ทำแล้วอาจเป็นโครงแบบที่มีประโยชน์เพื่อพัฒนาวัคซีนและพัฒนาวิธีการรักษาโรค[23][26] จนถึงเดือนมีนาคม 2020 มีวัคซีนโรคเมอร์สชนิดหนึ่ง (อาศัยดีเอ็นเอ) ที่ได้ผ่านการทดลองทางคลินิกระยะที่ 1 กับมนุษย์แล้ว[27] และมีวัคซีนอีก 3 อย่างที่กำลังอยู่ในกระบวนการโดยทั้งหมดเป็นวัคซีนมีไวรัสเป็นเวกเตอร์, 2 อย่างมีอะดีโนไวรัส (ChAdOx1 nCoV-19, BVRS-GamVac) เป็นเวกเตอร์ และอีกอย่างมี modified vaccinia Ankara (MVA) เป็นเวกเตอร์[28] การพัฒนาวัคซีนโควิดในปี 2020ในอดีตยังไม่เคยมีวัคซีนป้องกันโรคติดเชื้อที่สามารถพัฒนาได้จนสำเร็จอย่างรวดเร็วภายในเวลาไม่กี่ปี และวัคซีนป้องกันไวรัสโคโรนาสำหรับใช้ในมนุษย์ก็ยังไม่เคยมีผลิตมาก่อน[29] หลังจากได้พบโรคปอดบวมเหตุไวรัสโคโรนาแบบใหม่เมื่อเดือนธันวาคม 2019[30] ก็ได้ตีพิมพ์ลำดับยีนของโควิด-19 เมื่อวันที่ 11 มกราคม 2020 ซึ่งจุดชนวนการตอบสนองฉุกเฉินในระดับนานาชาติเพื่อเตรียมรับโรคระบาดและเร่งพัฒนาวัคซีนป้องกันโรค[31][32][33] ในปลายเดือนกุมภาพันธ์ 2020 องค์การอนามัยโลกคาดว่า จะมีวัคซีนป้องกันไวรัสโคโรนาสายพันธุ์ใหม่ (SARS-CoV-2) ที่เป็นเหตุของโรคอย่างเร็วก็ใช้เวลา 18 เดือน[34] อัตราการติดเชื้อที่เพิ่มขึ้นอย่างรวดเร็วของโควิดทั่วโลกเมื่อต้นปี 2020 ได้กระตุ้นให้ก่อพันธมิตรระดับนานาชาติและกระตุ้นให้รัฐระดมทรัพยากรเพื่อพัฒนาวัคซีนหลายชนิดในระยะเวลาสั้น ๆ[35] จึงมีวัคซีนแคนดิเดต 4 อย่างที่เริ่มการทดลองในมนุษย์ในเดือนมีนาคม (ดูตารางการทดลองทางคลินิกที่เริ่มในปี 2020 ต่อไป)[31][36] องค์การอนามัยโลกประเมินค่าใช้จ่ายทั้งหมดถึง 8,000 ล้านดอลลาร์สหรัฐ (ประมาณ 250,000 ล้านบาท) เพื่อพัฒนาวัคซีนสามอย่างหรือมากกว่าที่มีเทคโนโลยีและการจัดจำหน่ายต่าง ๆ กันเพื่อระงับการระบาดของโควิดทั่วโลก[35] จนถึงเดือนเมษายน 2020 ก็มี "บริษัทและสถาบันเกือบ 80 แห่งใน 19 ประเทศ" ที่กำลังดำเนินการอันเสมือนกับสถานการณ์ตื่นทองนี้แล้ว[37] ในเดือนเมษายนเช่นกัน เซพี (CEPI) ได้ประเมินว่าอาจมีวัคซีนแคนดิเดตต้านโรคโควิดถึง 6 อย่าง ที่พันธมิตรนานาชาติควรเลือกพัฒนาให้ผ่านการทดลองทางคลินิกระยะที่ 2–3 และ 3 อย่างควรช่วยลดระเบียบราชการที่จุกจิกเกินไปให้ผ่านการตรวจสอบของรัฐและการตรวจสอบคุณภาพได้ โดยจะมีค่าใช้จ่ายอย่างน้อยถึง 2 พันล้านดอลลาร์สหรัฐ (ประมาณ 62,851 ล้านบาท)[38][36][29] ส่วนงานวิเคราะห์อีกงานหนึ่งประเมินว่า จะต้องพัฒนาวัคซีนแคนดิเดตในเบื้องต้นพร้อม ๆ กัน 10 อย่างก่อนจะเลือกเพียงไม่กี่อย่างเพื่อพัฒนาจนถึงให้อนุมัติได้[29] ในเดือนกรกฎาคม 2020 ศูนย์ความมั่นคงไซเบอร์แห่งชาติสหราชอาณาจักร บวกกับหน่วยงานความมั่นคงการสื่อสารต่าง ๆ ของแคนาดา สำนักงานความมั่นคงโครงสร้างพื้นฐานแห่งความมั่นคงไซเบอร์สหรัฐ (Cybersecurity Infrastructure Security Agency) และสำนักงานความมั่นคงแห่งชาติสหรัฐ ได้ร่วมกันกล่าวหาว่านักเลงคอมพิวเตอร์ที่ประเทศรัสเซียสนับสนุนได้พยายามขโมยงานวิจัยเกี่ยวกับการรักษาและวัคซีนโควิดจากสถาบันวิชาการและสถาบันยาในประเทศต่าง ๆ แต่รัสเซียก็ได้ปฏิเสธข้อกล่าวหานี้[39] การพัฒนาทั่วโลกในช่วงปี 2020 ความเปลี่ยนแปลงสำคัญของการพัฒนาวัคซีนโควิดจากต้นปีก็คือ การเพิ่มการร่วมมือกันระหว่างบริษัทยาข้ามชาติกับรัฐบาลของประเทศต่าง ๆ, รูปแบบบริษัทและจำนวนบริษัทเทคโนโลยีชีวภาพในประเทศต่าง ๆ ที่ได้เล็งความสนใจไปที่วัคซีนโควิด[38] ตามเซพี เมื่อจำแนกตามภูมิภาค องค์กรที่พัฒนาวัคซีนโควิดร้อยละ 40 อยู่ในทวีปอเมริกาเหนือเทียบกับร้อยละ 30 ในเอเชียและออสเตรเลียร้อยละ 26 ในยุโรป โดยมีโครงการจำนวนน้อยในอเมริกาใต้และแอฟริกา[38][31]
Access to COVID-19 Tools (ACT) Accelerator และโคแว็กซ์องค์กรนานาชาติรวมทั้งองค์การอนามัยโลก, เซพี (Coalition for Epidemic Preparedness Innovations, CEPI), กาวี, มูลนิธิบิลและเมลินดาเกตส์ และรัฐบาลต่าง ๆ ได้ก่อตั้งโครงการ "Access to COVID-19 Tools (ACT) Accelerator" เพื่อหาเงินทุน เร่งการวิจัยและพัฒนา การผลิต และการเข้าถึงอย่างยุติธรรมทั่วโลกสำหรับชุดตรวจโควิด วิธีการรักษา และการได้ใบอนุญาตเพื่อผลิตวัคซีน โดยมีโปรแกรมพัฒนาโดยเฉพาะที่เรียกว่า โคแว็กซ์ (COVAX Pillar)[40][41] โคแว็กซ์มุ่งอำนวยให้ได้ใบอนุญาตเพื่อผลิตวัคซีนโควิดหลายอย่าง มุ่งให้มีราคาที่ยุติธรรม มุ่งให้ได้วัคซีนถึง 2,000 ล้านโดสไม่เกินปลายปี 2021 เพื่อป้องกันบุคลากรทางแพทย์ผู้เป็นหน่วยหน้าและคนที่เสี่ยงมากที่สุด โดยเฉพาะสำหรับประเทศที่มีรายได้ต่ำจนถึงปานกลาง[42][43] (รวมทั้งประเทศไทย) จนถึงเดือนธันวาคม 2020 โครงการ ACT Accelerator รวม ๆ แล้วได้เงินทุนมา 2,400 ล้านดอลลาร์สหรัฐ (ประมาณ 75,000 ล้านบาท) มีวัคซีนแคนดิเดต 9 อย่างที่ได้เงินทุนจากโคแว็กซ์และเซพี จึงจัดเป็นกลุ่มที่มีวัคซีนโควิดมากที่สุด โดยมีประเทศ 189 ประเทศ ตกลงว่าจะร่วมแผนการผลิตจัดส่งวัคซีนในที่สุด[44][45] ในต้นปี 2020 องค์การอนามัยโลกได้ออกสื่อสัญญาณต่อเนื่องซึ่งได้สัญญาว่าจะได้เงิน 8,000 ล้านดอลลาร์สหรัฐ (ประมาณสองแสนแปดหมื่นล้านบาท) จากประเทศ 40 ประเทศเพื่อสนับสนุนการเร่งพัฒนาวัคซีน[46] ในเดือนกรกฎาคม องค์การประกาศว่าประเทศ 165 ประเทศ ซึ่งมีประชากรทั้งหมดร้อยละ 60 ของทั้งโลกได้ตกลงกับแผนการของโคแว็กซ์เพื่อให้แจกจำหน่ายวัคซีนที่ได้อย่างยุติธรรมและเท่าเทียมกัน ซึ่งรับประกันว่าประเทศที่เข้าร่วมแต่ละประเทศจะได้ส่วนแบ่งวัคซีนเพื่อให้แก่ประชากรที่เสี่ยงสุดร้อยละ 20 ของประเทศไม่เกินปลายปี 2021[47] ส่วนองค์กรการร่วมมืองานวิจัยโลกเพื่อความเตรียมพร้อมต่อโรคติดต่อ (Global Research Collaboration for Infectious Disease Preparedness) กำลังทำงานอย่างใกล้ชิดกับองค์การอนามัยโลกและประเทศสมาชิกเพื่อจัดลำดับความจำเป็นในการได้ทุนของงานวิจัยต่าง ๆ เพื่อประสานงานระหว่างองค์กรนานาชาติผู้ให้ทุนกับองค์กรที่ทำงานวิจัย เพื่ออัปเดตข้อมูลเกี่ยวกับความก้าวหน้าของวัคซีน และเพื่อหลีกเลี่ยงการให้ทุนซ้ำซ้อน[48][49] ส่วนสหพันธ์โรคทางเดินหายใจเฉียบพลันรุนแรงและการติดเชื้ออุบัติใหม่ (International Severe Acute Respiratory and Emerging Infection Consortium ตัวย่อ ISARIC) ก็กำลังจัดระเบียบและเผยแพร่ข้อมูลงานวิจัยเกี่ยวกับโควิดเพื่อให้เกิดผลต่อนโยบายสาธารณสุขของรัฐในเรื่องการแจกจำหน่ายวัคซีนที่จะได้[50] ในวันที่ 4 มิถุนายน มีงานประชุมสุดยอดเสมือนที่ประสานงานจากกรุงลอนดอน มีผู้แทนจากองค์กรของรัฐและเอกชนจากประเทศ 52 ประเทศ รวมทั้งประมุขแห่งรัฐ 35 ท่านจากประเทศกลุ่ม 7 และกลุ่ม 20 เพื่อระดมเงิน 8,800 ล้านดอลลาร์สหรัฐ (ประมาณสองแสนแปดหมื่นล้านบาท) เพื่อสนับสนุนให้กาวี (พันธมิตรโลกเพื่อวัคซีนและการให้ภูมิคุ้มกัน) เตรียมให้วัคซีนโควิดแก่เด็ก 300 ล้านคนในประเทศด้อยพัฒนาตลอดจนถึงปี 2025[51] ผู้บริจาครายใหญ่รวมทั้งมูลนิธิบิลและเมลินดาเกตส์ (1,600 ล้านดอลลาร์สหรัฐหรือประมาณห้าหมื่นล้านบาท)[52] และสหราชอาณาจักร (330 ล้านปอนด์สเตอร์ลิงต่อปีเป็นเวลา 5 ปีรวมเป็นเงินประมาณหกหมื่นหกพันล้านบาท)[51] ในเดือนธันวาคม มูลนิธิบิลและเมลินดาเกตส์บริจาคทรัพย์อีก 250 ล้านดอลลาร์สหรัฐ (ประมาณเจ็ดพันแปดร้อยล้านบาท) ให้แก่ ACT Accelerator เพื่อ "สนับสนุนการส่งชุดตรวจโควิด-19 การรักษา และวัคซีนใหม่ ๆ โดยเฉพาะแก่ประเทศมีรายได้ต่ำและปานกลาง" ในช่วงปี 2021 จึงรวมการบริจาคทรัพย์เกี่ยวกับโควิดของมูลนิธิเป็น 1,750 ล้านดอลลาร์สหรัฐ (ประมาณ 55,000 ล้านบาท)[53][54]
เซพีเซพี (Coalition for Epidemic Preparedness Innovations, CEPI) เป็นองค์กรนานาชาติที่จัดตั้งขึ้นในปี 2017 มุ่งทำงานร่วมกับเจ้าหน้าที่สาธารณสุขและผู้พัฒนาวัคซีนนานาชาติเพื่อพัฒนาวัคซีนป้องกันโรคระบาดต่าง ๆ[43] เซพีได้จัดตั้งกองทุน 2,000 ล้านดอลลาร์สหรัฐ (ประมาณ 64,600 ล้านบาท) โดยเป็นหุ้นส่วนทั่วโลกกับองค์กรของรัฐ เอกชน การกุศล กับประชาสังคมเพื่อเร่งวิจัยและทดลองวัคซีนแคนดิเดตสำหรับโควิด 9 อย่าง โดยมีเป้าหมายให้มีหลายอย่างพัฒนาจนได้อนุมัติภายในปี 2020–21[38][36][44] สหราชอาณาจักร แคนาดา เบลเยียม นอร์เวย์ สวิตเซอร์แลนด์ เยอรมนี และเนเธอร์แลนด์ได้บริจาคเงิน915 ล้านดอลลาร์สหรัฐ (ประมาณสองหมื่นเก้าพันล้านบาท) แก่เซพีแล้วในต้นเดือนพฤษภาคม[46][55] ส่วนมูลนิธิบิลและเมลินดาเกตส์ ซึ่งมีเป้าหมายในด้านการวิจัยและการแจกจำหน่ายวัคซีน ได้บริจาคเงิน 250 ล้านดอลลาร์สหรัฐ (ประมาณเจ็ดพันเก้าร้อยล้านบาท) ให้แก่องค์การเพื่องานวิจัยและการให้การศึกษาแก่สาธารณชนในเรื่องวัคซีนโควิด[56][57] ตลอดการระบาดทั่วปี 2020 เซพีได้ให้เงินทุนพัฒนาวัคซีนแคนดิเดต 9 อย่างโดยตั้งใจให้มีเทคโนโลยีวัคซีนหลายหลากต่าง ๆ กันเพื่อลดความเสี่ยงการล้มเหลวซึ่งปกติจะสูงเมื่อพัฒนาวัคซีน[44][58] จนถึงเดือนธันวาคม องค์กรและโปรแกรมการวิจัยที่ได้การสนับสนุนจากเซพีรวมแอสตร้าเซนเนก้า/มหาวิทยาลัยออกซฟอร์ด (AZD1222), Clover Biopharmaceuticals (SCB-2019), CureVac (Zorecimeran/CVnCoV), Inovio (INO-4800), สถาบันปาสเตอร์ (MV-SARS-CoV-2), โมเดอร์นา (mRNA-1273), Novavax (NVX-CoV2373), SK bioscience (GBP510), และมหาวิทยาลัยฮ่องกง[44][59][60] รัฐบาลของประเทศรัฐบาลของประเทศที่จัดงบประมาณเพื่อลงทุนในประเทศและต่างประเทศเกี่ยวกับงานวิจัยวัคซีน งานพัฒนา และการผลิตเริ่มต้นในปี 2020 รวมทั้งรัฐบาลกลางของแคนาดา ซึ่งประกาศทุน 275 ล้านดอลลาร์แคนาดา (ประมาณหกพันสี่ร้อยล้านบาท) สำหรับโครงการงานวิจัยวัคซีน 96 โครงการ ทั้งในบริษัทและในมหาวิทยาลัย โดยมีแผนจะสร้าง "ธนาคารวัคซีน" เพื่อฝากวัคซีนไว้หลายอย่างที่สามารถใช้ถ้าโรคระบาดอีก[61][62] ยังมีการลงทุนเพิ่มอีก 1,100 ล้านดอลลาร์แคนาดา (ประมาณสองหมื่นหกพันล้านบาท) เพื่อสนับสนุนการทดลองทางคลินิกในแคนาดาแล้วพัฒนาโซ่การผลิตและการแจกจำหน่ายสำหรับวัคซีน[49] วันที่ 4 พฤษภาคม รัฐบาลแคนาดาจัดงบประมาณ 850 ล้านดอลลาร์แคนาดา (ประมาณสองหมื่นล้านบาท) ให้แก่องค์การอนามัยโลกเนื่องกับการออกสื่อสัญญาณต่อเนื่องเพื่อระดมทุน 8,000 ล้านดอลลาร์สหรัฐให้วัคซีนโควิด[63]  ในประเทศจีน รัฐบาลได้ให้เงินกู้มีดอกเบี้ยต่ำแก่ผู้พัฒนาวัคซีนผ่านธนาคารกลาง และหาที่ดินให้เพื่อให้บริษัทสร้างโรงงานผลิตวัคซีน[55] จนถึงเดือนมิถุนายน 2020 วัคซีนแคนดิเดต 6 อย่างจาก 11 อย่างที่กำลังทดสอบเบื้องต้นในมนุษย์มาจากองค์กรของจีน[56] บริษัทวัคซีนและสถาบันวิจัย 3 แห่งได้เงินสนับสนุนจากรัฐบาลจีนเพื่อการวิจัย เพื่อการทดลองทางคลินิก และการผลิตวัคซีนซึ่งดีที่สุด โดยให้ความสำคัญกับการได้หลักฐานประสิทธิศักย์ของวัคซีนเร็ว ๆ ยิ่งกว่าความปลอดภัย[64] วันที่ 18 พฤษภาคม จีนได้สัญญาว่าจะให้เงิน 2 พันล้านดอลลาร์สหรัฐ (ประมาณหกหมื่นสามพันล้านบาท) เพื่อสนับสนุนงานขององค์การอนามัยโลกเพื่อกำจัดโควิด[65] วันที่ 22 กรกฎาคม จีนได้ประกาศว่าจะให้เงินกู้ 1 พันล้านดอลลาร์สหรัฐ (ประมาณ 32,000 ล้านบาท) เพื่อให้ประเทศต่าง ๆ ในลาตินอเมริกาและแคริบเบียนสามารถซื้อวัคซีนจากจีนได้[66] วันที่ 24 สิงหาคม นายกรัฐมนตรีจีนหลี่ เค่อเฉียงประกาศว่า จะแจกจำหน่ายวัคซีนของจีนให้แก่ประเทศเอเชียอาคเนย์ 5 ประเทศ คือกัมพูชา ลาว เมียนมาร์ ไทยและเวียดนาม ก่อนอื่นเมื่อได้วัคซีนแล้ว[67] ในบรรดาประเทศสหภาพยุโรป เมื่อเดือนพฤษภาคม ฝรั่งเศสประกาศการลงทุน 4.9 ล้านดอลลาร์สหรัฐ (ประมาณร้อยห้าสิบสี่ล้านบาท) ในสหพันธ์การวิจัยวัคซีนโควิดผ่านเซพี ที่องค์กรต่าง ๆ รวมทั้งสถาบันปาสเตอร์ (ฝรั่งเศส), Themis Bioscience (ออสเตรีย) และมหาวิทยาลัยพิตต์สเบิร์ก (สหรัฐ) จะมีบทบาท ซึ่งเพิ่มทุนการพัฒนาวัคซีนโควิดของ CEPI เป็น 480 ล้านดอลลาร์สหรัฐ (ประมาณหมื่นห้าพันล้านบาท) [68][69] ในเดือนมีนาคม คณะกรรมาธิการยุโรปได้ลงทุน 80 ล้านยูโร (ประมาณ 2,769 ล้านบาท) กับ CureVac ซึ่งเป็นบริษัทเทคโนโลยีชีวภาพของเยอรมนีเพื่อพัฒนาวัคซีนแบบเอ็มอาร์เอ็นเอ[70] ส่วนรัฐบาลเยอรมันเองก็ได้ลงทุนต่างหากกับบริษัทอีก 300 ล้านยูโร (ประมาณหมื่นสี่พันล้านบาท) ในเดือนมิถุนายน[71] เบลเยียม นอร์เวย์ สวิตเซอร์แลนด์ เยอรมนี และเนเธอร์แลนด์เป็นผู้บริจาครายสำคัญให้แก่ CEPI เพื่อวิจัยวัคซีนโควิดในยุโรป[55] ในเดือนเมษายน รัฐบาลสหราชอาณาจักรก่อตั้งคณะกรรมการวัคซีนโควิดเฉพาะกิจเพื่อเร่งพัฒนาวัคซีนผ่านการร่วมงานระหว่างอุตสาหกรรม มหาวิทยาลัย กับองค์กรต่าง ๆ ของรัฐตลอดขั้นตอนการพัฒนาวัคซีน รวมทั้งกำหนดโรงพยาบาลในประเทศเพื่อทำการทดลองทางคลินิก กฎการอนุมัติ และการผลิตในที่สุด[72] โครงการริเริ่มพัฒนาวัคซีนที่มหาวิทยาลัยออกซฟอร์ดและอิมพิเรียลคอลเลจลอนดอนได้รับงบประมาณ 44 ล้านปอนด์สเตอร์ลิง (ประมาณพันแปดร้อยล้านบาท) ในเดือนเมษายน[73][74] สำนักงานวิจัยและพัฒนาทางชีวเวชขั้นสูงสหรัฐ (Biomedical Advanced Research and Development Authority ตัวย่อ BARDA อ่านว่า บาร์ดา) เป็นองค์กรของรัฐบาลกลางสหรัฐที่ให้ทุนกับเทคโนโลยีรักษาโรค ได้ประกาศลงทุนเกือบ 1,000 ล้านดอลลาร์สหรัฐ (ประมาณสามหมื่นหนึ่งพันล้านบาท) เพื่อสนับสนุนการพัฒนาวัคซีนโควิด และเตรียมตัวผลิตวัคซีนแคนดิเดตที่มีหวังที่สุดในสหรัฐ วันที่ 16 เมษายน บาร์ดาลงทุน 483 ล้านดอลลาร์สหรัฐ (ประมาณหมื่นห้าพันล้านบาท) กับบริษัทโมเดอร์นา (Moderna) และหุ้นส่วนคือจอห์นสันแอนด์จอห์นสัน[55][75] บาร์ดายังมีงบประมาณอีก4,000 ล้านดอลลาร์สหรัฐ (ประมาณแสนสามหมื่นล้านบาท) สำหรับพัฒนาวัคซีน ดังนั้น จึงอาจลงทุนพัฒนาวัคซีนแคนดิเดตได้ถึง 6–8 อย่างที่จะทดลองทางคลินิกในปี 2020–2021 โดยบริษัทต่าง ๆ เช่น Sanofi Pasteur (ฝรั่งเศส) และ Regeneron (สหรัฐ)[75][76] ในวันที่ 15 พฤษภาคม รัฐบาลกลางสหรัฐได้ประกาศให้งบประมาณกับโปรแกรมเร่งด่วนคือ Operation Warp Speed (แปลได้ว่า ปฏิบัติการความเร็วเหนือแสง) โดยมุ่งให้เริ่มทดลองวัคซีนแคนดิเดตทางคลินิกในช่วงฤดูใบไม้ร่วงปี 2020 แล้วผลิตวัคซีนที่ได้อนุมัติ 300 ล้านโดสให้ได้ในเดือนมกราคม 2021 ผู้นำโปรแกรมนี้เป็นนายพลทหารบกสหรัฐ ในเดือนมิถุนายน ผู้นำโปรแกรมแจ้งว่า จะทำงานร่วมกับบริษัท 7 บริษัทที่กำลังพัฒนาวัคซีนแคนดิเดตสำหรับโควิด คือ โมเดอร์นา จอห์นสันแอนด์จอห์นสัน เมอร์ค ไฟเซอร์ และมหาวิทยาลัยออกซฟอร์ดที่ร่วมมือกับบริษัทแอสตร้าเซนเนก้า บวกกับบริษัทอีกสองบริษัท[77] แม้บริษัทไฟเซอร์ภายหลังจะระบุว่า "บริษัทไม่ได้ยอมรับเงินทุน (จากรัฐ)... การลงทุนเพื่อวิจัยและพัฒนาของไฟเซอร์ทั้งหมดเป็นการเสี่ยง"[78] การทดลองขององค์การอนามัยโลกในเดือนเมษายน 2020 องค์การอนามัยโลกได้ตีพิมพ์แผนการวิจัยและพัฒนาไวรัสโคโรนาใหม่ ซึ่งเตรียมแผน "การวิจัยทางคลินิกขนาดใหญ่ ทำในระดับนานาชาติ มีศูนย์หลายศูนย์ ทำแบบสุ่ม มีกลุ่มควบคุม" เพื่อให้สามารถ "ประเมินประโยชน์และความเสี่ยงของวัคซีนแคนดิเดตแต่ละอย่างพร้อม ๆ กันภายใน 3–6 เดือนที่มีให้ใช้ทดลอง" แผนการนี้มี "โพรไฟล์ผลิตภัณฑ์เป้าหมาย" (Global Target Product Profile ตัวย่อ TPP) ซึ่งจำแนกคุณสมบัติของวัคซีนที่ปลอดภัยและมีประสิทธิผลไว้เป็น 2 หมวด คือ "วัคซีนเพื่อการป้องกันในระยะยาวสำหรับบุคคลที่เสี่ยงโควิดสูงกว่า เช่น บุคลากรทางการแพทย์" และวัคซีนอื่น ๆ ที่ให้ภูมิคุ้มกันอย่างรวดเร็วเมื่อเกิดการระบาดใหม่[35] องค์การยังได้จัดตั้งทีมนานาชาติ คือ ทีพีพี (TPP) ขึ้นเพื่อ
ทีมนานาชาตินี้จะจัดลำดับความสำคัญว่า วัคซีนใดควรเข้าสู่การทดลองทางคลินิกระยะที่ 2 และ 3 และระบุโพรโทคอล/เกณฑ์วิธีของการทดลองระยะ 3 แบบเข้ากันได้สำหรับวัคซีนทั้งหมดที่เข้าสู่ระยะก่อนได้รับอนุมัตินี้[35] แบบทดลองที่ปรับได้สำหรับการทดลองซอลิแดริตีแบบทดลองทางคลินิกที่กำลังทำอยู่อาจปรับได้โดยเรียกว่าเป็น "adaptive design" (แบบปรับได้) ถ้าข้อมูลที่ได้ในการทดลองให้ความชัดเจนตั้งแต่เนิ่น ๆ เกี่ยวกับประสิทธิผลของวัคซีน ไม่ว่าจะบวกหรือลบ[81][82] ดังนั้น การทดลองร่วม (Solidarity trial) ขององค์การอนามัยโลกสำหรับวัคซีนหลายอย่างที่ทดลองทางคลินิกในปี 2020 จะใช้วิธีเช่นนี้เพื่อให้สามารถเปลี่ยนพารามิเตอร์ของการทดลองได้อย่างรวดเร็วในศูนย์ทดลองทุกแห่งเมื่อผลปรากฏ[80] วัคซีนแคนดิเดตใหม่ที่เข้าเกณฑ์ยังอาจเพิ่มเข้าในโปรแกรมการทดลองร่วม และวัคซีนแคนดิเดตที่ปรากฏโดยหลักฐานว่าปลอดภัยหรือมีประสิทธิศักย์ไม่ดีเทียบกับยาหลอกและวัคซีนอื่น ๆ ก็จะยกเลิกทดลองในโปรแกรมนี้[80] แบบปรับได้ที่ใช้ในการทดลองวัคซีนแคนดิเดตทางคลินิกระยะที่ 2–3 อาจทำให้ระยะการทดลองสั้นลงโดยมีอาสาสมัครผู้รับวัคซีนน้อยกว่า ช่วยเร่งการตัดสินใจไม่ว่าจะหยุดการทดลองตั้งแต่ต้น ๆ หรือตัดสินใจว่ามีผล หลีกเลี่ยงทำการวิจัยซ้ำ ๆ และเพิ่มการประสานงานเพื่อเปลี่ยนแบบการทดลองที่ทำร่วมในศูนย์ประเทศต่าง ๆ[80][81] หุ้นส่วน การแข่งขัน และการแจกจำหน่ายบริษัทยายักษ์ใหญ่ที่มีประสบการณ์ผลิตวัคซีนเป็นจำนวนมาก ๆ รวมทั้งจอห์นสันแอนด์จอห์นสัน แอสตร้าเซนเนก้า และแกล็กโซสมิธไคลน์ กำลังสร้างพันธมิตรกับบริษัทเทคโนโลยีชีวภาพ รัฐบาลของประเทศต่าง ๆ และมหาวิทยาลัยเพื่อเร่งการพัฒนาวัคซีนที่มีประสิทธิภาพ[56][55] เพื่อรวมสมรรถภาพทางการเงินและการผลิตเพื่อสร้างเทคโนโลยีวัคซีนโรคระบาดทั่วแบบใช้ตัวเสริม (adjuvant) แกล็กโซสมิธไคลน์จึงได้จับมือกับซาโนฟี่ ซึ่งเป็นหุ้นส่วนแบบที่ไม่ค่อยทำกันระหว่างบริษัทยักษ์ใหญ่นานาชาติเพื่อเร่งพัฒนาวัคซีน[83] เมื่อโควิด-19 กำลังระบาดไปทั่วอย่างรวดเร็วในปี 2020 องค์การนานาชาติเช่นองค์การอนามัยโลกและเซพี ผู้พัฒนาวัคซีน รัฐบาล และอุตสาหกรรมก็ได้ประเมินการแจกจำหน่ายวัคซีนที่จะได้[35] ประเทศผลิตวัคซีนแต่ละประเทศอาจถูกโน้มน้าวให้ขายวัคซีนในราคาสูงสุด หรือใช้วัคซีนในประเทศของตนก่อน[32][29][55] ผู้เชี่ยวชาญเน้นว่า วัคซีนที่จะอนุมัติควรมีราคาที่พอซื้อได้และมีให้สำหรับบุคคลหน่วยหน้าในการรักษาพยาบาลและคนที่จำเป็นมากสุด[32][29][55] ในเดือนเมษายน เดอะเดลีเทลิกราฟ (ลอนดอน) รายงานว่า สหราชอาณาจักรได้ตกลงทำการร่วมกับประเทศและองค์กรนานาชาติอื่น ๆ รวมทั้งประเทศฝรั่งเศส เยอรมนี และอิตาลีเพื่อค้นหาวัคซีนและแชร์ผลที่ได้ และตกลงว่า ประชาชนอังกฤษจะไม่ได้รับสิทธิพิเศษเพื่อได้วัคซีนโควิดที่มหาวิทยาลัยอังกฤษซึ่งได้รับเงินภาษีของประชาชนเป็นผู้พัฒนาขึ้น[73] บริษัทหลายแห่งมีแผนผลิตวัคซีนเพื่อเริ่มต้นขายในราคาถูก แล้วเพิ่มราคาเพื่อให้ได้กำไรภายหลังถ้าต้องฉีดวัคซีนทุกปีและเมื่อประเทศต่าง ๆ ตุนวัคซีนเผื่ออนาคต[55] องค์การอนามัยโลกและเซพีกำลังสร้างทรัพยากรทางการเงินและแนวปฏิบัติเพื่อส่งวัคซีนที่มีประสิทธิผล 3 อย่างหรือยิ่งกว่าไปทั่วโลก โดยสำนึกว่าประเทศต่าง ๆ และประชากรกลุ่มต่าง ๆ ย่อมจำเป็นต่างกัน[31][35][36][80] ยกตัวอย่างเช่น วัคซีนที่มีประสิทธิผลน่าจะจัดก่อนอื่นให้แก่บุคลากรทางแพทย์และกลุ่มประชากรที่เสี่ยงป่วยหนักและเสี่ยงตายมากสุดจากการติดโรค เช่น คนชราหรือคนจนที่อยู่ในชุมชนแออัด[84][85] ทั้งองค์การอนามัยโลก เซพี และกาวีต่างก็ได้แสดงความเป็นห่วงว่า ประเทศร่ำรวยไม่ควรได้วัคซีนโควิดก่อนประเทศอื่น ๆ แต่ควรพิจารณาความจำเป็นในหมู่ประชากรและความจำเป็นเพื่อลดปัญหาทางเศรษฐกิจ[31][36][84] กำหนดเวลาต่าง ๆ ที่ต้องย่อลงประเด็นต่าง ๆ ทางภูมิรัฐศาสตร์ ปัญหาของกลุ่มประชากรที่อ่อนแอ และปัญหาการผลิตวัคซีนเป็นพัน ๆ ล้านโดสล้วนอาจกดดันให้ย่อกำหนดเวลาต่าง ๆ ในการพัฒนาวัคซีนและในบางกรณี อาจรวมระยะการทดลองทางคลินิกหลายระยะเข้าด้วยกันแล้วทำพร้อม ๆ กันโดยใช้เวลาแค่เดือน ๆ ซึ่งปกติต้องทำเป็นลำดับต่อ ๆ กันเป็นปี ๆ[56] ยกตัวอย่างเช่น ผู้พัฒนาวัคซีนประเทศจีนและศูนย์ควบคุมและป้องกันโรคจีน (Chinese Center for Disease Control and Prevention) ได้เริ่มงานพัฒนาวัคซีนในเดือนมกราคม 2020[86] แต่เพียงแค่ถึงเดือนมีนาคม ก็กำลังตรวจดูวัคซีนแคนดิเดตเป็นจำนวนมากโดยใช้กำหนดเวลาที่ย่อลง และมีจุดประสงค์เพื่อแสดงความแข็งแกร่งของเทคโนโลยีจีนเหนือของสหรัฐ และเพื่อให้ชาวจีนมั่นใจถึงคุณภาพวัคซีนที่ผลิตในจีน[56][87] เพื่อเร่งพัฒนาวัคซีนในกำหนดเวลาย่อ ๆ สำหรับโรคระบาดทั่ว ทั้งผู้พัฒนาวัคซีนและรัฐบาลได้ยอมรับความเสี่ยงเมื่อลัดวงจรพัฒนาวัคซีนปกติ[55] ผู้บริหารของอุตสาหกรรมคนหนึ่งถึงกับกล่าวว่า "วิกฤติการณ์ของโลกใหญ่จนกระทั่งเราแต่ละคนจะต้องยอมเสี่ยงที่สุดเดี๋ยวนี้เพื่อยุติโรคนี้"[55] มีเรื่องที่ต้องพิจารณาหลายเรื่องรวมทั้งระดับความเป็นพิษที่ยอมรับได้ (คือความปลอดภัย) การตั้งเป้าที่กลุ่มประชากรที่อ่อนแอ ความก้าวหน้าอย่างมากของประสิทธิศักย์วัคซีนที่ต้องมี ระยะการป้องกันของวัคซีน ระบบการส่งยาพิเศษ (เช่น ให้ทางปากหรือทางจมูก แทนที่จะฉีด) ขนาดการให้ยา ความเสถียรของวัคซีนและวิธีการเก็บในคลัง การอนุมัติให้ใช้เป็นการฉุกเฉินก่อนได้รับอนุมัติทั่วไป วิธีการผลิตดีที่สุดเพื่อให้ได้วัคซีนเป็นพัน ๆ ล้านโดส และการแจกจำหน่ายวัคซีนที่ได้อนุมัติ[29][88] ถ้านับเริ่มจากการทดลองทางคลินิกระยะที่ 1 วัคซีนถึงร้อยละ 84–90 ล้มเหลวในช่วงพัฒนาการแล้วไม่ได้รับอนุมัติให้วางตลาดขาย[31][89] ถ้าเริ่มจากการทดลองทางคลินิกระยะที่ 3 วัคซีนร้อยละ 25.7 ล้มเหลวและไม่ได้รับอนุมัติโดยที่สุด[89] ผู้ผลิตวัคซีนอาจจะลงทุนไปแล้วเกิน 1,000 ล้านดอลลาร์สหรัฐ (ประมาณสามหมื่นหนึ่งพันล้านบาท) โดยได้ผลิตวัคซีนเป็นล้าน ๆ โดสไปแล้วที่ใช้ไม่ได้[29][56][55] ในกรณีของโควิด-19 โดยเฉพาะ ประสิทธิศักย์ของวัคซีนที่อัตราร้อยละ 70 อาจพอระงับการระบาดทั่ว เพราะถ้ามีประสิทธิศักย์เพียงร้อยละ 60 การระบาดก็ยังอาจต่อไปได้ และประสิทธิศักย์ที่น้อยกว่าร้อยละ 60 จะไม่ก่อภูมิคุ้มกันหมู่พอระงับการกระจายเชื้อโดยตนเอง[29] โรคที่ระบาดทั่วในปี 2020 ได้สร้างปัญหากับสถาบันวิจัยเพราะการเว้นระยะห่างทางสังคมและการปิดห้องปฏิบัติการ[90][91] อุปกรณ์เครื่องใช้ที่จำเป็นอย่างยิ่งสำหรับการวิจัยและพัฒนาวัคซีนก็ขาดแคลนขึ้นเรื่อย ๆ เนื่องจากการซื้อแข่งขันกันในระดับนานาชาติหรือการเข้ายึดของรัฐ[64] กำหนดเวลาต่าง ๆ สำหรับการทดลองทางคลินิก ซึ่งปกติเป็นกระบวนการที่ทำเป็นลำดับต่อ ๆ กันโดยใช้เวลาเป็นปี ๆ ก็กำลังย่อเป็นการทดลองตรวจความปลอดภัย ประสิทธิศักย์ และหาขนาดยาที่ทำพร้อม ๆ กันโดยใช้เวลาเป็นแค่เดือน ๆ ซึ่งอาจมีผลต่อความปลอดภัย[56][55]
แพลตฟอร์มเทคโนโลยีในเดือนกันยายน 2020 นักวิทยาศาสตร์ของเซพีรายงานว่า มีแพลตฟอร์เทคโนโลยี 9 แพลตฟอร์มที่กำลังวิจัยและพัฒนาในช่วงปี 2020 เพื่อสร้างวัคซีนต้านโควิด-19 โดยยังมีวัคซีนแคนดิเดตเป็นจำนวนมากที่ไม่ระบุแพลต์ฟอร์มเทคโนโลยี[38] แพลตฟอร์มโดยมากสำหรับวัคซีนที่อยู่ในช่วงทดลองทางคลินิกจนถึงเดือนกันยายนได้เล็งโปรตีน spike ของไวรัสและรูปแบบต่าง ๆ ของโปรตีนนี้เพื่อใช้เป็นแอนติเจนหลักในการสร้างภูมิคุ้มกันโรค[38] แพลตฟอร์มที่กำลังพัฒนาในปี 2020 รวมเทคโนโลยีกรดนิวคลีอิก (คือ เอ็มอาร์เอ็นเอที่ดัดแปลงนิวคลีโอไซด์ (modRNA) หรือดีเอ็นเอ), เวกเตอร์ไวรัสที่ไม่ขยายพันธุ์, เพปไทด์, โปรตีนจากยีนลูกผสม, ไวรัสโควิดลดฤทธิ์ที่ยังเป็น และไวรัสโควิดเชื้อตาย[92][38][29][31] เทคโนโลยีวัคซีนที่กำลังพัฒนาเพื่อโควิดหลายอย่างไม่เหมือนกับวัคซีนป้องกันไข้หวัดใหญ่ที่ใช้กันอยู่แล้ว แต่จัดเป็นของใหม่ที่ทำงานเฉพาะเจาะจงกับกลไกการแพร่เชื้อของโควิด[31][92][38][31] เทคโนโลยีที่ใช้ยังอาจเพิ่มความยืดหยุ่นในการจัดการแอนติเจน และบางอย่างอาจมีประสิทธิผลดีกว่าในกลุ่มประชากรย่อยต่าง ๆ รวมทั้งคนชรา เด็ก หญิงมีครรภ์ และคนไข้ที่ภูมิต้านทานอ่อนแอ[38][31]  
วัคซีนจนถึงวันที่ 21 ธันวาคม ประเทศ 17 ประเทศ[B] และสหภาพยุโรป[110] ได้อนุมัติให้ใช้วัคซีนของบริษัทไฟเซอร์-ไบออนเทคคือ tozinameran เป็นการฉุกเฉิน บาห์เรนยังอนุมัติให้วางตลาดขายฉุกเฉินสำหรับวัคซีน BBIBP-CorV ของบริษัทซิโนฟาร์ม[94] โดยสหรัฐอาหรับเอมิเรตส์ต่อมาก็ได้ทำเช่นกัน[95] ในสหราชอาณาจักรจนถึงวันที่ 16 ธันวาคม คน 138,000 คนได้รับ tozinameran ในอาทิตย์แรกของโปรแกรมการฉีดวัคซีนของประเทศ[111] ในวันที่ 11 ธันวาคม 2020 องค์การอาหารและยาสหรัฐได้อนุญาตให้ใช้ tozinameran เป็นการฉุกเฉิน[112] อีกอาทิตย์ต่อมา ก็ให้อนุญาตเช่นกันกับวัคซีน mRNA-1273 ของบริษัทโมเดอร์นา จึงเป็นประเทศแรกที่อนุญาตให้ใช้วัคซีน 2 อย่างเป็นการฉุกเฉิน[113][114][115] เซพีจัดระยะการพัฒนาวัคซีนเป็นสามกลุ่ม คือ (1) ระยะการสำรวจ (exploratory) คือการวางแผนและออกแบบวัคซีนโดยไม่มีการประเมินในสิ่งมีชีวิต (2) พรีคลินิก (preclinical) คือการประเมินในสิ่งมีชีวิตและเตรียมตัวผลิตสารประกอบเพื่อจะทดสอบในมนุษย์ หรือ (3) ที่เริ่มทดสอบความปลอดภัยในมนุษย์อาสาสมัครที่สุขภาพดีระยะที่ 1 แล้ว[38] จนถึงกลางเดือนกันยายน มีวัคซีนแคนดิเดต 321 อย่างที่ได้ยืนยันแล้วว่ากำลังทดลองทางคลินิก หรือว่าเป็นโครงการสำรวจหรือพรีคลินิก[38] การทดลองระยะที่ 1 โดยหลักทดสอบความปลอดภัยและขนาดยาเป็นเบื้องต้นโดยให้ยาแก่อาสาสมัครสุขภาพดีเป็นสิบ ๆ คน ระยะที่ 2 ซึ่งทำหลังประสบความสำเร็จในระยะที่ 1 จะตรวจปฏิกิริยาของภูมิคุ้มกัน, ขนาดของยา (คือตรวจประสิทธิศักย์โดยใช้ค่าวัดของสารบ่งชี้ทางชีวภาพ คือ biomarker) และผลที่ไม่พึงประสงค์ ปกติทำกับคนเป็นร้อย ๆ คน[116][117] การทดลองระยะ 1–2 ทดสอบความปลอดภัยและการตอบสนองของภูมิคุ้มกันในเบื้องต้นโดยจะกำหนดขนาดที่ได้ผลให้แม่นยำด้วย[117] ส่วนการทดลองระยะที่ 3 ปกติจะมีอาสาสมัครมากกว่า มีกลุ่มควบคุม และทดสอบประสิทธิผลป้องกันโรคของวัคซีน (เป็นการทดลองแบบแทรกแซง คือ interventional) และจะเฝ้าสังเกตผลที่ไม่พึงประสงค์เมื่อใช้ขนาดยาที่ดีสุด[116][117] นิยามของความปลอดภัยของวัคซีน ประสิทธิศักย์ จุดยุติทางคลินิก (clinical endpoint) ในการทดลองระยะที่ 3 อาจต่างกันระหว่างบริษัทต่าง ๆ เช่นการนิยามระดับผลข้างเคียง การติดเชื้อ หรือการแพร่เชื้อ และว่า วัคซีนป้องกันการติดเชื้อโควิดแบบรุนแรงหรือแบบปานกลาง[118][119][120] วัคซีนที่ได้ขึ้นทะเบียนแล้ว
องค์กรควบคุมของประเทศต่าง ๆ ได้อนุมัติให้ใช้วัคซีน 11 ชนิดเป็นการฉุกเฉิน ในจำนวนนั้น 6 ชนิดได้รับอนุมัติจากองค์กรควบคุมที่องค์การอนามัยโลกจัดว่ามีระเบียบเคร่งครัด (stringent regulatory authorities) อย่างน้อย 1 แห่ง
การทดลองทางคลินิกในมนุษย์
การฉีดวัคซีนบูสต์ชนิดเดียวกันในเดือนกรกฎาคม 2021 องค์การอาหารและยาสหรัฐ (FDA) และศูนย์ควบคุมและป้องกันโรคสหรัฐ (CDC) ได้ร่วมกันแถลงการณ์ว่า การฉีดวัคซีนบูสต์ยังไม่จำเป็นสำหรับผู้ที่ได้รับวัคซีนตามสูตรแล้ว[544] โดยระบุด้วยว่า องค์กรต่าง ๆ ของรัฐรวมทั้ง FDA, CDC, และสถาบันสุขภาพแห่งชาติสหรัฐมุ่งมั่นใช้กระบวนการทางวิทยาศาสตร์ที่เข้มงวดเพื่อพิจารณาว่า เมื่อไรจึงต้องฉีดวัคซีนบูสต์[544] ต่อมาในเดือนสิงหาคม FDA และ CDC จึงได้อนุมัติให้ฉีดวัคซีนเอ็มอาร์เอ็นเอเป็นตัวบูสต์สำหรับผู้ที่มีภูมิคุ้มกันบกพร่อง[545][546] การฉีดวัคซีนบูสต์ต่างชนิดผู้เชี่ยวชาญบางส่วนเชื่อว่า การฉีดวัคซีนสองโดสต่างชนิดกัน (prime-boost vaccination) จะช่วยเพิ่มภูมิคุ้มกันเทียบกับการฉีดวัคซีนสองโดสเหมือนกัน โดยมีงานศึกษาที่กำลังตรวจสอบผลเช่นนี้อยู่[547] แม้จะยังไม่มีข้อมูลทางคลินิกเกี่ยวกับประสิทธิศักย์และความปลอดภัยของการฉีดวัคซีนไขว้เช่นนี้ แคนาดาและประเทศต่าง ๆ ในยุโรปต่างก็แนะนำให้ฉีดวัคซีนโดสที่สองต่างชนิดกันสำหรับบุคคลที่ได้รับวัคซีนแอสตร้าเซนเนก้าเป็นโดสที่หนึ่ง[548] ในเดือนกุมภาพันธ์ 2021 กลุ่มวิจัยวัคซีนที่มหาวิทยาลัยออกซฟอร์ดได้เริ่มการทดลองซึ่งตรวจสอบการได้วัคซีนโควิด-19 สองโดสโดยต่างชนิด[549] ณ เดือนมิถุนายนปีเดียวกัน ก็ได้ดำเนินไปถึงการทดลองทางคลินิกระยะที่ 2 แล้วโดยมีงานสองงาน คือ Com-COV และ Com-COV2[550] งานทดลอง Com-COV เปรียบการฉีดวัคซีนไขว้คือ วัคซีนของแอสตร้าเซนเนก้ากับของไฟเซอร์-ไบออนเทค เทียบกับการฉีดวัคซีนสองชนิดสองเข็มประเภทเดียวกัน โดยมีระยะห่าง 28 วัน (4 สัปดาห์) หรือ 84 วัน (12 สัปดาห์) ระหว่างโดส[551][552] [แหล่งอ้างอิงทางการแพทย์ที่ไม่น่าเชื่อถือ?] ส่วนงานทดลอง Com-COV2 ฉีดวัคซีนโดสแรกซึ่งไม่เป็นของแอสตร้าเซนเนก้าก็เป็นของไฟเซอร์ ส่วนโดสที่สองเป็นของโมเดอร์นา หรือของโนวาแวกซ์ หรือเป็นวัคซีนชนิดเดียวกันกับโดสแรก โดยฉีดห่างกัน 56 วัน (8 สัปดาห์) หรือ 84 วัน (12 สัปดาห์)[553] งานศึกษาอีกงานหนึ่งในสหราชอาณาจักรกำลังตรวจการฉีดบูสต์ซึ่งเลือกวัคซีนโดยสุ่ม วัคซีนอาจเป็นของแอสตร้าเซนเนก้า, ของไฟเซอร์, ของโมเดอร์นา, ของโนวาแวกซ์, VLA2001, CureVac, หรือของจอห์นสันแอนด์จอห์นสัน[554]
งานวิจัยพรีคลินิกในเดือนเมษายน องค์การอนามัยโลกแถลงการณ์โดยเป็นตัวแทนของนักวิทยาศาสตร์กลุ่มต่าง ๆ ทั่วโลกว่าจะร่วมมือกันเพื่อเร่งพัฒนาวัคซีนป้องกันโรคโควิด[562] โดยชักชวนองค์กรต่าง ๆ รวมทั้งองค์กรที่กำลังพัฒนาวัคซีนแคนดิเดต องค์กรควบคุมและตั้งนโยบายของรัฐ ผู้ให้เงินทุน องค์กรสาธารณสุข และรัฐบาล ให้ร่วมมือกันเพื่อให้สามารถผลิตวัคซีนที่มีประสิทธิผลได้โดยมีปริมาณเพียงพอในการแจกจำหน่ายให้แก่เขตต่าง ๆ ทั้งหมดของโลกโดยเฉพาะเขตที่ยากจน[31] เมื่อวิเคราะห์ประวัติของอุตสาหกรรมพัฒนาวัคซีนก็พบว่า การพัฒนาจะล้มเหลวในอัตราร้อยละ 84–90[31][89] อนึ่ง เพราะโควิดเป็นไวรัสใหม่ มีลักษณะต่าง ๆ ที่ยังไม่ชัดเจนทั้งหมด และต้องใช้กลยุทธ์และเทคโนโลยีใหม่ ๆ เพื่อพัฒนาวัคซีน ทุก ๆ ขั้นตอนจึงเสี่ยงไม่สำเร็จสูงมาก[31] เพื่อประเมินประสิทธิผลที่วัคซีนหนึ่ง ๆ อาจมี ก็จะต้องพัฒนาแบบจำลองทางคอมพิวเตอร์และสัตว์จำลองซึ่งเฉพาะเจาะจงต่อโควิดที่ไม่เคยมีมาก่อน และสิ่งจำลองเหล่านี้ก็ยังไม่สามารถทดสอบยืนยันกับลักษณะต่าง ๆ ของไวรัสที่ยังไม่ปรากฏ เป็นสิ่งที่ต้องร่วมกันทำโดยกำลังจัดตั้งในปี 2020[31] ในบรรดาวัคซีนแคนดิเดตที่ยืนยันแล้วว่ากำลังพัฒนา บริษัทเอกชนเป็นผู้พัฒนาในอัตราร้อยละ 70 ที่เหลือนักวิชาการ รัฐบาล และองค์กรสาธารณสุขเป็นผู้พัฒนา[38] ผู้พัฒนาวัคซีนโดยมากเป็นบริษัทเล็ก ๆ หรือทีมนักวิจัยในมหาวิทยาลัยผู้มีประสบการณ์น้อยในการออกแบบวัคซีนให้ประสบความสำเร็จ มีทุนจำกัดเพื่อทำงานทดลองทางคลินิกที่ซับซ้อนและเพื่อผลิตวัคซีนถ้าไม่ได้บริษัทเภสัชภัณฑ์ยักษ์ใหญ่ข้ามชาติเป็นหุ้นส่วน[38][31] ผู้กำลังพัฒนาวัคซีนรวมองค์กรในสหรัฐและแคนาดาซึ่งทั้งสองรวมกันมีงานวิจัยวัคซีนที่กำลังดำเนินการเป็นอัตราร้อยละ 46 ทั้งหมดของโลก เทียบกับเอเชียที่ร้อยละ 36 รวมทั้งประเทศจีน และกับยุโรปที่ร้อยละ 18[31] การทดลองระยะ 1 ที่วางแผนในปี 2020วัคซีนแคนดิเดตที่กำลังออกแบบหรือพัฒนาในระยะพรีคลินิกสำหรับโควิดอาจไม่ได้รับอนุมัติให้ศึกษาในมนุษย์ช่วงปี 2020 เพราะเป็นพิษ ไม่มีประสิทธิผลชักนำให้ภูมิคุ้มกันตอบสนอง หรือล้มเหลวในด้านต่าง ๆ ในสัตว์ทดลอง หรืออาจไม่มีทุนพอ[563][564] สำหรับโรคติดเชื้อ โอกาสประสบความสำเร็จของวัคซีนแคนดิเดตในการฝ่าอุปสรรคระยะพรีคลินิกแล้วเข้าสู่การทดลองในมนุษย์ระยะที่ 1 อยู่ในอัตราร้อยละ 41–57[563] ค่าใช้จ่ายของการทดลองเบื้องต้นในมนุษย์ค่อนข้างสูงสำหรับผู้พัฒนาวัคซีน ประเมินอยู่ที่ 14–25 ล้านดอลลาร์สหรัฐ (ประมาณ 440–786 ล้านบาท) สำหรับโปรแกรมการทดลองระยะที่ 1 ทั่วไป แต่ก็อาจถึง 70 ล้านดอลลาร์สหรัฐ (ประมาณ 2,200 ล้านบาท) ได้เหมือนกัน[563][565] เมื่อเปรียบเทียบกับ|โรคไวรัสอีโบลาที่ระบาดทั่วระหว่างปี 2013–2016 ซึ่งมีวัคซีนแคนดิเดต 37 ชนิดที่พัฒนาอย่างเร่งด่วน มีเพียงชนิดเดียวเท่านั้นที่ได้รับอนุมัติให้ใช้เป็นวัคซีน โดยมีค่าใช้จ่ายเพื่อยืนยันประสิทธิผลในการทดลองระยะที่ 2–3 ประมาณพันล้านดอลลาร์สหรัฐ (35,292 ล้านบาท)[563]
วัคซีนที่ไม่เฉพาะเจาะจงโรคโควิดวัคซีนบางชนิดมีผลที่ไม่เฉพาะเจาะจง (non-specific effects) คืออาจมีประโยชน์เกินนอกเหนือจากโรคที่ป้องกัน[566] แม้อ้างว่า (มี.ค., มิ.ย. และ ก.ค.) อัตราการตายเหตุโควิดจะต่ำกว่าในประเทศที่ฉีดวัคซีนบีซีจีเพื่อป้องกันวัณโรคเป็นปกติ[567][568][569][570] แต่องค์การอนามัยโลกก็กล่าวในเดือนเมษายนว่า ไม่มีหลักฐานว่าวัคซีนนี้มีผลต้านโควิด[571] ในเดือนมีนาคม 2020 ประเทศเนเธอร์แลนด์ได้เริ่มการทดลองวัคซีนบีซีจีแบบสุ่มเพื่อลดการติดโรคโควิดโดยรับแพทย์พยาบาล 1,000 คน[572] ออสเตรเลียก็ทดลองแบบสุ่มเช่นกันโดยรับแพทย์พยาบาล 4,170 คน[573][574] การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยยาหลอกเพื่อตรวจว่าวัคซีนเอ็มเอ็มอาร์ (ป้องกันโรคหัด-คางทูม-หัดเยอรมัน) สามารถป้องกันแพทย์พยาบาลจากโรคโควิดจะเริ่มในเดือนพฤษภาคม 2020 ที่กรุงไคโรโดยรับอาสาสมัคร 200 คน[575] วัคซีนบีซีจีนักวิจัยได้ศึกษาวัคซีนบีซีจีอันอาจมีผลที่ไม่เฉพาะเจาะจง (non-specific effects) เป็นการป้องกันการติดเชื้อไวรัสโควิด-19 หลังจากสังเกตการณ์ว่าอัตราตายและความรุนแรงของโรคจะน้อยกว่าในประเทศกำลังพัฒนา (ที่มักใช้วัคซีนนี้) แต่องค์การอนามัยโลกก็เตือนว่า มีปัจจัยหลายอย่างที่อาจมีผลต่อข้อสังเกตเช่นนี้เช่น อัตราการตรวจโรคโควิดและภาระโรค (disease burden)[576] ในการทดลองแบบสุ่มและมีกลุ่มควบคุม วัคซีนนี้พบว่ามีผลไม่เฉพาะเจาะจงเป็นการป้องกันการติดเชื้อทางลมหายใจอื่น ๆ[577] ปัจจุบัน ยังไม่มีหลักฐานพอสนับสนุนข้อสรุปว่า วัคซีนบีซีจีมีประสิทธิภาพป้องกันโควิด[578] ในเดือนตุลาคม มหาวิทยาลัยเอ็กซิเตอร์ (อังกฤษ) ประกาศการทดลองนานาชาติขนาดใหญ่เพื่อศึกษาว่า การให้วัคซีนบีซีจีสามารถลดอันตรายของโควิดต่อบุคลากรทางแพทย์หรือไม่[579][580] ซึ่งเนเธอร์แลนด์ก็ประกาศเช่นเดียวกันในเดือนพฤษภาคมก่อนหน้านั้น[577]
การใช้ตัวเสริม (adjuvant)จนถึงเดือนกันยายน 2020 วัคซีนแคนดิเดต 11 อย่างที่อยู่ในระยะการทดลองทางคลินิกใช้ตัวเสริมเพื่อเพิ่มการตอบสนองของภูมิคุ้มกัน[38] ตัวเสริม หรือ immunological adjuvant เป็นสารที่เลือกใช้กับวัคซีนเพื่อเพิ่มการตอบสนองของภูมิคุ้มกันต่อแอนติเจน เช่นต่อไวรัสโควิดหรือไข้หวัดใหญ่[581] ตรง ๆ ก็คือ ตัวเสริมอาจใช้กับวัคซีนโควิดเพื่อเพิ่มการตอบสนองของภูมิคุ้มกันและเพิ่มประสิทธิศักย์ในการลดหรือป้องกันการติดเชื้อโควิดในบุคคลที่ได้วัคซีน[581][582] ตัวเสริมอาจมีประสิทธิภาพเป็นพิเศษในเทคโนโลยีที่ใช้ไวรัสโควิดเชื้อตาย (inactivated) ในวัคซีนโปรตีนที่ได้จากยีนลูกผสม (recombinant protein) หรือในวัคซีนที่ใช้เวกเตอร์ (vector)[582] เกลืออะลูมิเนียม (aluminum salt, alum) เป็นตัวเสริมแรกที่ใช้ในวัคซีนซึ่งได้อนุมัติ โดยเลือกใส่ในวัคซีนที่ใช้ตัวเสริมเกินร้อยละ 80[582] และได้ใช้มาตั้งแต่คริสต์ทศวรรษ 1920 เป็นสารที่เริ่มกลไกทางโมเลกุลและเซลล์อย่างหลายหลากเพื่อเพิ่มการตอบสนองของภูมิคุ้มกัน รวมทั้งการปล่อยไซโตไคน์ที่เสริมการอักเสบ[581][582]
ประสิทธิศักย์ ประสิทธิศักย์ของวัคซีน (efficacy) หมายถึงสมรรถภาพของวัคซีนในการลดความเสี่ยงการติดโรคของผู้ได้รับวัคซีนในการทดลองแบบมีกลุ่มควบคุม โดยเทียบกับผู้ไม่ได้รับ[147] ประสิทธิศักย์ที่ ร้อยละ 0 หมายถึงวัคซีนไม่มีผลเลย (คือมีผลเท่ากับยาหลอก) และที่ร้อยละ 50 ก็หมายถึงการมีกรณีการติดโรคครึ่งหนึ่งเทียบกับผู้ไม่ได้วัคซีน ประสิทธิศักย์อาจลดลงถ้าผู้ฉีดจับแขนหรือบีบแขนของผู้รับวัคซีนอย่างไม่ถูกต้อง ทำให้ฉีดวัคซีนเข้าใต้ผิวหนังแทนที่จะฉีดเข้ากล้ามเนื้อ[584][585] แนวทางการปฏิบัติปัจจุบันของศูนย์ป้องกันโรคสหรัฐก็คือไม่ควรฉีดวัคซีนซ้ำหลังจากที่ได้ฉีดพลาดเข้าใต้ผิวหนัง[586] เป็นการยากที่จะเทียบประสิทธิศักย์ของวัคซีนต่างชนิดกัน เพราะข้อมูลประสิทธิศักย์ของวัคซีนแต่ละชนิดได้จากการทำการทดลองกับกลุ่มประชากรที่ต่างกัน ในภูมิภาคที่ต่างกัน และกับไวรัสสายพันธุ์ต่าง ๆ กัน[587] สำหรับโควิด-19 ประสิทธิศักย์ที่ร้อยละ 67 อาจพอชลอให้โรคระบาดช้าลง แต่วัคซีนที่มีในปัจจุบันก็ไม่ได้สร้างภูมิคุ้มกันแบบกำจัดเชื้อ (sterilizing immunity)[588] ซึ่งจำเป็นในการป้องกันไม่ให้โรคติดต่อ ประสิทธิศักย์ของวัคซีนจริง ๆ สะท้อนเพียงการป้องกันโรค และอาจเป็นตัวบ่งชี้การติดต่อเชื้อที่ไม่ดีเพราะผู้ไม่มีอาการก็ยังสามารถแพร่เชื้อไปให้คนอื่นได้มาก[589] องค์การอาหารและยาสหรัฐ (FDA) และสำนักงานการแพทย์ยุโรป (EMA) มีเกณฑ์ประสิทธิศักย์ขั้นต่ำของวัคซีนโควิด-19 ที่ร้อยละ 50 สำหรับการขึ้นทะเบียนให้ใช้[590][591][592] ทั่วไปแล้ว การฉีดวัคซีนให้ประชากรร้อยละ 75 เป็นเป้าหมายที่เชื่อว่าปฏิบัติได้จริง ดังนั้น วัคซีนจึงต้องมีประสิทธิภาพอย่างน้อยร้อยละ 70 เพื่อไม่ให้โรคระบาด (ขึ้นอยู่กับค่าระดับการติดเชื้อพื้นฐาน คือ ) และร้อยละ 80 เพื่อกำจัดโรคโดยไม่ต้องควบใช้นโยบายอื่น ๆ เช่น การเว้นระยะห่างทางสังคม[593] ประสิทธิศักย์ที่ไม่น้อยของวัคซีนเอ็มอาร์เอ็นเอบางอย่างหลังจากฉีดเพียงแค่โดสเดียวเป็นตัวบ่งว่า[594] การฉีดวัคซีนแต่ละโดสสัมพันธ์อย่างไม่เชิงเส้นกับประสิทธิศักย์ ซึ่งจริง ๆ ก็ได้เห็นแล้วตั้งแต่การทดลองระยะที่ 1-2[595] และแสดงนัยว่า การให้วัคซีนในขนาดที่เฉพาะบุคคล ๆ (เช่น ให้เต็มสูตรสำหรับคนชรา ให้น้อยลดสำหรับเยาวชน[596] และให้เพิ่มสำหรับผู้มีภูมิคุ้มกันบกพร่อง[597]) อาจช่วยเร่งการฉีดวัคซีนให้แก่ประชาชนเมื่อวัคซีนมีจำกัด และช่วยย่นระยะเหตุการณ์ระบาด ดังที่จริง ๆ แบบจำลองการระบาดได้แสดงให้เห็นแล้ว[598] พิสัยต่าง ๆ ในตารางต่อไปนี้มีช่วงความเชื่อมั่น (CI) ที่ร้อยละ 95 ยกเว้นจะระบุเป็นพิเศษ โดยค่าเป็นจริงสำหรับคนทุกช่วงอายุตามแหล่งอ้างอิง โดยนิยามแล้ว ความแม่นยำของค่าประเมินที่ไม่มีช่วงความเชื่อมั่นจะยังไม่ชัดเจน ค่าประสิทธิศักย์ในการป้องกันโรคที่มีอาการรุนแรงเป็นเรื่องสำคัญสุด เพราะการเข้า รพ. และความตายเป็นปัญหาทางสาธารณสุขที่ต้องป้องกันก่อนอื่น[599] วัคซีนที่ได้ขึ้นทะเบียนให้ใช้มีค่าประสิทธิศักย์ดังต่อไปนี้
ประสิทธิภาพ/ประสิทธิผล (effectiveness)งานศึกษาประสิทธิภาพของวัคซีนในสถานการณ์จริงจะวัดว่า วัคซีนสามารถป้องกันเหตุการณ์ต่าง ๆ รวมทั้งการติดเชื้อ อาการแสดง การเข้า รพ. และการตายได้แค่ไหน โดยติดตามตรวจสอบกับกลุ่มประชากรขนาดใหญ่ในเหตุการณ์จริงที่ปัจจัยต่าง ๆ ไม่ได้เป็นไปตามคาดหวังทุกอย่าง[619]
อัตราการฉีดวัคซีนครอบคลุมวิกฤติแม้เป้าหมายแรกสุดในเหตุการณ์โรคระบาดทั่วก็คือป้องกันคนไม่ไให้ติดโรค แต่เป้าหมายระยะยาวปกติก็คือเพื่อกำจัดโรคในที่สุด แต่จะทำอย่างนี้ได้ สัดส่วนประชากรที่มีภูมิคุ้มกันจะต้องยิ่งกว่าอัตราการฉีดวัคซีนครอบคลุมวิกฤติ คือ ซึ่งสามารถคำนวณได้จากค่าระดับการติดเชื้อพื้นฐาน คือ และประสิทธิภาพของวัคซีนในการป้องกันการติดต่อโรค คือ ดังนี้คือ[644]
สำหรับเชื้อโควิด-19 ถ้าสมมุติว่า R0 ≈ 2.87[645] อัตราการฉีดวัคซีนครอบคลุมวิกฤติก็จะต้องยิ่งกว่าร้อยละ 72.4 สำหรับวัคซีนที่มีประสิทธิภาพป้องกันการติดต่อโรคได้ร้อยละ 90 เมื่อใช้สมการเดียวกัน ประสิทธิภาพป้องกันการติดต่อโรคที่จำเป็นของวัคซีนสามารถคำนวณได้โดยสมการ
ถ้าสมมุติเช่นกันว่า R0 ≈ 2.87 และสมมุติว่า จริง ๆ คงจะฉีดวัคซีนให้ประชากรได้ประมาณร้อยละ 75 วัคซีนก็จะต้องมีประสิทธิภาพป้องกันการติดต่อโรคได้ยิ่งกว่าร้อยละ 86.9[593] แต่ถ้าสมมุติอัตราการฉีดวัคซีนที่จริง ๆ ทำไม่ได้ว่าเต็มร้อย วัคซีนก็จะต้องมีประสิทธิภาพป้องกันการติดต่อโรคได้ยิ่งกว่าร้อยละ 65.2 และที่มีประสิทธิภาพน้อยกว่านี้ก็จะไม่สามารถกำจัดโรคได้ จนถึงเดือนมิถุนายน 2021 งานศึกษาหลังวางตลาด (post-marketing) หลายงานได้ประเมินประสิทธิภาพของวัคซีนในการป้องกันการติดเชื้อที่ไม่แสดงอาการ แม้การป้องกันการติดเชื้อจะมีผลชะลอการติดต่อโรค (โดยเฉพาะแบบไม่แสดงอาการ) แต่ก็ยังต้องตรวจสอบผลระงับการติดต่อโรคที่ได้แน่นอนต่อไป[646] ไวรัสโควิด-19 บางสายพันธุ์ติดต่อได้ง่ายกว่า คือมีค่าระดับการติดเชื้อยังผล (effective reproduction number) ที่สูงกว่า ซึ่งระบุว่ามีค่าระดับการติดเชื้อพื้นฐานที่สูงกว่า ดังนั้น การควบคุมโรคจึงต้องอาศัยอัตราการฉีดวัคซีนครอบคลุมที่สูงกว่า หรือวัคซีนต้องมีประสิทธิภาพป้องกันการติดต่อได้สูงกว่า หรืออาจจะต้องได้ปัจจัยทั้งสองอย่าง ในเดือนกรกฎาคม 2021 ผู้เชี่ยวชาญหลายท่านระบุว่า การได้ภูมิคุ้มกันหมู่ในปัจจุบันอาจเป็นไปไม่ได้เพราะว่าสายพันธุ์เดลตายังสามารถติดต่อได้แม้ในบุคคลที่ฉีดวัคซีนแล้ว[647] ศูนย์ควบคุมและป้องกันโรคสหรัฐมีข้อมูลที่ระบุว่า คนที่ฉีดวัคซีนแล้วสามารถแพร่เชื้อสายพันธุ์เดลตา ซึ่งเจ้าหน้าที่เชื่อว่าไม่เกิดกับสายพันธุ์โควิด-19 อื่น ๆ[648]
สายพันธุ์ของไวรัสโควิด-19ปฏิสัมพันธ์ระหว่างไวรัสโควิด-19 กับมนุษย์ตอนแรกเป็นไปตามธรรมชาติ แต่ปัจจุบันได้เปลี่ยนไปเพราะการฉีดวัคซีน[649] โอกาสการเกิดสายพันธุ์โควิดที่ดื้อต่อแอนติบอดีที่วัคซีนรุ่นปัจจุบันกระตุ้นให้เกิด อาจทำให้ต้องปรับปรุงวัคซีน[650] การทดลองต่าง ๆ ได้ระบุว่า วัคซีนที่พัฒนาเพื่อต่อต้านสายพันธุ์ดั้งเดิมมีประสิทธิศักย์ต่อต้านการติดเชื้อแบบแสดงอาการที่ลดลงสำหรับสายพันธุ์บางสายพันธุ์[651] อัลฟา (B.1.1.7)ในเดือนธันวาคม สายพันธุ์ใหม่ของไวรัสโควิด-19 คือสายพันธุ์อัลฟา (B.1.1.7) ได้พบเป็นครั้งแรกในสหราชอาณาจักร[652] องค์การอนามัยโลกระบุว่ามีหลักฐานจำกัดที่แสดงว่าวัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้า ของไฟเซอร์-ไบออนเทค และโนวาแวกซ์ยังคงประสิทธิผล/ประสิทธิภาพต่อต้านสายพันธุ์อัลฟาอยู่ ส่วนวัคซีนอื่น ๆ ยังไม่มีข้อมูล ในเรื่องการคงระดับแอนติบอดีลบล้างฤทธิ์ซึ่งป้องกันการติดเชื้อแบบไม่แสดงอาการและสำคัญในการยุติเหตุการณ์ระบาดทั่ว วัคซีนที่ใช้มากที่สุดรวมทั้งสปุตนิกวี วัคซีนของไฟเซอร์-ไบออนเทค ของโมเดอร์นา ของซิโนแวค ของซิโนฟาร์ม และโคแว็กซิน ก็ปรากฏว่าคงระดับแอนติบอดีสำหรับสายอัลฟาด้วย สำหรับวัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้า ระดับแอนติบอดีลดลงเล็กน้อยจนถึงปานกลาง ส่วนวัคซีนอื่น ๆ ยังไม่มีข้อมูล[653] ผลเบื้องต้นแสดงว่า วัคซีนของไฟเซอร์-ไบออนเทคและโมเดอร์นาสามารถป้องกันสายพันธุ์นี้[654][655] งานศึกษาหนึ่งระบุว่า วัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้ามีประสิทธิศักย์ระหว่าง 42-89 ต่อต้านสายพันธุ์นี้ เทียบกับร้อยละ 71-91 สำหรับสายพันธุ์อื่น[656] ผลเบื้องต้นจากการทดลองทางคลินิกระบุว่า วัคซีนโนวาแวกซ์มีประสิทธิภาพประมาณร้อยละ 96 สำหรับการติดเชื้อที่แสดงอาการสำหรับสายพันธุ์ดั้งเดิม และประมาณร้อยละ 86 สำหรับสายพันธุ์อัลฟา[657] เบตา (B.1.351)องค์การอนามัยโลกระบุว่า มีหลักฐานจำกัดจากงานศึกษาเบื้องต้นหลายงานที่แสดงว่าวัคซีนต่าง ๆ มีประสิทธิศักย์/ประสิทธิภาพต่อต้านสายพันธุ์เบตาลดลงในระดับต่าง ๆ รวมทั้งวัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้า (อาจจะมาก) โนวาแวกซ์ (ปานกลาง) วัคซีนของบริษัทไฟเซอร์-ไบออนเทคและจอห์นสันแอนด์จอห์นสัน (น้อย) โดยยังไม่มีข้อมูลสำหรับวัคซีนอื่น ๆ ในเรื่องการคงระดับแอนติบอดีลบล้างฤทธิ์ซึ่งป้องกันการติดเชื้อแบบไม่แสดงอาการและสำคัญในการยุติเหตุการณ์ระบาดทั่ว วัคซีนที่ใช้มากที่สุดรวมทั้งวัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้า สปุตนิกวี จอห์นสันแอนด์จอห์นสัน ไฟเซอร์-ไบออนเทค โมเดอร์นา และโนวาแวกซ์ล้วนมีแอนติบอดีลดลงในระดับน้อยจนถึงมาก ยกเว้นซิโนแวคและซิโนฟาร์มที่มีแอนติบอดีลดลงน้อย โดยวัคซีนอื่น ๆ ยังไม่มีข้อมูล[653] โมเดอร์นาได้เริ่มทำการทดลองวัคซีนรุ่นใหม่เพื่อจัดการสายพันธุ์เบตา (B.1.351) แล้ว[658] ในวันที่ 17 กุมภาพันธ์ 2021 บริษัทไฟเซอร์ประกาศว่า สำหรับสายพันธุ์นี้ อานุภาพทำลายฤทธิ์ไวรัสของแอนติบอดีที่เนื่องกับวัคซีนลดลงถึง 2/3 โดยระบุด้วยว่ายังไม่สามารถกำหนดประสิทธิศักย์ของวัคซีนในการป้องกันการติดเชื้อแบบแสดงอาการ[659] งานศึกษาหลายงานต่อมาได้ตรวจน้ำเหลืองของคนไข้ที่ได้ฉีดวัคซีนของโมเดอร์นาและของไฟเซอร์-ไบออนเทคแล้วยืนยันว่า อานุภาพทำลายฤทธิ์ไวรัสของแอนติบอดีที่เนื่องกับวัคซีนลดลงจริง ๆ[655][660] แต่ในวันที่ 1 เมษายน 2021 รายงานจากการทดลองวัคซีนของไฟเซอร์-ไบออนเทคในแอฟริกาใต้กลับรายงานว่า วัคซีนมีประสิทธิภาพเต็มร้อยจนถึงตอนนั้น (คือ อาสาสมัครที่ฉีดวัคซีนไม่มีใครติดโรคเลย) เทียบกับกลุ่มยาหลอกที่อาสาสมัคร 6 คนติดเชื้อชนิดเบตา[661] ในเดือนมกราคม 2021 บริษัทจอห์นสันแอนด์จอห์นสันซึ่งกำลังทดสอบวัคซีนโควิด-19 ในแอฟริกาใต้ รายงานว่าประสิทธิศักย์การป้องกันการติดเชื้อแบบมีอาการปานกลางจนถึงหนักอยู่ที่ร้อยละ 72 ในสหรัฐและร้อยละ 57 ในแอฟริกาใต้[662] ในวันที่ 6 กุมภาพันธ์ หนังสือพิมพ์อังกฤษ Financial Times ได้รายงานข้อมูลเบื้องต้นจากงานศึกษาในแอฟริกาใต้ร่วมกับมหาวิทยาลัยออกซฟอร์ดที่แสดงว่า วัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้ามีประสิทธิศักย์ลดลงสำหรับสายพันธุ์นี้[663] โดยพบว่า ในบรรดาผู้ได้รับวัคซีน 2,000 คน วัคซีนสามารถป้องกันโรคได้เพียงเล็กน้อยยกเว้นแต่คนที่มีอาการหนักสุด[664] ต่อมาในวันที่ 7 กุมภาพันธ์ 2021 กระทรวงสาธารณสุขแอฟริกาใต้จึงระงับแผนการฉีดวัคซีนนี้ 1 ล้านโดสให้แก่ประชาชน[664][665] ในเดือนมีนาคม 2021 มีรายงานว่า "ประสิทธิศักย์เบื้องต้นที่พบ" ของโนวาแว็กซ์ (NVX-CoV2373) สำหรับการติดเชื้อชนิดเบตาที่มีอาการอ่อน ปานกลาง และรุนแรง[666] สำหรับอาสาสมัครที่ตรวจไม่พบเอชไอวีอยู่ที่ร้อยละ 51 แกมมา (P.1)องค์การอนามัยโลกระบุว่ามีหลักฐานจำกัดที่แสดงว่าวัคซีนของซิโนแวคและของซิโนฟาร์ม ยังคงประสิทธิผล/ประสิทธิภาพต่อต้านสายพันธุ์แกมมาอยู่ ส่วนวัคซีนอื่น ๆ ยังไม่มีข้อมูล ในเรื่องการคงระดับแอนติบอดีลบล้างฤทธิ์ซึ่งป้องกันการติดเชื้อแบบไม่แสดงอาการและสำคัญในการยุติเหตุการณ์ระบาดทั่ว วัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้าและของซิโนแวคไม่ลดหรือแทบไม่ลดประสิทธิภาพต่อต้านสายพันธุ์แกมมาเลย วัคซีนของไฟเซอร์-ไบออนเทคและของโมเดอร์นาลดลงบางเล็กน้อยจนถึงปานกลาง ส่วนวัคซีนอื่น ๆ ยังไม่มีข้อมูล[653] ดังนั้น สายพันธุ์แกมมา (P.1, 20J/501Y.V3) ซึ่งเริ่มต้นพบที่บราซิล ดูเหมือนจะหลบภูมิคุ้มกันเนื่องกับวัคซีนของไฟเซอร์-ไบออนเทคได้บ้าง[660] เดลตา (B.1.617.2)สายพันธุ์เดลตา หรือ B.1.617.2 หรือ G/452R.V3 หรือ 21A[667] หรือ 21A/S:478K[668] ได้พบครั้งแรกในอินเดียเมื่อเดือนตุลาคม 2020 แต่หลังจากนั้นก็ได้กระจายไปยังประเทศอื่น ๆ แล้ว เป็นสายพันธุ์ลูกหลานของ B.1.617 เช่นเดียวกับสายพันธุ์แคปปาที่กำลังตรวจสอบ[669][670][671][672][673] ในวันที่ 6 พฤษภาคม 2021 นักวิทยาศาสตร์อังกฤษได้ประกาศสายพันธุ์นี้ (ซึ่งมีจุดเด่นคือ ไม่มีการกลายพันธุ์ E484Q) ว่าเป็นสายพันธุ์ที่น่าเป็นห่วงโดยกำหนดรหัสเป็น VOC-21APR-02 หลังจากที่พบหลักฐานว่ามันกระจายไปได้เร็วกว่าไวรัสดั้งเดิมและอาจกระจายได้เร็วเท่าสายพันธุ์อัลฟา[674][675][676] มันมีการกลายพันธุ์ L452R, T478K และ P681R[677] แต่ก็ไม่เหมือนกับสายพันธุ์แคปปาเพราะไม่มีการกลายพันธุ์ E484Q องค์การอนามัยโลกระบุว่า มีหลักฐานจำกัดจากงานศึกษาเบื้องต้นต่าง ๆ ที่แสดงว่าวัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้าและของไฟเซอร์-ไบออนเทคยังคงประสิทธิผล/ประสิทธิภาพต่อสายพันธุ์นี้ ส่วนวัคซีนอื่น ๆ ยังไม่มีข้อมูล ในเรื่องการคงระดับแอนติบอดีลบล้างฤทธิ์ซึ่งป้องกันการติดเชื้อแบบไม่แสดงอาการและสำคัญในการยุติเหตุการณ์ระบาดทั่ว วัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้ามีประสิทธิภาพลดลงอย่างมาก และวัคซีนของไฟเซอร์-ไบออนเทคและโคแว็กซินมีประสิทธิภาพลดลงน้อยจนถึงปานกลาง ส่วนวัคซีนอื่น ๆ ยังไม่มีข้อมูล[653] ข้อจำกัดและปัญหาที่อาจเกิดการรีบเร่งพัฒนาและผลิตวัคซีนเพื่อโควิด-19 ที่ระบาดทั่วอาจเพิ่มความเสี่ยงและอัตราความล้มเหลวของการได้วัคซีนที่ปลอดภัยและมีประสิทธิผล[92][31][678] งานศึกษาหนึ่งพบว่าในระหว่างปี 2006-2015 สำหรับวัคซีน การได้รับอนุมัติให้ทำการทดลองระยะที่ 1 แล้วผ่านการทดลองระยะที่ 3 อย่างสำเร็จอยู่ที่อัตราร้อยละ 16.2 [89] และเซพีก็ได้ระบุว่าอัตราประสบความสำเร็จของวัคซีนแคนดิเดตที่กำลังพัฒนาอยู่ในปี 2020 น่าจะอยู่ที่เพียงร้อยละ 10[31] ในเดือนเมษายน 2020 รายงานของเซพีระบุว่า "การประสานงานและการร่วมมือกันอย่างเข้มแข็งและเป็นสากลระหว่างผู้พัฒนาวัคซีน องค์กรควบคุม องค์กรตั้งนโยบาย ผู้ให้เงินทุน องค์กรสาธารณสุข และรัฐบาลเป็นเรื่องจำเป็นเพื่อให้วัคซีนแคนดิเดตในระยะสุดท้าย ๆ สามารถผลิตได้อย่างเพียงพอและแจกจำหน่ายให้แก่เขตติดโรคทั้งหมดได้อย่างยุติธรรม โดยเฉพาะแก่เขตที่ยากจน"[31] แต่ประชากรอาจถึงร้อยละ 10 ก็รู้สึกว่าวัคซีนไม่ปลอดภัยหรือไม่จำเป็น และไม่ยอมรับวัคซีน ซึ่งเป็นอันตรายต่อสาธารณสุขของโลกที่ได้ชื่อว่า vaccine hesitancy (ความลังเลกับวัคซีน)[679] และเพิ่มความเสี่ยงว่าโควิดจะเกิดระบาดอีก[680] ในกลางปี 2020 งานสำรวจสองงานประเมินว่าประชากรสหรัฐร้อยละ 67 หรือ 80 จะยอมรับการฉีดวัคซีนป้องกันโควิด โดยมีความต่าง ๆ กันมากเหตุระดับการศึกษา การมีงานทำ เชื้อชาติ และภูมิลำเนา[681][682] ปัญหาความปลอดภัยทางชีวภาพงานวิจัยเบื้องต้นเพื่อประเมินประสิทธิผลของวัคซีนโดยใช้สัตว์แบบจำลองที่เฉพาะต่อโรคโควิด (เช่น หนูเพาะให้มียีนหน่วยรับ ACE) และใช้สัตว์ทดลองอื่น ๆ และไพรเมตที่ไม่ใช่มนุษย์ แสดงว่าต้องรักษาความปลอดภัยทางชีวภาพในระดับ 3 เมื่อทดลองไวรัสที่ยังไม่ตาย และต้องร่วมมือกันในระดับสากลเพื่อให้มีมาตรฐานรักษาความปลอดภัย[92][31] การเพิ่มฤทธิ์ของเชื้อโดยอาศัยภูมิต้านทาน (ADE)แม้วัคซีนจะมุ่งช่วยกระตุ้นให้ร่างกายผลิตสารภูมิต้านทานเพื่อกำจัดเชื้อโรค แต่วัคซีนก็อาจมีผลตรงกันข้ามโดยเพิ่มฤทธิ์ของเชื้อ เป็นกระบวนการที่เรียกว่า การเพิ่มฤทธิ์ของเชื้อโดยอาศัยภูมิต้านทาน (antibody-dependent enhancement, ADE) ซึ่งเพิ่มสมรรถภาพของไวรัสในการจับกับเซลล์เป้าหมายในร่างกายแล้วจุดชนวนอาการพายุไซโตไคน์เมื่อติดเชื้อหลังจากได้วัคซีน[92][683] แพลตฟอร์มเทคโนโลยีของวัคซีน (เช่น ใช้ไวรัสเป็นเวกเตอร์, ใช้โปรตีน spike ของไวรัส หรือใช้หน่วยย่อยโปรตีนของไวรัส), ขนาดวัคซีนที่ให้, ระยะเวลาระหว่างการให้วัคซีนซ้ำ ๆ เพราะโอกาสการติดเชื้อโควิดอีก และอายุมาก ล้วนเป็นปัจจัยที่กำหนดความเสี่ยงและความรุนแรงของ ADE[92][683] การตอบสนองของภูมิคุ้มกันต่อวัคซีนก็ยังขึ้นอยู่กับเทคโนโลยีที่ใช้ รวมทั้งความแม่นยำของกลไกการทำงานของวัคซีน[92] หรือวิธีการให้ (ฉีดในกล้ามเนื้อ ฉีดใต้ผิวหนัง ให้ทางปาก ให้ทางจมูก เป็นต้น)[683][684] ประสิทธิศักย์ (efficacy)
ประสิทธิภาพ (effectiveness) ของวัคซีนขึ้นอยู่กับประสิทธิศักย์ (efficacy) ของวัคซีน[147] ประสิทธิศักย์ที่น้อยกว่าร้อยละ 60 ก็อาจไม่ก่อภูมิคุ้มกันหมู่[29][684] ปัจจัยส่วนบุคคลที่ทำให้เสี่ยงติดโรค เช่น ยีน สุขภาพ (โรคประจำตัว อาหาร การตั้งครรภ์ ไวหรือแพ้อะไรง่าย) ภูมิคุ้มกัน อายุ ฐานะทางเศรษฐกิจ หรือวัฒนธรรม อาจเป็นปัจจัยปฐมภูมิหรือทุติยภูมิซึ่งมีผลต่อความรุนแรงเมื่อติดโรคและการตอบสนองต่อวัคซีน[684] คนชรา (อายุเกิน 60 ปี) ผู้มีภูมิแพ้ และคนอ้วนเสี่ยงมีการตอบสนองของภูมิคุ้มกันที่อ่อนแอแล้วทำให้วัคซีนไม่มีประสิทธิผล จึงอาจต้องใช้เทคโนโลยีวัคซีนโดยเฉพาะ ๆ สำหรับคนกลุ่มเฉพาะ ๆ หรือต้องให้วัคซีนซ้ำ ๆ เพื่อจำกัดการแพร่เชื้อ[684] อนึ่ง การกลายพันธุ์ของเชื้อไวรัสอาจเปลี่ยนโครงสร้างที่เป็นเป้าหมายของวัคซีน ทำให้วัคซีนไม่ได้ผล[685][686] การรับสมัครอาสาสมัครเพื่อทดลองผู้พัฒนาวัคซีนต้องลงทุนแข่งขันในระดับนานาชาติเพื่อหาอาสาสมัครสำหรับการทดลองทางคลินิกระยะ 2–3 ให้มีจำนวนเพียงพอเพราะไวรัสระบาดไปในอัตราต่าง ๆ กันทั้งข้ามประเทศและในประเทศ[118] ยกตัวอย่างเช่น ในเดือนมิถุนายน บริษัทผลิตวัคซีนจีนคือซิโนแว็กไบโอเท็กได้ร่วมมือกับมาเลเซีย แคนาดา สหราชอาณาจักร และบราซิลเพื่อรับอาสาสมัครในการทดลองและเพื่อผลิตวัคซีนให้ได้จำนวนเพียงพอสำหรับการทดลองระยะที่ 3 ในประเทศบราซิลที่โรคได้เร่งระบาดเพิ่มขึ้น[118] เพราะจีนควบคุมการระบาดทั่วของโควิดได้ ผู้พัฒนาวัคซีนจีนจึงต้องร่วมมือกับนานาชาติเพื่อทำงานศึกษาในมนุษย์ระยะปลาย ซึ่งเป็นการแข่งขันหาอาสาสมัครสู้กับผู้ผลิตอื่น ๆ และกับโปรแกรม Solidarity trial ที่องค์การอนามัยโลกเป็นผู้จัด[118] นอกจากปัญหาการแข่งขันหาอาสาสมัครแล้ว ผู้จัดทำการทดลองอาจเจอกับคนที่ไม่ต้องการได้วัคซีนเพราะเหตุผลเกี่ยวกับความปลอดภัยและประสิทธิศักย์ที่ค้านกับความเห็นพ้องของนักวิทยาศาสตร์[680] หรือไม่เชื่อในวิทยาศาสตร์ที่ใช้เพื่อสร้างเทคโนโลยีวัคซีนและสมรรถภาพการป้องกันการติดเชื้อของวัคซีน[687] การมีบุคลากรที่ชำนาญในการให้วัคซีนไม่พออาจเป็นอุปสรรคต่อการทดลองทางคลินิกที่ต้องแก้ปัญหาต่าง ๆ เช่น การรับสมัครอาสาสมัครในเขตชนบทที่มีความหนาแน่นประชากรน้อย อาสาสมัครที่มีอายุ เชื้อชาติ และปัญหาทางสุขภาพต่าง ๆ[118][688] ค่าใช้จ่ายวัคซีนต้านโควิดที่มีประสิทธิผลอาจลดความเสียหายทางเศรษฐกิจของโลกเป็นล้านล้านดอลลาร์สหรัฐ และดังนั้น ค่าใช้จ่ายเป็นพัน ๆ ล้านดอลลาร์สหรัฐสำหรับวัคซีนเมื่อเทียบกันแล้วก็เล็กน้อย[689] ในตอนต้น ๆ ของเหตุการณ์ระบาดทั่ว ยังไม่ชัดเจนว่าจะสามารถสร้างวัคซีนสำหรับไวรัสนี้ได้อย่างปลอดภัย เชื่อถือได้ และมีราคาที่พอซื้อไหว และก็ยังไม่รู้ด้วยว่าจะมีค่าใช้จ่ายเพื่อพัฒนาวัคซีนเท่าไร[29][32][56] เป็นไปได้ว่าการลงทุนเป็นเป็นพัน ๆ ล้านดอลลาร์สหรัฐนั้นอาจไม่ได้ผลอะไร[55] หลังจากสร้างวัคซีนได้แล้ว จะต้องผลิตวัคซีนเป็นพัน ๆ ล้านโดสแล้วแจกจ่ายทั่วโลก ในเดือนเมษายน 2020 มูลนิธิบิลและเมลินดาเกตส์ประเมินว่า การผลิตและการแจกจำหน่ายวัคซีนอาจมีค่าใช้จ่ายถึง 25,000 ล้านดอลลาร์สหรัฐ (ประมาณแปดแสนล้านบาท)[690] คณะกรรมาธิการยุโรปจัดให้มีการประชุมทางวิดีโอของผู้นำโลกในวันที่ 4 พฤษภาคม 2020 ซึ่งได้สัญญาว่าจะให้เงิน 8,000 ล้านดอลลาร์สหรัฐเพื่อพัฒนาวัคซีนไวรัสโคโรนา (เป็นงานเดียวกับขององค์การอนามัยโลก)[691] จนถึงเดือนพฤศจิกายน 2020 บริษัทที่ได้เงินทุนจากโปรแกรมปฏิบัติการความเร็วเหนือแสงของสหรัฐได้ตั้งราคาวัคซีนเบื้องต้นประมาณ 19.5–25 ดอลลาร์สหรัฐ (ประมาณ 610–780 บาท) ต่อโดส (คนหนึ่งปกติต้องใช้ 2 โดส) ซึ่งเป็นราคาประมาณเท่า ๆ กับวัคซีนไข้หวัดใหญ่[692] ในเดือนธันวาคม 2020 นักการเมืองเบลเยียมผู้หนึ่งได้เปิดเผยราคาที่สหภาพยุโรปตกลงซื้อวัคซีนจากบริษัทต่าง ๆ[693]
การแจกจำหน่ายวัคซีนต่าง ๆ ต้องขนส่งและจัดการต่าง ๆ กัน ตัวอย่างเช่น วัคซีน tozinameran ของบริษัทไฟเซอร์-ไบออนเทคต้องส่งในตู้แช่แข็งพิเศษโดยมีอุณหภูมิระหว่าง −80 ถึง −60 องศาเซลเซียส[695] ต้องใช้ใน 5 วันหลังละลาย[695] ต้องสั่งอย่างน้อย 975 โดส จึงคงมีแต่ รพ. ใหญ่ ๆ ซึ่งมีเครื่องไม้เครื่องมือดีที่สามารถให้วัคซีนนี้ได้[696] ส่วนวัคซีนของโมเดอร์นาต้องเก็บแช่แข็งระหว่าง −25 ถึง −15 องศาเซลเซียส[697] แต่เมื่อแช่แข็งแล้ว ก็สามารถเก็บที่อุณหภูมิระหว่าง 2 ถึง 8 องศาเซลเซียสจนถึง 30 วัน[697] การไร้ข้อมูลที่เปิดเผยและความไม่เชื่อใจสหรัฐอาหรับเอมิเรตส์ได้ประกาศให้อนุมัติวัคซีนของจีนคือ BBIBP-CorV แต่ก็ไม่ได้ประกอบด้วยข้อมูลและรายละเอียดสำคัญต่าง ๆ[698] ไม่เหมือนกับวัคซีนที่พัฒนาในประเทศตะวันตกบางประเทศ วัคซีนจีนมีข้อมูลเกี่ยวกับความปลอดภัยและประสิทธิศักย์น้อย แม้สหรัฐอาหรับเอมิเรตส์จะระบุว่า ได้พิจารณางานวิเคราะห์ในระหว่างของบริษัท แต่ก็ไม่ชัดเจนว่า ได้วิเคราะห์ข้อมูลดิบเองอย่างเป็นอิสระ และก็ไม่ชัดเจนว่า บริษัทได้สรุปข้อมูลอย่างไร เพราะสหรัฐอาหรับเอมิเรตส์ไม่ได้ระบุรายละเอียดการวิเคราะห์ที่สำคัญ เช่น จำนวนคนติดเชื้อและอายุของอาสาสมัคร[698] นักวิทยาการระบาดชาวจีนที่มหาวิทยาลัยออกซฟอร์ดกล่าวว่า "ยากที่จะรู้ว่าวัคซีนได้ผลดีขนาดไหน ผมหวังว่ามันคงเป็นจริง"[699] การไม่ทำข้อมูลให้เป็นสาธารณะอาจจำกัดบริษัทจากการแจกจำหน่ายวัคซีนไปยังประเทศบางประเทศ เพราะไม่มั่นใจในความปลอดภัยและประสิทธิศักย์ของวัคซีน นักวิทยาการคนเดียวกันระบุว่า การโน้มน้าวให้ประเทศอื่น ๆ คล้อยตามจะต้องมีหลักฐานทางวิทยาศาสตร์ที่แน่นและข้อมูลที่ดีซึ่งสามารถให้ตรวจดูได้ ส่วนนักวิทยาไวรัสที่มหาวิทยาลัยฮ่องกงอีกคนหนึ่งเป็นห่วงว่า ประเทศต่าง ๆ อาจต้องเลือกยอมรับวัคซีนโดยไม่มีการวิเคราะห์ที่เป็นอิสระ หรือเลือกไม่ใช้วัคซีนนี้เลย[699] วัคซีนจีนอีกอย่างคือ CoronaVac ก็มีปัญหาเช่นเดียวกัน ในวันที่ 14 ธันวาคม 2020 สำนักงานควบคุมสาธารณสุขบราซิล (Anvisa) ระบุว่า การให้อนุมัติเพื่อใช้ในประเทศจีนไม่ใช่เรื่องเปิดเผย คือไม่มีข้อมูลว่าใช้กฎเกณฑ์อะไรในการอนุมัติให้ใช้เป็นการฉุกเฉินในประเทศจีนเมื่อเดือนมิถุนายน 2020[700] ปัญหาของการศึกษาแบบ "ท้าทาย" ที่เสนอเพราะโรคโควิดที่กำลังระบาดทั่วเป็นเรื่องฉุกเฉินทั่วโลก จึงต้องพิจารณายุทธการย่อเวลาเพื่ออนุมัติให้ใช้วัคซีนป้องกันโควิด โดยเฉพาะการย่อเวลาของการทดลองทางคลินิกระยะ 2-3 ที่ปกติยาวเป็นปี ๆ[701][702][703] งานศึกษาแบบ "ท้าทาย" เป็นการทดลองวัคซีนโดยจงใจทำให้อาสาสมัครติดเชื้อ เป็นวิธีที่เคยทำกับโรคที่เสี่ยงตายน้อยกว่าโควิด เช่น ไข้หวัดใหญ่ทั่วไป ไข้รากสาดน้อย อหิวาตกโรค และมาลาเรีย[702] คือเมื่อได้ตรวจสอบความปลอดภัยและประสิทธิผลของวัคซีนแคนดิเดตในสัตว์ทดลองและมนุษย์ที่สุขภาพปกติแล้ว อาจต้องท้าทาย (challenge) จงใจให้อาสาสมัครติดเชื้อโควิด โดยมีกลุ่มควบคุมและข้ามงานทดลองระยะ 3 ซึ่งปกติต้องทำ เพื่อช่วยเร่งให้อนุมัติใช้วัคซีนเพื่อป้องกันโรคได้อย่างกว้างขวาง[701][704][702] เริ่มตั้งแต่เดือนมกราคม 2021 อาสาสมัครผู้ใหญ่หนุ่มสาวเป็นโหล ๆ จะจงใจทำให้ติดเชื้อโควิดในการทดลองแบบท้าทายใน รพ. ในกรุงลอนดอนซึ่งบริหารโดยหน่วยบริหารวัคซีนโควิดเฉพาะกิจของรัฐบาลอังกฤษ[705] โดยหลังจากกำหนดขนาดไวรัสที่ทำให้ติดเชื้อได้ ก็จะตรวจสอบประสิทธิภาพป้องกันการติดเชื้อของวัคซีนแคนดิเดตสำหรับโควิด 2 อย่างหรือมากกว่านั้น[705] งานศึกษาแบบท้าทายมีสองขั้นตอน ขั้นแรกตรวจสอบวัคซีนแคนดิเดตว่าปลอดภัยหรือไม่และมีผลต่อภูมิต้านทานอย่างไรทั้งในสัตว์ทดลองและผู้ใหญ่อาสาสมัครสุขภาพดี (100 คนหรือน้อยกว่านั้น) โดยทำพร้อม ๆ กันซึ่งปกติจะทำเป็นลำดับต่อกันเริ่มจากสัตว์ก่อน เมื่อขั้นแรกได้ผลดี ขั้นสองเป็นการทดลองขนาดใหญ่ระยะ 2–3 และให้วัคซีนขนาดที่ได้ผลแก่อาสาสมัครผู้ไม่ได้ติดโรคมาก่อน มีความเสี่ยงน้อย (เช่น ผู้มีอายุน้อย) โดยจงใจทำให้ติดเชื้อไวรัสโควิดเพื่อเปรียบเทียบกับกลุ่มควบคุมที่ให้ยาหลอก[701][702][704] หลังจาก "ท้าทาย" ให้ติดโรคเช่นนี้ ก็จะเฝ้าตรวจอาสาสมัครอย่างใกล้ชิดในคลินิกที่มีอุปกรณ์วัสดุพร้อมมือและสามารถช่วยชีวิตได้ถ้าจำเป็น[701][702] การอาสาเป็นผู้ร่วมงานศึกษาแบบท้าทายในช่วงเกิดโรคระบาดทั่วเช่นนี้ คล้ายกับการเข้าปฏิบัติการในเหตุการณ์ฉุกเฉินของแพทย์พยาบาลเพื่อรักษาคนไข้โรคโควิด หรือของเจ้าหน้าที่ดับเพลิง หรือของผู้บริจาคอวัยวะ[701] แม้งานศึกษาเช่นนี้จะน่าสงสัยทางจริยธรรมเพราะอันตรายที่อาจเกิดขึ้นต่ออาสาสมัครเหตุโรครุนแรงขึ้นอาศัยวัคซีน เพราะไม่ชัดเจนว่าวัคซีนปลอดภัยในระยะยาวหรือไม่ หรือเพราะประเด็นปัญหาอื่น ๆ แต่ตามผู้เชี่ยวชาญในเรื่องโรคติดต่อบางท่าน[701][702][704] งานศึกษาเช่นนี้ก็อาจเลี่ยงไม่ได้เพื่อให้สามารถผลิตวัคซีนที่มีผลได้อย่างรวดเร็วและช่วยลดจำนวนคนตายเหตุโควิดที่กะว่าอาจตกเป็นล้าน ๆ คนทั่วโลก[701][706] ในวันที่ 6 พฤษภาคม 2020 องค์การอนามัยโลกได้พัฒนาแนวปฏิบัติที่แสดงกฎเกณฑ์การศึกษาโควิดแบบท้าทายในอาสาสมัครสุขภาพดี รวมวิธีการประเมินทางวิทยาศาสตร์และทางจริยธรรม การปรึกษาหารือและการประสานงานกับประชาชน การเลือกและการขอคำยินยอมของอาสาสมัคร และการดูแลสอดส่องโดยผู้เชี่ยวชาญอิสระ[707] การอนุญาตให้ใช้เป็นการฉุกเฉิน (EUA)เมื่อโควิดได้เริ่มระบาดทั่วเมื่อต้นปี 2020 องค์การอนามัยโลกได้เผยแพร่แนวทางการจดบัญชีรายการยาให้ใช้เป็นการฉุกเฉิน (Emergency Use Listing) สำหรับวัคซีนใหม่ ๆ เป็นกระบวนการที่ได้มาจากการระบาดทั่วของอีโบลาระหว่างปี 2013-2016[708] ซึ่งบังคับว่า วัคซีนแคนดิเดตที่พัฒนาเพื่อการฉุกเฉินอันเป็นอันตรายถึงชีวิตต้องผ่านมาตรฐาน GMP และต้องผ่านการพัฒนาตามกระบวนการให้อนุญาตก่อน (prequalification) ขององค์การ[708] แม้เมื่อมีวัคซีนใหม่ ๆ ที่พัฒนาขึ้นในระหว่างการระบาดทั่วของโควิด การให้อนุญาตก็ยังบังคับให้ส่งเอกสารแบบเต็มในเรื่องการพัฒนาและคุณภาพการผลิต เทียบกับสหภาพยุโรป ที่บริษัทสามารถใช้กระบวนการพิจารณาอย่างต่อเนื่อง (rolling review) คือให้ข้อมูลตามเท่าที่ได้ในการทดลองระยะที่ 3 แทนที่จะส่งข้อมูลเต็มซึ่งต้องทำเป็นเดือน ๆ หรือปี ๆ หลังการทดลองในกระบวนการปกติ กระบวนการเช่นนี้ทำให้คณะกรรมการเวชภัณฑ์สำหรับใช้ในมนุษย์ยุโรป (CHMP) สามารถประเมินข้อมูลในเวลาจริง ซึ่งช่วยให้วัคซีนแคนดิเดตอันมีอนาคตสามารถได้อนุมัติอย่างรวดเร็วจากสำนักงานการแพทย์ยุโรป (EMA)[709] ในเดือนตุลาคม กระทรวงสาธารณสุขแคนาดาและสำนักงานการแพทย์ยุโรปได้เริ่มการพิจารณาอย่างต่อเนื่องสำหรับวัคซีนของบริษัทโมเดอร์นา[710] และในแคนาดาเดือนพฤศจิกายน สำหรับวัคซีนของบริษัทไฟเซอร์-ไบออนเทค[711] วันที่ 24 มิถุนายน 2020 ประเทศจีนได้อนุมัติวัคซีนของบริษัทแคนซิโนไบโอลอจิกส์เพื่อให้ใช้อย่างจำกัดในทหาร และอนุมัติวัคซีนแบบไวรัสโควิดฆ่าแล้วสองอย่างเพื่อใช้ในการฉุกเฉินสำหรับผู้ประกอบอาชีพความเสี่ยงสูง[712] ในวันที่ 11 สิงหาคม 2020 รัสเซียประกาศการอนุมัติวัคซีนสปุตนิก วี เพื่อใช้ในการฉุกเฉิน แต่เดือนหนึ่งต่อจากนั้น ก็ยังมีวัคซีนเพียงจำนวนน้อยที่แจกจำหน่ายนอกการทดลองทางคลินิกระยะที่ 3[713] ในเดือนกันยายน สหรัฐอาหรับเอมิเรตส์อนุมัติวัคซีนของบริษัทซิโนฟาร์มเป็นการฉุกเฉินสำหรับบุคลากรทางแพทย์[714] โดยบาห์เรนก็ทำเช่นเดียวกันในเดือนพฤศจิกายนต่อมา[715] ในสหรัฐ องค์การอาหารและยาอาจให้อนุมัติเป็นการฉุกเฉินแก่วัคซีนโควิดก่อนจะได้หลักฐานเต็มจากการทดลองระยะที่ 3 ในเรื่องความปลอดภัยและประสิทธิศักย์ แต่ก็ถูกวิจารณ์ว่าใช้อย่างผิด ๆ เพราะเหตุทางการเมือง เป็นการลดมาตรฐาน และเพิ่มความรู้สึกต่อต้านวัคซีนของประชาชนในช่วงปี 2020[681][716][717] ในวันที่ 8 กันยายน 2020 บริษัทยาแนวหน้า 9 บริษัทที่วิจัยวัคซีนโควิดจึงได้ร่วมให้สัญญาว่า จะยื่นคำขอใช้เป็นการฉุกเฉินก็ต่อเมื่อการทดลองระยะที่ 3 ได้ระบุวัคซีนว่าปลอดภัยและมีประสิทธิศักย์แล้ว[718] วันที่ 20 พฤศจิกายน 2020 บริษัทไฟเซอร์-ไบออนเทคได้ยื่นคำขอใช้วัคซีนของบริษัทเป็นการฉุกเฉินแก่องค์การอาหารและยาสหรัฐ[719][720] โดยองค์การก็ประกาศว่า คณะกรรมการที่ปรึกษาเรื่องวัคซีนและผลิตภัณฑ์ชีวภาพที่เกี่ยวข้อง (VRBPAC) ขององค์การจะพิจารณาคำขอนี้ในวันที่ 10 ธันวาคม[721][722] ในเดือนพฤศจิกายน องค์การได้อธิบายว่า การอนุญาตให้ใช้เป็นการฉุกเฉินก็คือ "กลไกที่อำนวยการทำให้มีและการใช้วิธีแก้ปัญหาทางแพทย์รวมทั้งวัคซีน ในช่วงความฉุกเฉินทางสาธารณสุข เช่น การระบาดทั่วของโควิด-19 ในปัจจุบัน"[723] เมื่อองค์การอนุมัติให้ใช้เป็นการฉุกเฉินแล้ว ผู้พัฒนาวัคซีนก็ยังต้องดำเนินการทดลองระยะที่ 3 ต่อไปเพื่อบูรณาการข้อมูลความปลอดภัยและประสิทธิศักย์ของวัคซีน โดยในที่สุดก็จะยื่นคำขออนุมัติแบบเต็ม[723] ในวันที่ 30 พฤศจิกายน 2020 บริษัทโมเดอร์นาได้ยื่นคำขอใช้วัคซีนเป็นการฉุกเฉินแก่องค์การอาหารและยาสหรัฐ[724][725] บาห์เรนในเดือนพฤศจิกายนและธันวาคม 2020 องค์การควบคุมทางสุขภาพแห่งชาติบาห์เรน (National Health Regulatory Authority, NHRA) ได้อนุญาตให้ใช้วัคซีน BBIBP-CorV ของบริษัทซิโนฟาร์ม และวัคซีน tozinameran ของบริษัทไฟเซอร์-ไบออนเทคเป็นการฉุกเฉิน[94] แคนาดาในวันที่ 9 ธันวาคม 2020 กระทรวงสาธารณสุขแคนาดา (Health Canada) ได้อนุญาตให้นำเข้าวัคซีนของบริษัทไฟเซอร์-ไบออนเทคเพื่อใช้ในการฉุกเฉินอย่างชั่วคราว[96] มีวัคซีน 30,000 โดสส่งมาถึงแคนาดาในวันที่ 13 ธันวาคม โดยกะว่าจะได้ 249,000 โดสไม่เกินปลายปี 2020 และ 6 ล้านโดสก่อนเดือนเมษายน 2021[726] เม็กซิโกในวันที่ 11 ธันวาคม 2020 คณะกรรมการกลางป้องกันความเสี่ยงทางอนามัย (Federal Commission for the Protection against Sanitary Risk, COFEPRIS) ของเม็กซิโกได้อนุญาตให้ใช้วัคซีนของบริษัทไฟเซอร์-ไบออนเทคเป็นการฉุกเฉิน วัคซีนได้สั่งแล้ว 34.4 ล้านโดสโดยเริ่มส่งตั้งแต่กลางเดือนธันวาคม[99] ฟิลิปปินส์ในวันที่ 2 ธันวาคม 2020 ประธานาธิบดีฟิลิปปินส์โรดรีโก ดูแตร์เต ได้สั่งองค์กรอาหารและยาฟิลิปปินส์ให้ให้อนุญาตใช้วัคซีนและการรักษาโควิดอื่น ๆ เป็นการฉุกเฉิน[727] โดยมีข้อแม้อย่างหนึ่งว่า ผู้ผลิตวัคซีนต้องได้อนุญาตให้ใช้เป็นการฉุกเฉินในประเทศต้นกำเนิดหรือประเทศอื่น ๆ ที่มีการควบคุมดี องค์การก็ได้ประกาศว่าผู้ผลิตวัคซีน 3 รายคือไฟเซอร์ แอสตร้าเซนเนก้า และซิโนแว็กก็ได้สอบถามเรื่องกระบวนการขออนุญาตให้ใช้เป็นการฉุกเฉินในประเทศ[728] สหราชอาณาจักรในวันที่ 2 ธันวาคม 2020 สำนักงานควบคุมผลิตภัณฑ์ยาและสุขภาพ (Medicines and Healthcare products Regulatory Agency, MHRA) แห่งสหราชอาณาจักรได้อนุมัติให้ใช้วัคซีนของบริษัทไฟเซอร์-ไบออนเทค คือ Tozinameran (BNT162b2) เป็นการฉุกเฉิน เป็นประเทศแรกที่อนุมัติวัคซีนนี้ และประเทศตะวันตกแรกที่ให้อนุมัติเป็นการฉุกเฉินแก่วัคซีนโควิด[93][729][730] สหรัฐในวันที่ 11 ธันวาคม 2020 องค์กรอาหารและยาสหรัฐได้อนุญาตให้ใช้วัคซีนของบริษัทไฟเซอร์-ไบออนเทคเป็นการฉุกเฉิน[112] การให้อนุญาตวัคซีนจะได้อนุญาตตามความสำเร็จของการทดลองทางคลินิกระยะ 1–3 ที่ได้แสดงความปลอดภัย, การสร้างภูมิคุ้มกันโรคเมื่อใช้ขนาดยาโดยเฉพาะ, ประสิทธิภาพป้องกันการติดเชื้อในกลุ่มประชากรเป้าหมาย และประสิทธิภาพการป้องกันที่คงยืน[731] คณะผู้เชี่ยวชาญการวางมาตรฐานทางชีวภาพขององค์การอนามัยโลกได้สร้างแนวปฏิบัตินานาชาติเพื่อผลิตและควบคุมคุณภาพของวัคซีน เป็นกระบวนการหมายให้องค์กรควบคุมของรัฐต่าง ๆ ใช้ในการให้อนุญาตวัคซีนของตนเอง[731] ปกติผู้ผลิตจะไม่ได้รับอนุญาตจนกว่าวัคซีนจะได้พิสูจน์ว่าปลอดภัยและมีประสิทธิภาพในระยะยาว องค์กรควบคุมนานาชาติหรือของรัฐ เช่น สำนักงานการแพทย์ยุโรป (European Medicines Agency, EMA) หรือองค์กรอาหารและยาสหรัฐ (Food and Drug Administration, FDA) จะเป็นผู้ตรวจพิจารณาข้อมูลทางวิทยาศาสตร์ของวัคซีน[732][733] การสร้างความมั่นใจและการยอมรับวัคซีนที่ได้อนุมัติแก่สาธารณชนเป็นหน้าที่การสื่อสารของรัฐและบุคลากรทางแพทย์เพื่อให้โปรแกรมการฉีดวัคซีนดำเนินไปได้ด้วยดี, เพื่อช่วยชีวิตคน และช่วยคืนสภาพทางเศรษฐกิจ[734] ในเบื้องต้น วัคซีนจะมีจำนวนจำกัดเพราะเหตุผลทางการผลิต, การแจกจำหน่าย และโลจิสติกส์ จึงต้องมีแผนการจัดสรรวัคซีนจำนวนจำกัดที่มี และจัดลำดับกลุ่มประชากรที่ควรได้วัคซีนแรก ๆ[734] องค์การอนามัยโลกวัคซีนที่พัฒนาเพื่อแจกจำหน่ายข้ามชาติผ่านกองทุนเพื่อเด็กแห่งสหประชาชาติต้องได้การอนุญาตก่อน (pre-qualification) ขององค์การอนามัยโลกเพื่อให้ได้มาตรฐานสากลในด้านคุณภาพ ความปลอดภัย การสร้างภูมิคุ้มกัน และประสิทธิศักย์ จึงจะนำไปใช้ในประเทศต่าง ๆ มากมายได้[731] ผลิตภัณฑ์ต้องผลิตได้อย่างสม่ำเสมอโดยผ่านมาตรฐาน GMP[731] เมื่อองค์กรของสหประชาชาติมีส่วนร่วมในการให้อนุญาตวัคซีน ประเทศแต่ละประเทศจะร่วมมือโดย 1) ให้อนุญาตวัคซีน ให้อนุญาตการวางขาย สำหรับผู้ผลิตและหุ้นส่วนในการแจกจำหน่าย 2) สอดส่องผลของยาหลังจากวางตลาด (postmarketing surveillance) รวมทั้งบันทึกผลที่ไม่พึงประสงค์หลังการให้วัคซีน องค์การอนามัยโลกทำงานร่วมกับองค์กรของรัฐเพื่อตรวจโรงงานผลิตและผู้จำหน่ายว่าผ่านมาตรฐาน GMP และกฎควบคุมต่าง ๆ หรือไม่[731] ประเทศบางประเทศอาจเลือกซื้อวัคซีนที่ได้รับอนุญาตจากองค์กรควบคุมของประเทศอื่น ๆ ที่น่าเชื่อถือเช่น สำนักงานการแพทย์ยุโรป (EMA) หรือองค์การอาหารและยาสหรัฐ แต่ราคาก็อาจจะแพงกว่า และวิธีการแจกจำหน่ายก็อาจใช้ในประเทศกำลังพัฒนานั้น ๆ ไม่ได้[731] ออสเตรเลียในเดือนตุลาคม 2020 องค์กรสินค้าเพื่อการรักษา (Therapeutic Goods Administration, TGA) ของออสเตรเลียได้ให้อนุญาตชั่วคราวแก่วัคซีนโควิดคือ ChAdOx1 nCoV-19 ของบริษัทแอสตร้าเซนเนก้า และวัคซีน Tozinameran (BNT162b2) ของบริษัทไฟเซอร์[735][736] สหภาพยุโรปในสหภาพยุโรป วัคซีนสำหรับโรคระบาดทั่ว เช่น ไข้หวัดใหญ่ จะได้อนุญาตแบบต่าง ๆ รวมทั้ง อนุญาตทั่วไป (centralized) คือรัฐสมาชิกทั้งหมดปฏิบัติตาม หรืออนุญาตในบางประเทศ (decentralized) หรืออนุญาตในประเทศ ๆ เดียว[732] โดยทั่วไปแล้ว รัฐสมาชิกจะอนุโลมตามแนวทางการควบคุมและโปรแกรมทางคลินิกที่กำหนดโดยคณะกรรมการเวชภัณฑ์สำหรับใช้ในมนุษย์ (Committee for Medicinal Products for Human Use, CHMP) ของยุโรป ซึ่งเป็นคณะกรรมการทางวิทยาศาสตร์ของสำนักงานการแพทย์ยุโรป (EMA) ซึ่งมีหน้าที่ให้อนุญาตวัคซีน[732] กลุ่มผู้เชี่ยวชาญหลายกลุ่มที่ประเมินและสอดส่องความก้าวหน้าของวัคซีนทั้งก่อนและหลังการให้อนุญาตและการแจกจำหน่ายทำหน้าที่สนับสนุนคณะกรรมการนี้[732] ในเดือนตุลาคม 2020 CHMP ได้เริ่มทำการพิจารณาอย่างต่อเนื่อง (rolling reviews) สำหรับวัคซีน ChAdOx1 nCoV-19 ของบริษัทแอสตร้าเซนเนก้า และ Tozinameran (BNT162b2) ของบริษัทไฟเซอร์[737][738][739] ในเดือนพฤศจิกายน 2020 CHMP ได้เริ่มการพิจารณาอย่างต่อเนื่องสำหรับวัคซีนโควิดของบริษัทโมเดอร์นาคือ mRNA-1273[740] ในเดือนธันวาคม 2020 EMA ได้รับคำขออนุญาตวางตลาดแบบมีเงื่อนไข (conditional marketing authorization) แก่วัคซีนแบบ modRNA คือ Tozinameran และ mRNA-1273[741][742] การประเมินวัคซีนจะทำอย่างเร่งด่วนโดยอาจลงความเห็นภายในไม่กี่อาทิตย์[741][742] ในเดือนธันวาคม 2020 CHMP ได้เริ่มการพิจารณาอย่างต่อเนื่องสำหรับวัคซีนโควิด Ad26.COV2.S ของบริษัท Janssen-Cilag International N.V.[743] สหรัฐตามกฎขององค์การอาหารและยาสหรัฐ การแสดงหลักฐานว่าวัคซีนปลอดภัยและมีประสิทธิศักย์ทางคลินิกจะเหมือนกับกระบวนการอนุมัติยาที่แพทย์สั่ง[744] ถ้ายาผ่านการทดลองทางคลินิกระยะต่าง ๆ บริษัทก็จะยื่นคำขอที่เรียกว่า Biologics License Application ซึ่งต้องแนบหลักฐานอย่างละเอียดว่าวัคซีนแคนดิเดตแสดงประสิทธิศักย์และความปลอดภัยตลอดระยะการพัฒนา เพื่อการพิจารณาทางวิทยาศาสตร์โดยคณะผู้เชี่ยวชาญสาขาต่าง ๆ รวมทั้งแพทย์ นักสถิติ นักจุลชีววิทยา และนักเคมี หลังจากนี้ ผู้เชี่ยวชาญก็จะตรวจโรงงานผลิตว่า ได้มาตรฐาน GMP หรือไม่ โดยฉลากยาต้องมีข้อมูลสำหรับแพทย์พยาบาลเกี่ยวกับการใช้ยาและความเสี่ยง เพื่อให้สามารถสื่อสารและให้ยากับสาธารณชนได้[744] คณะกรรมการที่ปรึกษาเรื่องแนวปฏิบัติเพื่อสร้างภูมิคุมกัน (Advisory Committee on Immunization Practices) ของศูนย์ป้องกันและควบคุมโรคสหรัฐได้ลงมติในวันที่ 2 ธันวาคมว่า วัคซีนที่ได้แรก ๆ ควรจัดให้กับแพทย์พยาบาลและผู้ดูแลรักษาผู้ป่วยในสถานพยาบาลระยะยาวก่อน โดยระบุด้วยว่าเมื่อการผลิตเพิ่มขึ้นแล้วกลุ่มที่ได้ต่อ ๆ มาควรเป็นคนชรา ผู้ทำการฉุกเฉิน (รวมตำรวจ นักผจญเพลิง) ครู และผู้ทำการจำเป็นที่ไม่สามารถเว้นระยะห่างทางสังคมได้ดี และบุคคลที่มีโรคร่วมหลายโรค อย่างไรก็ตาม รัฐต่าง ๆ ในสหรัฐจะเป็นผู้ตัดสินว่าจะจัดสรร แจกจำหน่าย จัดการโลจิสติกส์อย่างไร เพื่อให้วัคซีนแก่ทุก ๆ คนเมื่อมีวัคซีน[745] หลังจากให้อนุญาต การสอดส่องวัคซีนและการผลิตรวมทั้งการตรวจเป็นระยะ ๆ ว่ายังได้มาตรฐาน GMP หรือไม่ ก็จะทำต่อไปตราบเท่าที่ผู้ผลิตยังได้อนุญาตอยู่ โดยผู้ผลิตอาจต้องยื่นเอกสารเพิ่มเกี่ยวกับขั้นตอนการผลิตแต่ละขั้น ๆ ว่ายังสามารถคงฤทธิ์ ความปลอดภัย และความบริสุทธิ์ของวัคซีนได้หรือไม่[744] การสอดส่องผลของยาหลังจากวางตลาดจนกว่าจะได้ใช้วัคซีนในกลุ่มประชากรทั่วไป ก็ยังอาจไม่รู้ผลไม่พึงประสงค์ทั้งหมดของวัคซีน จึงทำให้ผู้ผลิตต้องสอดส่องผลของยาหลังจากวางตลาด (postmarketing surveillance) หรือบางครั้งเรียกว่า การทดลองทางคลินิกระยะที่ 4 ของวัคซีนเมื่อกำลังให้แก่สาธารณชนทั่วไป[731][744] องค์การอนามัยโลกทำงานร่วมกับรัฐสมาชิกเพื่อสอดส่องผลของยาหลังจากวางตลาด[731] ส่วนองค์การอาหารและยาสหรัฐมีโปรแกรม Vaccine Adverse Event Reporting System ที่สอดส่องปัญหาความปลอดภัยของวัคซีนเมื่อกำลังให้แก่สาธารณชน[744] การวางตลาดและการเข้าถึงอย่างเท่าเทียมกันปัญหาการวางตลาดจนถึงเดือนมิถุนายน 2020 บริษัท รัฐบาล องค์กรสาธารณสุขนานาชาติ และกลุ่มวิจัยในมหาวิทยาลัยได้ลงทุนเป็นหมื่น ๆ ล้านดอลลาร์สหรัฐเพื่อพัฒนาวัคซีนแคนดิเดตเป็นสิบ ๆ อย่าง และเตรียมตัวตั้งโปรแกรมให้วัคซีนเพือสร้างภูมิคุ้มกันต้านการติดเชื้อโควิด-19[32][746][747][748] การลงทุนของบริษัทและความจำเป็นต้องสร้างคุณค่าให้แก่ผู้ถือหุ้นก่อความกังวลในเรื่องการพัฒนาวัคซีนที่ใช้ "วิธีการทางตลาด" ว่าวัคซีนที่ได้อนุมัติจะมีราคาแพง ว่าประเทศร่ำรวยจะได้วัคซีนก่อน และว่าเขตที่โรคระบาดแย่สุดจะไม่ได้วัคซีนหรือได้น้อย ซึ่งพยากรณ์ว่าจะเกิดในประเทศยากจน มีประชากรหนาแน่น ที่ไม่สามารถซื้อวัคซีนได้[32][56][747] การร่วมมือกันระหว่างมหาวิทยาลัยออกซฟอร์ดกับแอสตร้าเซนเนก้า (เป็นบริษัทยายักษ์ใหญ่ในประเทศสหราชอาณาจักรมีรายได้ประมาณแปดแสนล้านบาทในปี 2016[749]) ก่อความกังวลเรื่องราคาวัคซีนและการแชร์ผลกำไรของการขายวัคซีนทั่วโลก เพราะปัญหาว่า รัฐบาลสหราชอาณาจักรและมหาวิทยาลัยซึ่งได้เงินภาษีของประชาชนมีสิทธิขายหรือไม่[748] บริษัทจึงแจ้งว่า ราคาเบื้องต้นของวัคซีนจะไม่รวมกำไรสำหรับบริษัทตราบเท่าที่โรคยังระบาดอยู่[748] ในต้นเดือนมิถุนายน บริษัทตกลงให้เซพีและกาวีผลิตและแจกจำหน่ายวัคซีน 300 ล้านโดสถ้าวัคซีนของออกซฟอร์ดพิสูจน์ว่าปลอดภัยและได้ผลโดยแลกเปลี่ยนกับการลงทุน 750 ล้านดอลลาร์สหรัฐ (ประมาณสองหมื่นสี่พันล้านบาท) โดยเท่ากับเพิ่มสมรรถภาพการผลิตวัคซีนของบริษัทเป็นมากกว่า2,000 ล้านโดสต่อปี[750] การวางตลาดวัคซีนโรคระบาดทั่วเป็นการลงทุนที่เสี่ยงสูง เพราะอาจเสียเงินทุนค่าพัฒนาและการเตรียมตัวผลิตวัคซีนถ้าวัคซีนแคนดิเดตปรากฏว่าไม่ปลอดภัยหรือไม่ได้ผล[32][55][56][746] บริษัทยาข้ามชาติคือไฟเซอร์ระบุว่า ไม่สนใจเป็นหุ้นส่วนกับรัฐ เพราะจะเป็น "มือที่สาม" ที่ทำให้โปรแกรมวัคซีนของบริษัทล่าช้า[751] อนึ่ง ยังมีความกังวลด้วยว่า โปรแกรมเร่งพัฒนา เช่น Operation Warp Speed (ปฏิบัติการความเร็วเหนือแสง) ของสหรัฐ กำลังเลือกวัคซีนแคนดิเดตเพราะความได้เปรียบทางการผลิตเพื่อย่นระยะเวลาการพัฒนา ไม่ได้เลือกเทคโนโลยีวัคซีนที่ปลอดภัยและมีประสิทธิศักย์สูงสุด[751] อำนาจอธิปไตยการเลือกแจกจำหน่ายวัคซีนให้แก่ประเทศไม่กี่ประเทศ ซึ่งคนตะวันตกเรียกว่า "vaccine sovereignty" (อธิปไตยวัคซีน) เป็นข้อวิจารณ์ข้อหนึ่งของหุ้นส่วนการพัฒนาวัคซีน[747][752] เช่นหุ้นส่วนระหว่างมหาวิทยาลัยออกซฟอร์ดกับแอสตร้าเซนเนก้า ว่าจะเลือกแจกจำหน่ายวัคซีนภายในสหราชอาณาจักรและต่อ "ผู้ให้ราคาสูงสุด" คือสหรัฐ ผู้ได้จ่ายเงินล่วงหน้า 1,200 ล้านดอลลาร์สหรัฐ (ประมาณสามหมื่นแปดพันล้านบาท) เพื่อคนอเมริกัน แม้ก่อนที่วัคซีนของออกซฟอร์ดหรือของซาโนฟี่จะได้พิสูจน์ว่าปลอดภัยและได้ผล[748][753][754] มีความกังวลว่า ประเทศบางประเทศที่ผลิตวัคซีนอาจจำกัดการส่งออกเพื่อตุนวัคซีนโควิดสำหรับประชาชนของตนก่อน[752] ในเดือนพฤษภาคม รัฐบาลจีนได้ให้คำมั่นสัญญาว่า วัคซีนจีนที่สำเร็จจะเป็น "สินค้าสาธารณะของโลก" (global, public good) คือบอกเป็นนัยว่า จะผลิตวัคซีนให้พอแจกจำหน่ายทั้งในประเทศและนอกประเทศ[755] อนึ่ง ไม่เหมือนกับวัคซีนเอ็มอาร์เอ็นเอ ซึ่งต้องเก็บไว้ในอุณหภูมิต่ำมาก วัคซีนอันเป็นไวรัสฆ่าแล้วของซิโนแว็กและซิโนฟาร์มต้องเก็บไว้ในเพียงตู้เย็นเก็บยาธรรมดา[756] จึงอาจน่าใช้มากกว่าในประเทศกำลังพัฒนา[757] ในเดือนมิถุนายน สถาบันเซรุ่มแห่งอินเดีย (Serum Institute of India) ซึ่งเป็นผู้ผลิตวัคซีนรายใหญ่ของโลก ได้สิทธิจากบริษัทแอสตร้าเซนเนก้าให้ผลิตวัคซีน 1,000 ล้านโดสสำหรับประเทศมีรายได้น้อยจนถึงปานกลาง[750] โดยครึ่งหนึ่งจะเป็นของอินเดีย[758] ถ้าประเทศออสเตรเลียผลิตวัคซีนด้วย ก็อาจเลือกปฏิบัติเช่นกัน[759] การเข้าถึงได้อย่างเท่าเทียมกันเพราะการพัฒนาและการผลิตวัคซีนแคนดิเดตยังมีผลลัพธ์ที่ไม่ชัดเจน รวมทั้งอัตราความล้มเหลวสูงในช่วงทดสอบในมนุษย์ องค์กรต่าง ๆ รวมทั้งเซพี องค์การอนามัยโลก และองค์กรวัคซีนการกุศล เช่น มูลนิธิบิลและเมลินดาเกตส์และกาวี ได้ระดมทุนเกินกว่า 20,000 ล้านดอลลาร์สหรัฐ ในต้นปี 2020 เพื่อเป็นทุนพัฒนาวัคซีนและเตรียมตัวแจกจำหน่ายให้วัคซีน โดยเฉพาะแก่เด็กในประเทศด้อยพัฒนา[760][46][51][746] เซพีแถลงการณ์ว่า รัฐบาลต่าง ๆ ควรจัดระบบจัดสรรวัคซีนที่ยุติธรรมทั่วโลกสำหรับวัคซีนที่จะได้ โดยประสานงานการผลิต การจัดหาทุนและการซื้อ และประกันว่าไม่ต้องรับผิดชอบต่อผลิตภัณฑ์เพื่อลดความเสี่ยงต่อผู้พัฒนาวัคซีน[36] องค์กรได้ตั้งขึ้นเพื่อเฝ้าตรวจการแจกจำหนายวัคซีนป้องกันโรคติดต่อที่ยุติธรรมไปยังประเทศรายได้น้อยและปานกลาง[752][761] เซพีได้ปรับปรุงนโยบายการเข้าถึงได้อย่างยุติธรรมที่ตีพิมพ์ในเดือนกุมภาพันธ์ ซึ่งอาจใช้กับทุนพัฒนาวัคซีนโควิดขององค์กรด้วย คือ
แต่ผู้ผลิตวัคซีนบางรายก็ต่อต้านข้อเสนอนี้เป็นบางส่วน[747][761] กลุ่มนานาชาติบางกลุ่ม เช่น Centre for Artistic Activism และ Universities Allied for Essential Medicines สนับสนุนให้เข้าถึงวัคซีนโควิดที่อนุมัติได้อย่างยุติธรรม[762][763] นักวิทยาศาสตร์สนับสนุนให้องค์การอนามัยโลก เซพี บริษัท และรัฐบาลร่วมมือกันเพื่อจัดสรรวัคซีนโควิดที่จะได้โดยกำหนดด้วยความเสี่ยงต่อโรค[752][761] โดยเฉพาะการให้วัคซีนก่อนอย่างเร่งด่วนแก่บุคลากรทางแพทย์ กลุ่มประชากรที่อ่อนแอ และเด็ก[32][746][747] ในช่วงปี 2020 องค์การอนามัยโลก กาวี และเซพี ได้รวมกำลังก่อตั้งโคแว็กซ์ ซึ่งเป็นโปรแกรมประสานงานสร้างวัคซีนที่เข้าถึงได้อย่างยุติธรรมทั่วโลก[84][47] นักวิทยาศาสตร์นานาชาติและบุคคลที่เป็นห่วงจำนวนหนึ่ง (รวมทั้งบุคลากรขององค์กรทางศาสนา) ได้ร้องให้ทำวัคซีนโควิดให้เป็นสาธารณสมบัติ ตามตัวอย่างการพัฒนาวัคซีนโปลิโอโดยแพทย์ชาวอเมริกันโจนัส ซอล์กผู้ไม่ได้จดสิทธิบัตร วัคซีนโควิด-19 ที่ได้ผลควรจะได้อนุมัติและผลิตในประเทศต่าง ๆ และศูนย์การผลิตยาทั่วโลก เพื่อให้สามารถแจกจำหน่ายได้อย่างยุติธรรมและมีราคาถูกยิ่งขึ้นในระดับโลก[764] โซ่อุปทานในช่วงปี 2021 และหลังจากนั้น การแจกจำหน่ายวัคซีนโควิดต้องอาศัยการขนส่งและการติดตามวัคซีนถึง 10,000-19,000 ล้านขวด ซึ่งจะเป็นความท้าทายทางโซ่อุปทานอันยิ่งใหญ่ที่สุดในประวัติศาสตร์[29][765][758] จนถึงเดือนกันยายน 2020 ผู้เชี่ยวชาญทางโซ่อุปทานและโลจิสติกส์ก็ยังแสดงความเป็นห่วงว่า เครือข่ายทั้งภายในประเทศและนานาชาติที่มีอยู่แล้วเพื่อแจกจำหน่ายวัคซีนอาจไม่พอรับรองจำนวนหรือความเร่งด่วนของวัคซีนโควิด เพราะสมรรถภาพการขนส่งได้เสื่อมลงเหตุการล็อกดาวน์และการลดจำนวนพนักงานในช่วงปี 2020[765][766][767] เมื่อกล่าวถึงความท้ายทายต่อองค์กรที่ต้องประสานงานกันต่าง ๆ รวมทั้งโปรแกรมโคแว็กซ์ บริษัทยาสากล ผู้รับจ้างผลิตวัคซีน บริษัทขนส่งทั้งในประเทศและนานาชาติ คลังจัดเก็บวัคซีน และองค์กรสาธารณสุขในแต่ละประเทศ ประธานบริหารของกาวีได้ระบุว่า "การส่งวัคซีนเป็นพัน ๆ ล้านโดสไปทั่วโลกอย่างมีประสิทธิภาพจะมีอุปสรรคทางโลจิสติกส์และทางแผนการที่ซับซ้อนอย่างยิ่งตลอดทั้งโซ่อุปทาน"[768] ตัวอย่างที่เน้นความใหญ่โตของปัญหาก็คือ สมาคมการขนส่งทางอากาศนานาชาติ (International Air Transport Association, IATA) ระบุว่า จะต้องมีเครื่องบินขนส่งโบอิง 747 ซึ่งประกอบกับตู้เย็นวัคซีนพิเศษที่รักษาอุณหภูมิอย่างแม่นยำถึง 8,000 ลำเพื่อใช้ส่งยาเพียงโดสหนึ่งไปยังประเทศเกิน 200 ประเทศทั่วโลก[769] โดยกาวีก็ระบุอีกว่า "สำหรับการระบาดทั่วที่แพร่ไปอย่างรวดเร็ว จะไม่มีใครปลอดภัยยกเว้นทุกคนปลอดภัย"[84] เมื่อเทียบกับเทคโนโลยีวัคซีนและงานวิจัยทางคลินิกระยะต้น ๆ ที่ได้เงินทุนเป็นพัน ๆ ล้านดอลลาร์สหรัฐแล้ว โซ่อุปทานที่จำเป็นหลังวัคซีนได้อนุมัติกลับไม่ได้รับความสนใจเท่าในด้านการวางแผน การประสานงาน ความมั่นคงปลอดภัย และการลงทุน[765][766][770] ปัญหาสำคัญอย่างหนึ่งก็คือ ทรัพยากรเพื่อแจกจำหน่ายวัคซีนในประเทศที่มีรายได้ต่ำจนถึงปานกลาง (รวมทั้งประเทศไทย) โดยเฉพาะในการให้วัคซีนแก่เด็ก อาจไม่เพียงพอหรือไม่มีเลย แต่อาจปรับปรุงโดยมีค่าใช้จ่ายน้อยที่สุดได้ถ้าสามารถซื้อและแจกจำหน่ายในระดับภูมิภาคหรือระดับชาติ[84][771] ในเดือนกันยายน โปรแกรมโคแว็กซ์รวมประเทศ 172 ประเทศซึ่งประสานแผนงานเพื่อให้ได้โซ่อุปทานของวัคซีนโควิดที่ดีสุด[772] และกองทุนเพื่อเด็กแห่งสหประชาชาติก็ได้เข้าร่วมกับโคแว็กซ์เพื่อตระเตรียมเงินทุนและโซ่อุปทานเพื่อให้วัคซีนแก่เด็กในประเทศกำลังพัฒนา 92 ประเทศ[773][774] โลจิสติกส์การมีระบบโลจิสติกส์ในการให้วัคซีนจะช่วยให้มีเครื่องไม้เครื่องมือ บุคลากร และวัคซีนที่ได้อนุมัติอย่างข้ามพรมแดน[775] ซึ่งอาจรวมการจัดการและเฝ้าสอดส่องวัคซีน การบริหารการเก็บและขนส่งที่ต้องใช้ตู้เย็น และความปลอดภัยในการแจกจำหน่ายวัคซีนภายในระบบ[776] เป้าของโปรแกรมโคแว็กซ์ก็เพื่อรวมศูนย์และจัดการทรัพยากรทางโลจิสติกส์อย่างยุติธรรมในบรรดาประเทศที่เข้าร่วมด้วย โดยรวมเข้าด้วยกันซึ่งการผลิต การขนส่ง และโครงสร้างพื้นฐานสำหรับโซ่อุปทานโดยทั่วไป[84][770]และมีเครื่องมือในการพยากรณ์วัคซีน การประเมินความต้องการ การบริหารวัคซีนภายในประเทศ การจัดการวัคซีนที่อาจเสีย และการบริหารวัคซีนในคลัง[776] ปัจจัยทางโลจิสติกส์อื่น ๆ ที่จะทำในระดับนานาชาติเมื่อแจกจำหน่ายวัคซีนโควิดอาจรวม[765][777][778]
ตามผู้ผลิตวัคซีนรายหนึ่ง ปัญหาทางโลจิสติกส์ในขั้นใดขั้นหนึ่งอาจสะดุดโซ่อุปทานทั้งโซ่[779] และถ้าโซ่อุปทานของวัคซีนล้มเหลว ความเสียหายทางเศรษฐกิจและทางมนุษยชนเหตุการระบาดทั่วอาจยืดยาวเป็นปี ๆ[767] กำลังการผลิตจนถึงเดือนสิงหาคม 2020 แม้เมื่อมีวัคซีนแคนดิเดตเพียงไม่กี่อย่างที่กำลังทดลองทางคลินิกในระยะที่ 3 โดยยังต้องใช้เวลาอีกหลายเดือนเพื่อกำหนดความปลอดภัยและประสิทธิศักย์ รัฐบาลต่าง ๆ ก็ได้สั่งวัคซีนล่วงหน้ามากกว่า 2,000 ล้านโดสโดยมีค่าใช้จ่ายเกิน 5,000 ล้านดอลลาร์สหรัฐ (ประมาณ 158,000 ล้านบาท)[758][779][780] รัฐบาลอังกฤษได้สั่งวัคซีนสำหรับปี 2021 ล่วงหน้าเป็นจำนวน 5 โดสต่อประชากรหนึ่งคน เป็นจำนวนที่ก่อความท้อใจแก่องค์กรต่าง ๆ เช่น องค์การอนามัยโลกและกาวีซึ่งกำลังโปรโมตการเข้าถึงวัคซีนอย่างยุติธรรมและทั่วถึงกันโดยเฉพาะสำหรับประเทศกำลังพัฒนา[758] ในเดือนกันยายน เซพีให้ทุนสนับสนุนทั้งงานวิจัยพื้นฐานและการทดลองทางคลินิกสำหรับวัคซีนแคนดิเดต 9 อย่าง โดยมีอีก 9 อย่างที่กำลังประเมิน และตกลงจะผลิตวัคซีนที่ได้อนุมัติ 3 อย่างเป็นจำนวน 2,000 ล้านโดสไม่เกินปี 2021[772] ทั่วไปแล้วก่อนปี 2022 ทั่วโลกอาจผลิตวัคซีนระหว่างเจ็ดพันถึงหมื่นล้านโดส แต่การสั่งวัคซีนล่วงหน้าของประเทศร่ำรวยก็อาจทำให้วัคซีนไม่มีสำหรับประเทศที่ยากจน[29][779][758] หลังจากเข้าร่วมโปรแกรมโคแว็กซ์ในเดือนตุลาคม จีนก็ระบุว่าจะผลิตวัคซีน 600 ล้านโดสก่อนสิ้นปี 2020 และผลิตอีกพันล้านโดสในปี 2021 แต่ก็ไม่แน่ใจว่าจำนวนเท่าไรจะใช้ในจีนเองซึ่งมีประชากรกว่า 1,300 ล้านคน[781] ซิโนฟาร์มกล่าวว่า บริษัทอาจมีกำลังผลิตวัคซีนเกิน 1,000 ล้านโดสในปี 2021[782] โดยหุ้นส่วนในดูไบคือบริษัท G42 Healthcare ก็มุ่งจะผลิตให้ได้ถึง 100 ล้านโดสในปี 2021 ให้ใช้ในตะวันออกกลาง[783] ส่วนซิโนแว็กก็กล่าวว่า บริษัทมุ่งสร้างโรงงานที่สองให้เสร็จปลายปี 2020 เพื่อเพิ่มกำลังผลิตวัคซีน CoronaVac เป็น 600 ล้านโดสซึ่งเป็นทวีคูณจากจำนวนเดิม[784] โดยหุ้นส่วนในบราซิลคือ Instituto Butantan มีแผนจะผลิตให้ถึง 100 ล้านโดส[785] และหุ้นส่วนในอินโดนีเซียคือ Bio Farma ก็มีแผนจะผลิตให้ได้ 250 ล้านโดส[786] สถาบันเซรุ่มแห่งอินเดียมีแผนจะผลิตวัคซีนอย่างน้อย 1,000 ล้านโดส แต่ก็ระบุแล้วว่าครึ่งหนึ่งจะใช้ในอินเดีย[758] ส่วนประธานบริหารของบริษัทแอสตร้าเซนเนก้าระบุว่า "ปัญหาไม่ใช่การผลิตวัคซีนเอง มันอยู่ที่ขวดบรรจุ คือโลกไม่มีขวดบรรจุพอ"[787] เพื่อเตรียมตัวรับมือกับการสั่งขวดเป็นจำนวนมาก บริษัทผลิตภัณฑ์แก้วอเมริกันรายหนึ่งได้ลงทุน 163 ล้านดอลลาร์สหรัฐ (ประมาณ 5,100 ล้านบาท) เพื่อสร้างโรงงานผลิตขวดวัคซีน[788] แต่การมีแก้วพอและการควบคุมความปนเปื้อนก็อาจเป็นปัญหา[789] ซึ่งทำให้ค่าใช้จ่ายการผลิตสูงขึ้นและกำไรน้อยลงสำหรับผู้พัฒนาวัคซีน ในสถานการณ์ที่เรียกร้องให้วัคซีนมีราคาพอจ่ายไหว[84][758][767] วัคซีนต้องดูแลและขนส่งตามกฎควบคุมสากล ต้องรักษาไว้ที่อุณหภูมิอันแน่นอนต่าง ๆ กันแล้วแต่เทคโนโลยีของวัคซีน และต้องใช้ก่อนเสื่อมเมื่อเก็บไว้ในคลัง[758][779] โซ่อุปทานของวัคซีนโควิดคาดว่าจะมีขนาดมหึมาเพื่อให้ส่งไปยังประชากรทั่วโลกได้[29][766] สิ่งสำคัญที่ต้องเตรียมตัวการขนส่งเยี่ยงนี้รวมอุปกรณ์และคลังเก็บที่ควบคุมอุณหภูมิ โครงสร้างพื้นฐานที่เหมาะสม บุคลากรที่ได้ฝึกเพื่อให้วัคซีน และการเฝ้าติดตามอย่างระมัดระวัง[766][768][773] จะมีการใช้อาร์เอฟไอดี (การระบุตัวด้วยคลื่นวิทยุ) เพื่อติดตามและยืนยันวัคซีนของจริงโดยเริ่มจากผู้ผลิต ไปตามโซ่อุปทาน จนถึงผู้ได้วัคซีน[790]
โซ่เย็น (cold chain)วัคซีนและตัวเสริมไม่เสถียรโดยธรรมชาติเมื่ออุณหภูมิเปลี่ยน จึงทำให้ต้องมี "โซ่เย็น" (cold chain) คือมีการแช่เย็นในการขนส่งและการเก็บตลอดโซ่อุปทาน ปกติที่อุณหภูมิราว2–8 องศาเซลเซียส[778][791] เพราะวัคซีนโควิดใช้เทคโนโลยีต่าง ๆ จึงก่อปัญหาใหม่ ๆ ในการจัดการบริหารโซ่เย็น มีวัคซีนบางอย่างที่เสถียรเมื่อแช่แข็งแต่ไม่คงตัวเมื่อเจอความร้อน บางอย่างไม่ควรแช่แข็งเลย และบางอย่างเสถียรตลอดทุกอุณหภูมิ[791] ความเสียหายเหตุการแช่แข็งและการฝึกบุคลากรในพื้นที่ไม่ดีพอจึงอาจเป็นปัญหาสำคัญ[792] ถ้าวัคซีนโควิดมากกว่าหนึ่งอย่างได้อนุมัติ โซ่เย็นวัคซีนอาจต้องแก้ปัญหาความไวอุณหภูมิในระดับต่าง ๆ ข้ามประเทศต่าง ๆ ที่มีภูมิอากาศต่าง ๆ และมีทรัพยากรในพื้นที่เพื่อรักษาอุณหภูมิต่าง ๆ กัน[791] วัคซีนของซิโนฟาร์มและซิโนแว็กเป็นตัวอย่างของวัคซีนอันใช้ไวรัสที่ฆ่าแล้วซึ่งอยู่ระหว่างการทดลองระยะที่ 3 อันสามารถขนส่งโดยระบบโซ่เย็นที่มีอยู่แล้วได้ กล่าวคือสามารถแช่เย็นในอุณหภูมิระหว่าง 2–8 องศาเซลเซียส[793][794] วัคซีนอาร์เอ็นเออาจมีความยากลำบากในการผลิตในปริมาณมาก ๆ หรือรักษาไว้ไม่ให้เสื่อม คือต้องใช้ตู้แช่แข็งอุณหภูมิต่ำพิเศษเพื่อเก็บในคลังและในการขนส่ง[767] ยกตัวอย่างเช่น วัคซีนอาร์เอ็นเอของโมเดอร์นาต้องใช้โซ่เย็นเพียงแค่เหนือจุดเยือกแข็งโดยเก็บได้เป็นเวลาจำกัด แต่วัคซีนของไฟเซอร์-ไบออนเทคต้องเก็บในตู้แช่แข็งอุณหภูมิต่ำ −80 ถึง −60 องศาเซลเซียสตลอดการขนส่งจนถึงจุดให้วัคซีน[795][796] หลังจากเจาะขวดวัคซีนด้วยเข็มฉีดแล้ว ก็จะใช้ได้เพียงแค่ 6 ชม. แล้วก็ต้องทิ้งไป หน่วยบริการในพื้นที่จึงต้องบริหารการแช่แข็งและการให้วัคซีน[29][797] เพราะวัคซีนโควิดน่าจะขลาดแคลนเมื่อเริ่มใช้ในเบื้องต้น บุคลากรก็จะต้องหลีกเลี่ยงการทำของเสีย ซึ่งปกติอาจจะถึงร้อยละ 30 ของวัคซีนที่มี[765][797] โซ่อุปทานยังอาจมีปัญหากับวิธีการขนส่งวัคซีนในพื้นที่ชนบท เช่น ด้วยจักรยานยนต์หรือด้วยโดรนส่งของ กับการต้องให้วัคซีนครั้งที่สอง กับการใช้สารทำให้เจือจาง กับการเข้าถึงกลุ่มประชากรเป้าหมาย เช่น บุคลากรทางแพทย์ เด็ก และคนชรา[29][773][798] การขนส่งทางอากาศและทางบกการประสานงานเครื่องบินขนส่งระดับนานาชาติจำเป็นในการแจกจำหน่ายวัคซีนโควิดที่มีจำกัดเวลาและอุณหภูมิ แต่จนถึงเดือนกันยายน 2020 เครือข่ายขนส่งเช่นนี้ก็ยังไม่พร้อมขนส่งวัคซีนในระดับนานาชาติ[766][769][799] ประธานบริหารของสมาคมการขนส่งทางอากาศนานาชาติ (IATA) ได้กล่าวในเดือนกันยายนว่า "การขนส่งวัคซีนโควิด-19 อย่างปลอดภัยจะเป็นภาระหน้าที่ซึ่งศตวรรษหนึ่งมีครั้งเดียวของอุตสาหกรรมขนส่งทางอากาศทั่วโลก แต่นี่เป็นไปไม่ได้ถ้าไม่วางแผนล่วงหน้าอย่างระมัดระวัง ซึ่งต้องทำเดี๋ยวนี้ เราวิงวอนให้รัฐบาลเป็นผู้นำในการอำนวยการร่วมมือกันตลอดโซ่โลจิสติกส์เพื่อจัดการสิ่งอำนวยความสะดวก ความมั่นคงและปลอดภัย และกระบวนการตรวจที่ชายแดนให้พร้อมกับงานขนาดยักษ์และซับซ้อนข้างหน้านี้"[799] เพราะการลดจำนวนผู้โดยสารทางอากาศอย่างหนักในช่วงปี 2020 สายการบินต่าง ๆ จึงได้ไล่พนักงานออก ลดจุดหมายที่บริการ และนำเครื่องบินไปเก็บในโรงเก็บระยะยาว[766][799] ดังนั้น องค์กรผู้นำในการซื้อหาและแจกจำหน่ายวัคซีนโควิดภายในโปรแกรมโคแว็กซ์คือกาวีและกองทุนเพื่อเด็กแห่งสหประชาชาติ จึงกำลังเตรียมตัวส่งวัคซีนเป็นจำนวนมากที่สุดและเร็วที่สุดเท่าที่เคยมี โดยประสานงานกับบริษัทขนส่งทางอากาศนานาชาติ การควบคุมคนเข้าเมืองและการตรวจอากรสินค้า และการใช้บริการของเครื่องบินขนส่งอาจถึง 8,000 ลำเพียงแค่จะส่งวัคซีนโดสเดียวไปยังประเทศต่าง ๆ[773][799] วัคซีนสองอย่างแรก ๆ ที่ได้อนุมัติคือ Tozinameran ของบริษัทไฟเซอร์-ไบออนเทค และ mRNA-1273 ของโมเดอร์นาต้องแช่แข็งในระหว่างการขนส่ง โดยใช้ตู้บรรจุที่ออกแบบเป็นพิเศษ[C] และน้ำแข็งแห้ง แต่น้ำแข็งแห้งก็ปกติอนุญาตเป็นจำนวนจำกัดบนเครื่องบินเพราะแก๊สจากการการระเหิดอาจเป็นพิษ ในสหรัฐ องค์การบริหารการบินแห่งชาติจำกัดจำนวนน้ำแข็งแห้งสำหรับเครื่องบินโบอิง 777 เพียงแค่ 1.4 ตัน แต่ก็อนุญาตชั่วคราวให้สายการบินยูไนเต็ดแอร์ไลน์ขนส่งถึง 6.8 ตัน คือเป็นวัคซีนเกือบ 1 ล้านโดส ระหว่างกรุงบรัสเซลส์จนถึงเมืองชิคาโก อเมริกันแอร์ไลน์ โบอิง และเดลตาแอร์ไลน์ก็กำลังเพิ่มสมรรถภาพการขนส่งน้ำแข็งแห้งสำหรับเที่ยวบิน โดยสายการบินอเมริกัน เดลตา และยูไนเต็ดต่างก็มีเครือข่ายขนส่งสินค้าแช่เย็นในสหรัฐของตน ๆ ส่วนเฟดเอกซ์และยูพีเอสได้ติดตั้งตู้แช่เข็งเย็นพิเศษที่ศูนย์เครื่องบินขนส่งในยุโรปและอเมริกาเหนือ[801] ความมั่นคงปลอดภัยและคอรัปชั่นยาเป็นสินค้าปลอมที่มีค่ามากที่สุดในโลก โดยมีมูลค่าเกิน 200,000 ล้านดอลลาร์สหรัฐต่อปี (ประมาณ 6.3 ล้านล้านบาท) ซึ่งทำให้วัคซีนโควิดอันมีความต้องการอย่างยิ่งเสี่ยงถูกปลอม ถูกขโมย เสี่ยงการฉ้อฉลและการโจมตีทางไซเบอร์ (cyberattack) ตลอดโซ่อุปทาน[770][802] จนกระทั่งถึงเรียกวัคซีนว่าเป็น "ทรัพย์สินที่มีค่าที่สุดในโลก" โดยตำรวจสากลเรียกมันว่า "ทองเหลว" และเตือนถึงการมีอาชญากรรมประเภทต่าง ๆ เกิดขึ้นพร้อม ๆ กัน[803] ระบบป้องกันคอรัปชั่น การสร้างความโปร่งใส การระบุหน้าที่รับผิดชอบก็กำลังตั้งขึ้นเพื่อลดและกำจัดคอรัปชั่นเกี่ยวกับเครื่องมือเครื่องใช้ของวัคซีนโควิด[802][804] แต่การไร้กฎหมายที่มีโครงสร้างเดียวกันระหว่างประเทศต่าง ๆ การไร้สมรรถภาพทางเทคโนโลยี วัคซีนที่มีจำกัด และความไม่สามารถระบุหรือติดตามวัคซีนของจริงหรือของปลอม ก็อาจเป็นอัตรายต่อชีวิตของผู้ได้วัคซีน และอาจทำให้การระบาดทั่วของโควิดไม่สิ้นสุด[802] ดังนั้น ผู้ผลิตวัคซีนจึงใช้เทคโนโลยีติดตามเพื่อตามขวดวัคซีนไปจนตลอดโซ่อุปทาน[770] และใช้เครื่องมือดิจิตัลแบบชีวมาตร (biometric) เพื่อสร้างความปลอดภัยสำหรับวัคซีน[790][805] ในเดือนธันวาคม 2020 ตำรวจสากลเตือนว่า พวกมาเฟียอาจแทรกตัวเข้าไปในโซ่อุปทานของวัคซีนแล้วขโมยวัคซีนหรือขโมยข้อมูล หรือแม้แต่ขายชุดวัคซีนปลอม[806] อนึ่ง วัคซีนที่ต้องแช่แข็งอยู่ตลอดก็เสี่ยงต่อวินาศกรรมด้วย[803] อุปกรณ์จีพีเอสจะใช้ติดตามวัคซีนในสหรัฐ ในรัฐโคโลราโด เจ้าหน้าที่ตำรวจรัฐจะตามคุ้มครองวัคซีนที่ส่งจากท่าอากาศยานนานาชาติเดนเวอร์ไปยังศูนย์ส่งต่อวัคซีนต่าง ๆ ในรัฐ 8 แห่ง โดยแผนการขนส่งจะเก็บเป็นความลับและเจ้าหน้าที่จะอำพรางปิดบังภารกิจ[800] ธุรกิจที่เกี่ยวข้องก็ยังอาจเกิดผลกระทบด้วย นักวิเคราะห์ทางความมั่นคงปลอดภัยของบริษัทไอบีเอ็มได้ให้สัมภาษณ์กับหนังสือพิมพ์เดอะนิวยอร์กไทมส์ ว่า บริษัทเคมีภัณฑ์ปิโตรเลียมได้กลายเป็นเป้าสำหรับนักเลงคอมพิวเตอร์เพราะบทบาทสำคัญของบริษัทในการผลิตน้ำแข็งแห้ง[803] โครงสร้างพื้นฐานของชาติองค์การอนามัยโลกได้สร้างระบบบริหารวัคซีนอย่างมีประสิทธิภาพ (Effective Vaccine Management)[807] ซึ่งรวมการจัดลำดับความสำคัญเพื่อเตรียมบุคลากรทั้งประจำประเทศและส่วนภูมิภาค เตรียมสถานบริการเพื่อแจกจำหน่ายวัคซีนรวมทั้ง
กระบวนการตรวจเมื่อเข้าเมืองเพื่อให้จัดการวัคซีนและผ่านกงศุลได้อย่างมีประสิทธิภาพในประเทศแต่ละประเทศอาจรวม[775][807]
ความรับผิดชอบต่อผลิตภัณฑ์วันที่ 4 กุมภาพันธ์ 2020 เลขาธิการกระทรวงบริการทางสาธารณสุขและมนุษย์สหรัฐได้ประกาศยกเว้นความรับผิดชอบต่อผลิตภัณฑ์ที่ใช้สู้กับโควิด-19 คือ วัคซีนอะไรก็ได้ ที่ใช้รักษา วินิจฉัย ป้องกัน หรือลดอาการโควิด-19 หรือลดการแพร่เชื้อของ SARS-CoV-2 หรือของไวรัสที่กลายพันธุ์จากนั้น และระบุว่า ประกาศนี้กันการฟ้องคดีเกี่ยวกับความรับผิดชอบว่า ผู้ผลิตวัคซีนประมาทเลินเล่อ หรือแพทย์พยาบาลประมาทเลินเล่อเพราะให้ยาผิดขนาด/ผิดประเภท หากไม่ได้จงใจประพฤติไม่ชอบในหน้าที่[808] ประกาศนี้มีผลในสหรัฐจนกระทั่งถึงวันที่ 1 ตุลาคม 2024 ข้อมูลผิด ๆสื่อสังคมได้ช่วยสนับสนุนทฤษฎีสมคบคิดที่อ้างว่า วัคซีนโควิด-19 มีอยู่แล้วเมื่อจริง ๆ ยังไม่มี และจริง ๆ สิทธิบัตรที่บทความต่าง ๆ ได้อ้างผิด ๆ ก็เป็นสิทธิบัตรสำหรับลำดับดีเอ็นเอและวัคซีนป้องกันไวรัสโคโรนาสายพันธุ์อื่น ๆ เช่น ไวรัสโคโรนาโรคซาร์ส ไม่ใช่สำหรับโควิด[809][810] ในวันที่ 21 พฤษภาคม 2020 องค์การอาหารและยาสหรัฐได้แถลงการณ์ว่า ได้ยื่นคำสั่งให้หยุดและไม่กระทำอีกต่อบริษัทในเมืองซีแอตเทิลคือ North Coast Biologics ผู้ได้ขายยาซึ่งอ้างว่าเป็น "วัคซีนโปรตีน spike ของ nCoV19"[811] ดูเพิ่ม
เชิงอรรถ
อ้างอิงอ่านเพิ่ม
แหล่งข้อมูลอื่น |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||